Гипоксия плода
Из-за недостаточного снабжения кислородом плода, которое называют гипоксией, в его организме происходят неблагоприятные изменения. В общем количестве родов она составляет 10,5%.
Последствиями кислородной недостаточности являются нарушение функций организма, изменение обменных процессов. Для плода последствия от кислородной недостаточности могут быть различны. Они зависят от срока беременности. Гипоксия плода на ранних сроках беременности приводит к появлению отклонений и задерживает развитие эмбриона. В более поздние сроки беременности кислородное голодание вызывает задержку роста плода, поражение центральной нервной системы, понижение адаптационных возможностей новорожденного.
Гипоксия плода не относится к самостоятельным заболеваниям. Она является следствием разнообразных патологических процессов в организме матери, плода и в плаценте. Гипоксия плода по длительности течения делится на острую и хроническую. Острая развивается внезапно, чаще встречается при родах, чем во время беременности.
Развитию гипоксии плода способствуют множество факторов. Это могут быть заболевания матери, такие как: сердечно-сосудистые и легочные заболевания, анемия, интоксикация и другие. Это могут быть и нарушения плодово-плацентарного кровотока: гестозы, перенашивание плода, риск преждевременных родов, патологии плаценты и пуповины, различные аномалии родовой деятельности. Это могут быть и заболевания самого плода: гемолитическая болезнь или анемия, инфицирование или врожденные пороки развития, длительное сдавливание головки во время родов.
Многочисленны и механизмы развития гипоксии плода. Это могут быть: нарушения поставки кислорода к матке, снижение обменных функций плаценты, дефицит гемоглобина в организме матери, сердечно-сосудистые заболевания, нарушение кровотока.
Выраженные компенсаторные способности плода обусловлены увеличением частоты сердечных сокращений до 150-160 уд/мин, высокой кислородной емкостью крови, уникальным строением гемоглобина, особенностью кровообращения и обменом веществ плода.
Процессы обмена веществ у плода изменяются с уменьшением насыщения крови кислородом. При этом все органы и системы плода за счет компенсаторных возможностей вначале работают с повышенной активностью, однако постепенно наступает их угнетение. Усугубление течения заболевания может привести к непоправимым изменениям.
На здоровье будущего ребенка незначительная гипоксия плода обычно не влияет. Однако гипоксия плода в тяжелой форме может сопровождаться ишемией и некрозами в разных органах, последствия в этом случае могут быть необратимы.
Гипоксию плода можно попытаться выявить самостоятельно, наблюдая за изменением двигательной активности плода. Начальная стадия характеризуется неугомонностью плода, повышением частоты и силы шевелений.
Длительная или прогрессирующая гипоксия плода приводит к ослаблению его движений.
Поводом для срочной консультации у врача служит уменьшение шевелений плода до 3 раз в течение часа. Это свидетельствует о страданиях плода. В этом случае проведут дополнительное обследование околоплодных вод, кардиотокографию, допплерометрию и т.д.
В этом случае проведут дополнительное обследование околоплодных вод, кардиотокографию, допплерометрию и т.д.
Самыми точными и информативными методами оценки состояния плода являются кардиотокография и допплерометрия. Основным симптомом гипоксии плода при родах является нарушение его сердечной деятельности. Поэтому кардиомониторное наблюдение за состоянием плода широко используется в родах. Если околоплодные воды окрашиваются меконием, т.е. становятся зелеными, значит у плода может быть гипоксия. Однако, этот признак существенен только, если плод лежит головой вперед.
Если у беременной хроническая внутриутробная гипоксия плода, то ей важен покой, т.к. улучшению кровоснабжения матки весьма способствует постельный режим. Хроническую гипоксию плода лечат комплексно, уделяя при этом особое внимание основному заболеванию, которое к ней привело. Проводят терапию, призванную улучшить снабжение плода кислородом и нормализацию обменных процессов. Если эффект от комплексной терапии отсутствует, и срок беременности превышает 28 недель, то принимают решение об экстренных родах путем кесарева сечения.
За течением беременности важно наблюдать очень тщательно, чтобы предотвратить, либо вовремя диагностировать и вылечить гипоксию плода.
Современным, доступным и эффективным средством в борьбе с гипоксией является профилактическая кислородотерапия, в том числе при помощи кислородного коктейля.
Научные материалы и исследования:
Энтеральная оксигенотерапия в акушерской и гинекологической практике, Кубицкая Ю.В., Ипатова М.В. (Русский Медицинский Журнал)
Эффективность энтеральной оксигенации в комплексной профилактике и лечении ранней плацентарной недостаточности при невынашивании, Радзинский В.Е., Ордиянц И.М., Абдурахманова О.Г. (Русский Медицинский Журнал)
Оксигенотерапия в ранние сроки беременности, Радзинский В.Е., Ордиянц И.М., Абдурахманова О.Г. (Русский Медицинский Журнал)
Позвоните нам сейчас по телефону , и мы подберем Вам оптимальную комбинацию оборудования для производства кислородного коктейля!
Дополнительный кислород для беременных и для всех людей является по сути лекарством.
Перед применением обязательно проконсультируйтесь с врачом!
Признаки гипоксии плода — ГБУЗ РА «Майкопская городская клиническая больница»
Главная страница » Признаки гипоксии плода
На ранних сроках достоверно обнаружить гипоксию плода почти невозможно , её можно лишь предположить если у мамы выявляется анемия или другие болезни.
После 18-20 недель, когда малыш вовсю начинается двигаться в матке, мама может заподозрить гипоксию по уменьшению его активности . Если движения плода стали вялыми и более редкими , необходимо показаться врачу для обследования .
 КТГ склонна давать много ложно- положительных результатов, то есть выявлять гипоксию в том числе там , где её нет . В случае плохого анализа , чаще всего нужно просто переделать его на следующий день.
КТГ склонна давать много ложно- положительных результатов, то есть выявлять гипоксию в том числе там , где её нет . В случае плохого анализа , чаще всего нужно просто переделать его на следующий день.Как бороться с гипоксией ❓❓❓
На протяжении всей беременности всем будущим мамам очень важно как можно больше гулять на свежем воздухе. Это простое правило поможет вам предотвратить многие осложнения беременности в том числе и гипоксию плода . Никакие кислородные коктейли не заменят вам 3-4 часов, проведённых на свежем воздухе.
Гипоксия плода: симптомы, признаки и последствия
Во время ожидания ребенка будущая мама иногда сталкивается с диагнозами, которые вызывают тревогу. Один из них – гипоксия плода, достаточно распространенное состояние у беременных, при котором нужна квалифицированная помощь врача. Что такое гипоксия плода, чем она опасна и каковы особенности лечения?
Один из них – гипоксия плода, достаточно распространенное состояние у беременных, при котором нужна квалифицированная помощь врача. Что такое гипоксия плода, чем она опасна и каковы особенности лечения?
пятница, июня 15th, 2018
Зарегистрируйся сегодня
Получайте полезные советы и принимайте участие в тестировании продукции
Причины гипоксии плода
Гипоксия плода – состояние, при котором ребенок в утробе испытывает сильный дефицит кислорода. Хроническая гипоксия бывает при беременности, острая – во время родов.
Существует много факторов, приводящих к патологии. К ним относятся следующие причины:
- Заболевания беременной, которые появились еще до зачатия: гипертония, болезни сердца и почек, сахарный диабет, бронхиты (острого и хронического течения), бронхиальная астма.
- Патологии вынашивания: гестоз, эклампсия, многоводие, фетоплацентарная недостаточность, токсикозы, переношенная беременность.

- Заболевания плода, при котором нарушается внутриутробное развитие, наследственно-генетические отклонения (часто гипоксия плода наблюдается при гемолитической болезни).
- Вынашивание двух и больше детей.
- Стремительные или затяжные роды, отслойка плаценты, обвитие пуповиной.
Гипоксию плода иногда вызывают внешние факторы: неудовлетворительная экология, прием некоторых лекарств, химическое отравление. Риск патологии еще выше у будущих мам, которые курят и злоупотребляют алкоголем.
Каковы симптомы дефицита кислорода у ребенка?
Важно распознать признаки гипоксии плода на ранней стадии, чтобы вовремя начать лечение и предупредить развитие тяжелых нарушений.
Ярких симптомов нехватки кислорода не существует. Поэтому будущая мама должна ориентироваться на количество шевелений ребенка. Согласно нормам, он должен давать о себе знать 3 – 10 раз в день. Чем больше срок вынашивания, тем интенсивнее должны быть движения. Если же малыш в утробе затих или, наоборот, слишком активен, следует срочно обратиться в поликлинику.
Гипоксия плода: последствия и осложнения
Дефицит кислорода имеет тяжелые последствия для плода. На ранних сроках вынашивания закладываются органы и системы маленького человека. В этот период гипоксия может нарушить образование нервной системы, сердца, головного мозга, почек.
Во второй половине беременности дефицит кислорода – частая причина отклонения в развитии сердца, легких, мозга, задержки роста малыша. У новорожденного возможен маленький вес, неврологические и психические заболевания.
Гипоксия плода тяжелого течения иногда приводит к внутриутробной гибели ребенка или его смерти в первые сутки жизни. Поэтому важно знать, что делать при гипоксии плода во время беременности.
Как диагностируют патологию?
Если ближе к концу беременности женщина может следить за количеством шевелений ребенка, то в первом и начале второго триместра трудно заподозрить гипоксию. Это значит, что будущей маме следует регулярно показываться врачу.
При подозрении на гипоксию плода, акушер прослушивает частоту сердцебиения малыша. Для этого используется стетоскоп. Затем назначает следующие методики диагностирования:
Для этого используется стетоскоп. Затем назначает следующие методики диагностирования:
- УЗ-исследование. С его помощью врач изучает состав и объем околоплодных вод. Слишком большое количество жидкости, также как и недостаточное, указывает на риск развития гипоксии плода.
- Допплерометрия. Позволяет узнать скорость движения крови в сосудах плаценты и пуповины.
- Кардиотокография. С ее помощью оценивается, как часто двигается плод, и количество сокращений его сердца.
- Амниоскопия. Состояние плода определяется по цветовым характеристикам и прозрачности околоплодной жидкости.
Что делать при гипоксии плода во время беременности?
Будущей маме, в зависимости от степени патологии, назначают амбулаторное или стационарное лечение. Оно направлено на устранение причины состояния и профилактику возможных последствий. Лечение проводится комплексно, состоит из нескольких методов.
Коррекция образа жизни
Беременной необходим полный покой. Для улучшения кровотока в матке, обеспечения отдыха назначается постельный режим.
Для улучшения кровотока в матке, обеспечения отдыха назначается постельный режим.
После улучшения состояния будущей маме обычно рекомендуются физические занятия, направленные на активизацию кровотока. Хороший эффект оказывает дыхательная гимнастика, аквааэробика. Все упражнения следует делать под контролем медицинского специалиста.
Лекарственная терапия
При необходимости врач назначает беременной лекарственные средства для улучшения обменных процессов. Прием их предупреждает гипоксию плода. Обычно применяются следующие лекарства:
- Гинипрал, Магне В6 – для снижения тонуса матки;
- Но-шпа, Эуфиллин – для расширения и улучшения состояния сосудов плаценты;
- Актовегин, Трентал – для нормализации показателей крови.
Если состояние ребенка не улучшилось после проведенного консервативного лечения, на сроке после семи месяцев делают кесарево сечение.
Зная, что такое гипоксия плода, каковы ее признаки, можно вовремя заподозрить патологию. Это позволит срочно обратиться к врачу, поможет улучшить состояние ребенка, и в результате, – предупредить серьезные последствия.
Это позволит срочно обратиться к врачу, поможет улучшить состояние ребенка, и в результате, – предупредить серьезные последствия.
Похожие статьи:
Шевеление ребенка
Первые шевеления
Алкоголь и курение на ранних сроках беременности
Подробнее
Гипоксия плода. Симптомы, признаки, последствия | Капсула Жизни
Гипоксия плода – опасный патологический процесс, характеризуемый пониженным снабжением кислородом плода.
Гипоксия возникает по причине нетипичных процессов, проходящих в женском организме. Время формирования, протекания и интенсивности проявления симптомов напрямую влияют на развитие и общее состояние здоровья ребёнка. Лечение гипоксии необходимо проводить как можно раньше, чтобы болезнь не нанесла непоправимых последствий.
Гипоксия может диагностироваться на любом сроке беременности. Чем раньше возникнет внутриутробная гипоксия плода, тем более серьёзно она повлияет на развитие ребёнка (как умственное, так и физическое). Также она может нанести ущерб ЦНС, но это в случае несвоевременного или неправильного лечения. Медицинская статистика показывает, что в 10-15% из всех беременностей наблюдается кислородная недостаточность. Лечение в этом случае в первую очередь направлено на приведение в норму потока крови к матке и плаценте, но при острой гипоксии плода рекомендуется вызывать роды искусственным способом, а не применять какие-либо способы лечения.
Также она может нанести ущерб ЦНС, но это в случае несвоевременного или неправильного лечения. Медицинская статистика показывает, что в 10-15% из всех беременностей наблюдается кислородная недостаточность. Лечение в этом случае в первую очередь направлено на приведение в норму потока крови к матке и плаценте, но при острой гипоксии плода рекомендуется вызывать роды искусственным способом, а не применять какие-либо способы лечения.
Причины внутриутробной гипоксии плода – разные патологии, протекающие в материнском организме, а также неблагоприятные факторы внешней среды. Гипоксия может возникнуть из-за заболеваний:
- гипертония
- сахарный диабет
- порок сердца
- преэклампсия и эклампсия
- хронический бронхит или бронхиальная астма
- различные заболевания почек
Внутриутробные причины возникновения гипоксии:
- повреждение целостности матки
- продолжительное передавливание головы, шеи ребёнка при родах
- усложнение прохода малыша по родовому каналу, чаще всего возникает по причине больших объёмов или неправильной позы малыша
- увеличение объёма околоплодной жидкости
- беременность двумя, тремя и более плодами
- внутриутробное заражение ребёнка
- перегораживание плацентой родового прохода из матки
- обматывание пуповины вокруг шеи ребёнка
- нарушение потока крови в плаценте
Кроме этого, весомыми причинами внутриутробной гипоксии плода могут быть внешние факторы:
- плохая экология и высокая загрязнённость воздуха в том месте, где проживает будущая мать
- приём большого количества лекарственных препаратов
- отравление химическими веществами
- злоупотребление женщиной в период беременности спиртными напитками, никотином или наркотиками
По скорости протекания гипоксия делится на:
- кратковременная, т.
 е. возникает быстро и неожиданно
е. возникает быстро и неожиданно - средней тяжести – выражается непосредственно во время родов
- острая – признаки болезни наблюдаются за несколько дней до предстоящих родов
- хроническая гипоксия плода – появляется она при сильном токсикозе, несовместимости групп крови или резус-факторов матери и ребёнка, внутриутробных инфекциях плода.
По времени возникновения гипоксия делится:
- образовавшееся на первых месяцах беременности
- во второй половине из отведённого срока
- во время родов
- после родов возникает очень редко.
Определяется гипоксия довольно сложно, так как она может проявиться внезапно. Но диагностировать гипоксию очень важно именно на ранних этапах, потому что это позволит быстро начать лечение и избежать последствий.
Главным симптомом гипоксии плода является замедленное сердцебиение, но это невозможно заметить в домашних условиях. Первым признаком для консультирования у врача становится изменение интенсивности толчков плода. Каждая женщина ощущает шевеление, но если ребёнок даёт о себе знать менее трёх раз в день, следует немедленно обращаться к специалистам, потому как это свидетельствует о хронической внутриутробной гипоксии плода.
Каждая женщина ощущает шевеление, но если ребёнок даёт о себе знать менее трёх раз в день, следует немедленно обращаться к специалистам, потому как это свидетельствует о хронической внутриутробной гипоксии плода.
Острая форма, возникающая внезапно, характеризуется совершенно противоположными признаками — ребёнок чересчур активен, сильно толкается.
Признаки гипоксии плода в первые три месяца беременности очень сложно определить, поэтому для женщины и плода будет лучше проходить обследования у врача еженедельно.
Последствия гипоксии плодаПри игнорировании симптомов или при позднем обращением к врачу, гипоксия серьезно угрожает здоровью и развитию плода.
Осложнениями хронической гипоксии плода могут стать:
- нарушения развития и формирования внутренних органов, костей и головного мозга плода
- внутриклеточные отёки
- внутренние кровоизлияния
- задержка в развитии плода
Для новорождённого ребёнка последствия не менее тяжкие:
- изменения в строении и структуре некоторых внутренних органов; кровоизлияния
- неспособность самостоятельно выполнять функции, характерные для первых дней после рождения
- болезни неврологического характера
- задержка в умственном развитии
- психические отклонения
- ДЦП и аутизм
Острая и хроническая гипоксия плода может привести к смерти плода в утробе или летальному исходу ребёнка на протяжении первой недели жизни.
Определить гипоксию плода начиная с пятого месяца беременности не составит труда. Намного сложнее это сделать на первых 3-х месяцах, но чем раньше будет поставлен диагноз, тем выше вероятность избежать последствий заболевания.
Диагностика гипоксии плода состоит из:
- при помощи специальных гинекологических диагностических методик проводится оценка прозрачности, цвета и количества околоплодных вод
- допплерометрии, которая позволяет отследить скорость потока крови в пуповине и плаценте
- УЗИ
- КТГ
- прослушивания через стетоскоп частоты сердцебиения
- наблюдения за интенсивностью движений плода
При первых же проявлениях симптомов гипоксии плода беременную женщину незамедлительно госпитализируют. Первое, на что направлено лечение, это стабилизация подачи кислорода к плоду и понижение тонуса матки. Для этого пациентке назначают строгий постельный режим и приём лекарственных препаратов, которые улучшат проходимость кислорода и метаболизм. Часто также назначают оксигенотерапию и гипербарическую оксигенацию (барокамеру), что позволяет повысить оксигенацию крови не только в организме матери, но и плода.
Часто также назначают оксигенотерапию и гипербарическую оксигенацию (барокамеру), что позволяет повысить оксигенацию крови не только в организме матери, но и плода.
Когда наблюдаются первые улучшения состояния плода, женщина может выполнять гимнастику, различные дыхательные упражнения, посещать аквагимнастику. Если никакие меры для нормализации подачи кислорода к плоду не дали должного эффекта или симптомы гипоксии плода сохраняются более двадцати восьми недель беременности, лучше всего немедленно провести кесарево сечение. В случае острой гипоксии для новорождённого ребёнка необходима помощь реаниматолога.
Профилактика гипоксии плодаПрофилактику гипоксии плода должна выполнять женщина, которая решила стать матерью, а именно:
- правильно выбрать способ рождения ребёнка. При кесаревом сечении меньше шансов на возникновение гипоксии плода, чем при естественных родах
- своевременное лечение болезней, которые сопутствуют беременности
- избегать сильных физических нагрузок, только дыхательная гимнастика
- отдыхать достаточное количество времени
- рационализировать питание, путём употребления большого количества витаминов и кальция
- вести здоровый образ жизни, отказаться от алкоголя, никотина и наркотиков
- регулярно наблюдаться в женской консультации
- вовремя становиться на учёт к акушеру-гинекологу
- планировать беременность и тщательно к ней подготавливаться, путём обследования у врачей, лечения хронических, инфекционных или гинекологических заболеваний
Существует много исследований, связанных с лечением гипоксии плода. Одно из них — применение баротерапии в лечении гипоксии плода
Одно из них — применение баротерапии в лечении гипоксии плода
Другие статьи о баротерапии, оксигенотерапии и барокамерах можно почитать у нас на канале Яндекс.Дзен. Подписывайтесь → канал «Капсула Жизни» в Дзене
Наш сайт: Capsule-life.ru
Лечение кислородом для беременных и готовящихся к беременности пациенток
Лечение кислородом для беременных и готовящихся к беременности пациенток
Рождение полноценного здорового ребенка является основным желанием будущих родителей. Однако в условиях городской жизни возникают различные угрозы для вынашивания здоровой беременности. Плохая экология, чаще всего не совсем здоровое питание, поздний возраст родителей с уже сопутствующими хроническими заболеваниями. В результате у большинства мамочек наблюдается та или иная патология беременности, среди которых: снижение иммунитета матери, гипоксия плода, угроза невынашивания, задержка внутриутробного развития, гестоз, преждевременные роды, малый вес ребенка при родах. Метод ГБО прекрасно подходит в качестве реабилитации после замершей беременности на ранних сроках. Наиболее сложным контингентом пациентов являются беременные с хроническими заболеваниями, не связанными с женским здоровьем, например, с сахарным диабетом.
Метод ГБО прекрасно подходит в качестве реабилитации после замершей беременности на ранних сроках. Наиболее сложным контингентом пациентов являются беременные с хроническими заболеваниями, не связанными с женским здоровьем, например, с сахарным диабетом.
В данных случаях помимо медикаментозного лечения крайне показано лечение кислородом под повышенным давлением в барокамере (метод гипербарической оксигенации). В результате лечения снижается или полностью уходит кислородное голодание всех тканей и органов, происходит их активное заживление и восстановление.
Как проводится процедура и насколько она комфортна? Процесс лечения проходит в комфортной обстановке, совершенно безболезненный и не доставляет никаких неудобств пациенту. Женщину в хлопчатобумажной одежде помещают в камеру, куда подается кислород под определенным давлением. Давление рассчитывается индивидуально, исходя из патологии, возраста и индивидуальных особенностей.
Во время набора давления, а также при его снижении возможна небольшая заложенность в ушах. Длительность процедуры составляет около часа и чаще всего пациенты сладко спят.
Длительность процедуры составляет около часа и чаще всего пациенты сладко спят.
Специально проведенные медицинские исследования показали, что лечение методом ГБО способствует улучшению состояния плода при внутриутробной гипоксии и маловесности плода, нормализации маточно-плацентарного кровотока, улучшению состояния плаценты на ранних сроках фетоплацентарной недостаточности, корректируется уровень гормонов, отвечающих за нормальное течение беременности, улучшается состояние беременных женщин с поздними гестозами, анемией, уменьшается количество осложнений во время родов со стороны матери и плода. Кроме того, после курса лечения улучшалось общее состояние: исчезали одышка и отеки, улучшался сон, нормализовались показатели крови. Отмечено увеличение размеров плода в среднем на 2-3 гестационные недели. ГБО снижает число перинатальных осложнений, преждевременных родов и перинатальной заболеваемости. У детей, рожденных от матерей, которые получали лечение ГБО, отмечалось более крепкое здоровье и реже наблюдались «проблемы» с неврологией.
Метод ГБО прекрасно стабилизирует состояние беременных с диагнозом сахарный диабет. Известно, что сахарный диабет оказывает крайне неблагоприятное действие на течение беременности, формирующийся плод и новорожденного. Беременность, в свою очередь, отягощает данное заболевание и вызывает его прогрессирование. При диабете довольно часто наступает внутриутробная гибель плода, преждевременное прерывание беременности и тяжелый токсикоз. Исследования показали, что после 5-6 сеансов в барокамере видна положительная динамика, стабилизируется уровень гипергликемии, нормализуются показатели крови, улучшается микроциркуляция.
Помимо помощи беременным женщинам, гипербарическая оксигенация помогает и женщинам с воспалительными заболеваниями яичников и маточных труб, а также хроническим эндометриозом. Применение ГБО в комплексе с терапией снижает риск развития спаечного процесса и трубного фактора бесплодия. Немаловажно и то, что действие ГБО не заканчивается после проведенного курса лечения. В организме образуется депо кислорода и на протяжении 4-6 месяцев ощущается прилив сил и бодрости. Даже здоровым жителям столицы полезно 1-2 раза в год пройти курс профилактического лечения в барокамере из-за высокой загазованности города.
В организме образуется депо кислорода и на протяжении 4-6 месяцев ощущается прилив сил и бодрости. Даже здоровым жителям столицы полезно 1-2 раза в год пройти курс профилактического лечения в барокамере из-за высокой загазованности города.
Особенно приятно, что каждый столичный житель может пройти процедуру гипербарической оксигенации в нашей больнице по полису ОМС.
УЗИ с доплером при беременности
Своевременная диагностика нарушений состояния плода позволяет вовремя провести соответствующее лечение, определить тактику ведения беременности. Однако обычными клиническими методами достоверно установить эти состояния не всегда можно. В настоящее время разработаны специальные методы диагностики состояния плода во время беременности. Из них одним из основных является УЗИ при беременности, обладающее высокой информативностью, а так же безвредностью для матери и плода.
С помощью УЗИ при измерении плода можно выявить несоответствие измеряемых размеров плода нормативным для данного срока беременности, что свидетельствует о нарушении жизнедеятельности плода и наличии синдрома задержки развития.
При благоприятном течение беременности у здоровых женщин обычно проводится 3 плановых сеанса УЗИ, соответственно триместрам беременности. В случаях выявления отклонений от нормы, развития осложнений беременности, а также у женщин с тяжелыми заболеваниями (сахарный диабет, заболевания почек, сердца и т.п.) УЗИ при беременности выполнятся чаще, что позволяет своевременно обнаружить отклонения от нормы и отследить динамику выявленных изменений. При проведении планового УЗИ в 30-34 недели обязательным компонентом обследования является допплерометрия (доплер).
Известно, что одним из основных факторов, приводящих к нарушению внутриутробного развития плода, являются нарушения кровообращения в системе мать-плацента-плод. Доплер дает возможность оценить реальное состояние кровоснабжения плаценты и матки, то есть маточно-плацентарный кровоток, и состояние плода. При допплерометрии обычно изучают состояние кровообращения в сосудах матки, пуповины и плода (аорта, среднемозговая артерия).
Как правило, плановый доплер назначают в начале третьего триместра. Однако важно помнить, что важным преимуществом УЗИ с доплером при беременности является возможность прогнозировать развитие таких серьезных осложнений как гестоз, СЗРП, внутриутробная гипоксия плода. А это, соответственно, позволяет провести своевременную адекватную профилактику в каждом конкретном случае.
Поэтому в группах риска первое проведение УЗИ с допплером желательно на сроках 20 — 24 недели беременности. Обследование на этих сроках необходимо проводить в группах риска по развитию таких осложнений беременности, как гестоз, внутриутробная гипоксия и задержка развития плода. Если есть необходимость, допплер может быть назначена в любые сроки беременности.
Показания к проведению УЗИ с доплером при беременности:
- Со стороны матери (сахарный диабет, артериальная гипертензия, заболевания почек, седечно-сосудистой системы, гестоз)
- Со стороны плода (многоплодная беременность, маловодие, синдром задержки внутриутробного развития плода — СЗРП, преждевременное созревание плаценты)
-
Отягощенный акушерский анамнез (сведения, полученные от женщины о предыдущих беременностях) – внутриутробная гибель плода, СЗРП, гестоз.

Акушеры-гинекологи ГС-клиники могут предложить Вам весь комплекс современного обследования плода при беременности.
Важность кислорода при беременности. Кислородное голодание плода
Беременность — ответственный и одновременно сложный период в жизни женщины. Теперь она должна еще более тщательно заботиться о своем здоровье: отказаться от вредных привычек, чередовать активность с отдыхом, выбирать только полезные продукты питания, употреблять витамины. Также в этот период организму женщины нужно получать больше кислорода.
Зачем беременной женщине кислород?
На протяжении девяти месяцев в ее организме происходят удивительные перемены. Будущая мама несет ответственность сразу за два организма, поэтому у нее увеличивается количество циркулируемой крови, а значит, требуется большее количество кислорода, чем прежде. Он нормализует процессы обмена в организме, обеспечивает правильное усвоение питательных веществ, помогает плоду получать необходимые вещества и развиваться здоровым и крепким.
Гипоксия плода (кислородное голодание)
Если беременная не получает достаточного количества кислорода, развитие ребенка может происходить с серьезными нарушениями. Как выявить недостаток этого газа? Подсказкой может стать анемия — низкий уровень гемоглобина в крови — у будущей матери. Именно с помощью гемоглобина в оргнизме происходит кислородный обмен, поэтому необходимо восстанавливать его с помощью препаратов, содержащих железо. На более поздних сроках нехватка кислорода может проявиться в виде повышенной или, наоборот, пониженной двигательной активности ребенка. При появлении первых подозрений лучше попросить помощи у специалистов. Они проведут обследование и определят нарушения. Специалисты обратят внимание на следующие показатели:
- Вес и размер плода. В случае серьезных отклонений будут назначены новые исследования и лечение.
- Нарушение сердечного ритма. Замедленное сердцебиение — признак продолжительной патологии, указывающий на то, что плод больше не может поддерживать нормальный кровоток во внутренних органах.
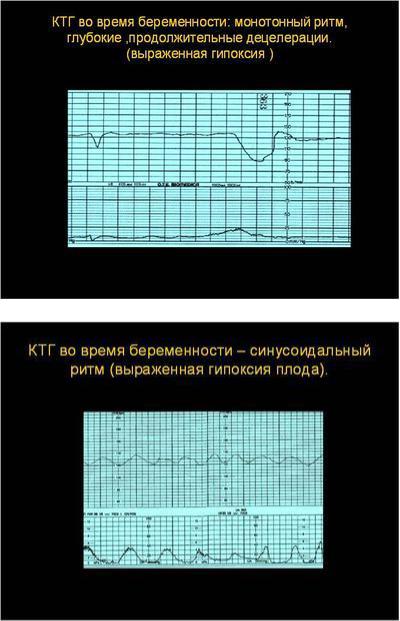
- Снижение активности плода на последних неделях беременности. Явный признак недостатка кислорода, который является поводом для беспокойства, тщательного изучения и постоянного контроля.
Причины гипоксии
Они могут быть связаны как с состоянием здоровья женщины, так и положением плода в утробе:
- Низкий уровень гемоглобина у беременной.
- Заболевания дыхательной системы, препятствующие попаданию кислорода в организм.
- Сердечные заболевания и патологии сосудов.
- Различные хронические заболевания (например, диабет или почечная недостаточность).
- Инфекции мочеполовой системы.
- Многоплодная беременность.
- Курение, употребление алкоголя или наркотиков.
- Недостаток или переизбыток околоплодных вод.
Неправильное положение плода и обвитие пуповиной провоцирует снижение кровообращение, а перенашивание или долгие роды могут вызвать гипоксию. В этом случае врачам следует предотвратить удушье и помочь младенцу появиться на свет.
Последствия
Они зависят от периода возникновения гипоксии и ее продолжительности. Например, в первые недели она грозит задержкой развития: органы и мозг формируются с опозданием, есть большой риск развития внутренних пороков. Из-за гипоксии, возникшей во время, родов малыш может родиться слабым, с угрозой развития серьезных заболеваний в будущем. Есть риск летального исхода. Своевременное вмешательство врачей и качественное лечение помогут восстановить дыхательную функцию плода и предотвратят развитие серьезных заболеваний.
Откуда брать кислород?
Будущая мать должна придерживаться здорового образа жизни: подобрать диету с идеальным содержанием полезных веществ, следить за своим самочувствием, избегать стрессовых ситуаций, быть физически активной.
Каким образом можно получать большее количество кислорода? Есть несколько простых условий:
- Выполнение дыхательных упражнений. Предполагается использование диафрагмы во время вдохов, живот при этом надувается, а плечи опущены.
 Так организм получит больше кислорода. Дыхательные упражнения можно делать лежа на спине.
Так организм получит больше кислорода. Дыхательные упражнения можно делать лежа на спине. - Физические тренировки. Укрепление бицепсов, трицепсов и плеч с помощью гантелей, упражнения для ног, плавание, йога или аквааэробика для беременных, а также пешие прогулки улучшат циркуляцию крови и насытят организм кислородом.
- Консультация со специалистом. Врач подберет наиболее подходящие методы получения кислорода с учетом самочувствия беременной и состояния плода. Если назначенное лечение не решит проблему, возможно, придется обратиться к методу кесарева сечения.
Еще один способ получить жизненно необходимый газ — использовать кислородный концентратор. Этот аппарат выделяет молекулы газа из атмосферы, концентрирует их и подает в виде чистого вещества. Используется для профилактики кислородной недостаточности, а также для приготовления коктейлей. Малогабаритные портативные модели можно устанавливать дома или на рабочем месте.
Каждой женщине желательно пройти обследования еще на этапе планирования ребенка. Это позволит выявить наличие хронических или инфекционных заболеваний и пройти лечение еще до зачатия. В качестве профилактики можно купить кислородный концентратор. Тогда повысится вероятность зачать и родить абсолютного здорового малыша.
Это позволит выявить наличие хронических или инфекционных заболеваний и пройти лечение еще до зачатия. В качестве профилактики можно купить кислородный концентратор. Тогда повысится вероятность зачать и родить абсолютного здорового малыша.
Скидка 12% на комплекты оборудования!!! Ваш купон: AIRMAMA
*Копируйте код купона и введите код в корзине, при оформлении заказа.
**Предложение действительно до 31.12.2019г.
Гипоксия плода — обзор
Неонатальная асфиксия
Хроническая внутриутробная асфиксия влияет на кровоток в плаценте, а инфаркт плаценты отрицательно влияет на рост плода. В случае хронической внутриутробной асфиксии роды могут плохо переноситься, и может потребоваться реанимация новорожденных. Когда требуется реанимация новорожденных, первичные или вторичные последствия асфиксии, включая ацидоз, судороги, преходящую сердечную дисфункцию (например, кардиомиопатию или трикуспидальную недостаточность), легочную гипертензию, почечную недостаточность (напр. g., острый тубулярный некроз), желудочно-кишечные / печеночные инсульты (например, некротический энтероколит [NEC]) или нарушения свертывания крови .
g., острый тубулярный некроз), желудочно-кишечные / печеночные инсульты (например, некротический энтероколит [NEC]) или нарушения свертывания крови .
Послеродовая асфиксия часто является результатом ряда внутриутробных событий, но она также может быть вызвана событиями, происходящими во время родов. Механизмы контроля дыхания у незрелых детей могут предрасполагать новорожденных, особенно недоношенных, к опасным для жизни реакциям на асфиксию. Например, реакция на гипоксию в течение первых 3-4 недель жизни может быть парадоксальной, поскольку гипоксия вызывает короткий период гиперпноэ, за которым следует брадипноэ (Cross and Oppe, 1952; Brady and Ceruti, 1966).Гипотермия и гиперкапноэ притупляют начальное гиперпноэ (Ceruti, 1966; Rigatto et al., 1975). Респираторная реакция на углекислый газ усиливается как в постнатальном, так и в гестационном возрасте (см. Главу 3, Респираторная физиология у младенцев и детей) (Rigatto et al., 1975).
Хотя гипоксия может иметь долгосрочные последствия для плода и новорожденного, гипероксия также может вызывать серьезные осложнения, особенно у недоношенных детей. Например, гипероксия поражает недоношенных детей, особенно рожденных до 32 недель ‘ беременность, к значительному риску ретинопатии недоношенных (ROP; см. ниже) и, в некоторых случаях, слепоты (см. главу 27, Анестезия для офтальмологической хирургии) (Sylvester, 2008).В норме Pao 2 плода составляет от 20 до 30 мм рт. После рождения Pao 2 60 мм рт. Ст., Вероятно, гипероксичен для младенцев, рожденных в возрасте от 24 до 36 недель ‘; беременность. Чтобы избежать последствий окислительного стресса у новорожденных, сатурация кислорода для недоношенных детей обычно поддерживается в пределах от 88% до 93% (Pao 2 от 45 до 60 мм рт. Ст.) В отделении интенсивной терапии, и аналогичные уровни Sao 2 составляют уместно в операционной. Непрерывное измерение Sao 2 облегчает поддержание желаемого насыщения кислородом.Следует отметить одного недоношенного ребенка, у которого никогда не было повышенного Pao 2 , кроме как в операционной, но у которого развилась ROP после операции (Betts et al.
Например, гипероксия поражает недоношенных детей, особенно рожденных до 32 недель ‘ беременность, к значительному риску ретинопатии недоношенных (ROP; см. ниже) и, в некоторых случаях, слепоты (см. главу 27, Анестезия для офтальмологической хирургии) (Sylvester, 2008).В норме Pao 2 плода составляет от 20 до 30 мм рт. После рождения Pao 2 60 мм рт. Ст., Вероятно, гипероксичен для младенцев, рожденных в возрасте от 24 до 36 недель ‘; беременность. Чтобы избежать последствий окислительного стресса у новорожденных, сатурация кислорода для недоношенных детей обычно поддерживается в пределах от 88% до 93% (Pao 2 от 45 до 60 мм рт. Ст.) В отделении интенсивной терапии, и аналогичные уровни Sao 2 составляют уместно в операционной. Непрерывное измерение Sao 2 облегчает поддержание желаемого насыщения кислородом.Следует отметить одного недоношенного ребенка, у которого никогда не было повышенного Pao 2 , кроме как в операционной, но у которого развилась ROP после операции (Betts et al. , 1977).
, 1977).
Внутриутробная гипоксия — обзор
Физиология допплеровской велоциметрии
При гипоксии плода или других формах стресса развиваются отклонения формы волны скорости плода. Хотя систолический компонент отражает интенсивность сердечной функции плода, диастолический компонент , кривых скорости плода имеет наибольшее значение при оценке состояния плода, поскольку он отражает величину периферического сопротивления, которое нижнее сосудистое русло оказывает сердцу.По мере увеличения периферического сопротивления скорость кровотока во время сердечной диастолы уменьшается. Таким образом, плод с инфарктом плаценты и связанным с этим повышением внутриплацентарного сопротивления демонстрирует со временем возрастающее систолическое отношение к диастолическому. Если сопротивление возрастает достаточно высоко, кровоток в диастоле может полностью прекратиться. В крайних случаях может наблюдаться обратный диастолический поток. Многие исследователи сообщали о связи отсутствия конечных диастолических скоростей (AEDV) в пупочной артерии с ЗВУР, аспирацией мекония, внутриутробной гибелью плода и асфиксией при рождении.
При беременности, осложненной ЗВУР, от двух третей до трех четвертей плодов демонстрируют чрезмерно высокий индекс плацентарного сопротивления (систолическое / диастолическое соотношение или индекс сопротивления) (Trudinger et al, 1991). Плоды с аномальной формой волны скорости кровотока имеют более высокую частоту неонатальной заболеваемости, чем плоды с нормальными результатами исследования.
Гистологически высокое сопротивление плаценты, о чем свидетельствует аномальная форма волны доплеровского кровотока в пуповине, связана с уменьшением количества мелких (диаметром <90 мкм) артерий в третичных ворсинах плаценты (сосуды сопротивления) (Giles et al, 1985) облитерирующие изменения остальных сосудов.
Нарушения скорости кровотока могут возникать в других сосудистых руслах у плода, страдающего гипоксемией. Когда уровень кислорода в пуповинной венозной крови падает, мозговое кровообращение компенсируется увеличением кровотока в сонных артериях. Соответственно, при прогрессирующей гипоксии внутримозговое сосудистое сопротивление обычно падает, а диастолическая скорость увеличивается. Скорость потока в нисходящей аорте, снабжающей большинство внутренних органов плода, может быть нарушена.Уровень внутриутробной гипоксемии в любой момент времени можно лучше всего выразить как сумму воздействий на пупочное, церебральное и аортальное кровообращение.
Скорость потока в нисходящей аорте, снабжающей большинство внутренних органов плода, может быть нарушена.Уровень внутриутробной гипоксемии в любой момент времени можно лучше всего выразить как сумму воздействий на пупочное, церебральное и аортальное кровообращение.
Поскольку связь сердца плода с плацентарным, церебральным и висцеральным кровообращением находится в динамическом состоянии потока во время беременности, показатели формы волны скорости плода должны быть скорректированы с учетом гестационного возраста. Нормативные таблицы для индекса пульсации и систолического-диастолического отношения были опубликованы Schulman и соавторами (1984).
Нарушения формы волны скорости плода (особенно диастолические изменения) обычно становятся очевидными за 1-3 недели до появления аномалий других клинических параметров, таких как частота сердечных сокращений плода, объем околоплодных вод и АД плода. Во время беременности кровоток в матке заметно увеличивается с минимальным сопротивлением вследствие воздействия эстрогена на кровообращение в матке. На достаточно ранних сроках беременности можно задокументировать кривые скорости плода в маточно-плацентарной циркуляции, а при некоторых материнских заболеваниях, таких как хроническая гипертензия и гипертензия, вызванная беременностью, могут быть задокументированы отклонения в кривых скорости плода в маточно-плацентарной фазе.Фактически, Кэмпбелл и соавторы (1986) отметили аномалии маточно-плацентарного кровообращения примерно с 20 недель беременности, при которых развились тяжелые ЗВУР или гипертензия, вызванная беременностью.
На достаточно ранних сроках беременности можно задокументировать кривые скорости плода в маточно-плацентарной циркуляции, а при некоторых материнских заболеваниях, таких как хроническая гипертензия и гипертензия, вызванная беременностью, могут быть задокументированы отклонения в кривых скорости плода в маточно-плацентарной фазе.Фактически, Кэмпбелл и соавторы (1986) отметили аномалии маточно-плацентарного кровообращения примерно с 20 недель беременности, при которых развились тяжелые ЗВУР или гипертензия, вызванная беременностью.
Дистресс плода :: Американская ассоциация беременных
Исторически термин дистресс плода использовался для описания того, когда плод не получает достаточного количества кислорода во время беременности или родов. Часто это обнаруживается по аномальной частоте сердечных сокращений плода.Однако, хотя термин «дистресс плода» широко используется, он не имеет четкого определения. Это затрудняет постановку точного диагноза и правильное лечение. Из-за двусмысленности термина его использование может привести к неправильному обращению.
Из-за двусмысленности термина его использование может привести к неправильному обращению.
Дистресс плода: диагностика, состояния и лечение
Дистресс плода обычно путают с термином асфиксия при рождении. Асфиксия при рождении возникает, когда ребенок не получает достаточного количества кислорода до, во время или после родов.Это может иметь несколько причин, некоторые из которых включают низкий уровень кислорода в крови матери или снижение кровотока из-за сжатия пуповины.
Поскольку многие неправильно использовали фетальный дистресс и родовую асфиксию как взаимозаменяемые термины, Комитет по акушерской практике Американского конгресса акушеров и гинекологов (ACOG) выразил озабоченность по поводу использования этих двух терминов. ACOG рекомендует заменить термин «дистресс плода» на «неутешительный статус плода».
Наряду с этим новым термином ACOG рекомендует врачам добавить к диагнозу список дополнительных результатов, таких как тахикардия плода, брадикардия, повторяющиеся переменные замедления, низкий биофизический профиль и поздние замедления. Комитет ACOG по акушерской практике также заявил, что термин асфиксия при рождении больше не следует использовать, поскольку он слишком расплывчатый диагноз для медицинского использования.
Комитет ACOG по акушерской практике также заявил, что термин асфиксия при рождении больше не следует использовать, поскольку он слишком расплывчатый диагноз для медицинского использования.
Диагностика дистресс-синдрома плода
Для врачей важно следить за состоянием плода на протяжении всей беременности, чтобы выявить возможные осложнения.Одним из наиболее широко используемых методов мониторинга является электронный мониторинг частоты сердечных сокращений плода (FHR).
Преимущества мониторинга FHR включают:
- Способность распознавать развитие гипоксии (когда плод не получает достаточного количества кислорода) путем анализа паттернов частоты сердечных сокращений плода
- Возможность следить за схватками матери
- Возможность контролировать реакцию плода на гипоксию
- Более положительный результат для родов с высоким риском
Тем не менее, мониторинг ЧСС также сопряжен с рисками, включая повышенную вероятность кесарева сечения из-за неправильной интерпретации результатов мониторинга ЧСС.
Заболевания плода
Потенциальные предвестники дистресса плода или неутешительного состояния плода могут включать:
Лечение
Основное лечение, используемое для неутешительного состояния плода, — это внутриматочная реанимация. Это поможет предотвратить ненужные процедуры.
Некоторые средства внутриматочной реанимации включают:
- Изменение положения матери
- Обеспечение хорошего увлажнения матери
- Обеспечение матери адекватным кислородом
- Амниоинфузия (введение жидкости в амниотическую полость для облегчения сдавления пуповины)
- Токолиз (терапия, используемая для отсрочки преждевременных родов путем временного прекращения схваток)
- Гипертоническая декстроза для внутривенного введения
Тем не менее, есть случаи, когда необходимо экстренное кесарево сечение.Однако из-за чрезмерного диагноза дистресса плода и потенциальной неправильной интерпретации частоты сердечных сокращений плода рекомендуется подтвердить диагноз потенциального дистресса плода с помощью кислотно-основного исследования крови плода. В целом это состояние указывает на важность дородового ухода и надлежащего наблюдения за матерью и плодом на протяжении всей беременности.
Хотите узнать больше?
Составлено на основе следующих источников:
Комитет ACOG по акушерской практике. (2005).Неуместное использование терминов дистресс плода и асфиксия при рождении. Заключение Комитета, 326.
Бекманн, К. Р. Б., Линг, Ф. У., Барзанский, Б. М., Герберт, В. Н. П., Лаубе, Д. У., и Смит, Р. П. (2010). Акушерство и гинекология (6-е изд.). Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс.
Баклин, Б. А., Азартные игры, Д. Р., Улоди, Д. Дж. (2009). Практический подход к акушерской анестезии. Гравли, Г. П. (Ред.). Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс.
Каур, Дж., & Каур, К. (2012). Состояния, вызывающие дистресс плода. Анналы биологических исследований, 3 (10). Получено с https://scholarsresearchlibrary.com/ABR-vol3-iss10/ABR-2012-3-10-4845-4851.pdf
Mayo Clinic. (2012). Биофизический профиль: зачем это нужно .
Руководства Merck. (н.о.) Поражение плода .
Американский конгресс акушеров и гинекологов (ACOG). (2013, 22 октября). акушеры-гинекологи пересматривают значение термина «доношенная беременность».
Детская больница Сан-Франциско Бениофф при Калифорнийском университете.(нет данных). Асфиксия при рождении . Получено с https://www.ucsfbenioffchildrens.org/conditions/birth_asphyxia/
Плацентарная гипоксия на ранних сроках беременности вызывает материнскую гипертензию и плацентарную недостаточность на модели гипоксической морской свинки1 | Биология размножения
Аннотация
Хроническая гипоксия плаценты является одной из первопричин плацентарной недостаточности, которая приводит к преэклампсии и гипертонии матери. Хроническая гипоксия вызывает нарушение развития трофобластов (ТБ), инвазию в децидуальную оболочку матери и ремоделирование спиральных артерий матери.Беременная морская свинка имеет несколько общих характеристик с людьми, таких как гемомонохориальная плацента, ворсинчатая субплацента, глубокая инвазия туберкулеза и ремоделирование материнских артерий, и является идеальной животной моделью для изучения развития плаценты. Мы предположили, что хроническая гипоксия плаценты беременной морской свинки подавляет инвазию ТБ и изменяет ремоделирование спиральной артерии. Спарившиеся беременные морские свинки подвергались либо нормоксии (NMX), либо трем уровням гипоксии (HPX: 16%, 12% или 10,5% O 2 ) с 20 дней беременности до среднесрочных (39-40 дней) или доношенных. (60–65 дней).В срок, HPX (10,5% O 2 ) повысил артериальное давление матери (HPX 57,9 ± 2,3 по сравнению с NMX 40,4 ± 2,3, P <0,001), снизил вес плода на 16,1% ( P <0,05), и увеличили как абсолютный, так и относительный вес плаценты на 10,1% и 31,8% соответственно ( P <0,05). В среднесрочной перспективе наблюдалось значительное увеличение пролиферации ТБ в плаценте HPX, что подтверждалось повышенным окрашиванием PCNA и KRT7 и повышенной экспрессией гена ESX1 (маркер TB) ( P <0.05). Кроме того, количественный анализ изображений показал снижение инвазии кровеносных сосудов матери туберкулезными клетками. Таким образом, эта животная модель плацентарного HPX выявляет несколько аспектов аномального развития плаценты, включая усиление пролиферации ТБ и снижение миграции и инвазии ТБ в спиральные артерии, последствия которых связаны с материнской гипертензией и задержкой роста плода.
Введение
Соответствующий тканевый кислородный баланс (O 2 ) важен для нормального развития плаценты.Некоторые условия, такие как проживание на большой высоте, материнское заболевание (цианотическая болезнь сердца), анемия, инфекция и хроническое воспаление [1], могут привести к снижению кровоснабжения и притока O 2 и плацентарной недостаточности [2]. Аномальная функция плаценты проявляется в изменении эндокринной функции и / или транспорта питательных веществ и может привести к ряду заболеваний — от маленьких для гестационного возраста детей до состояний матери, таких как преэклампсия (ПЭ). ПЭ является одной из основных причин заболеваний и смерти матери и ребенка [3] и часто проявляется в виде гипертонии, сосудистого воспаления, отека и протеинурии [4] у матери и асимметричного ограничения роста у плода [5].Даже несмотря на то, что гипоксия плаценты (HPX) причастна к плацентарным нарушениям и задержке роста плода (FGR), роль O 2 в развитии плаценты и дифференцировке трофобластов (TB) остается неясной. Понимание молекулярных основ плацентарной дисфункции, вызванной HPX, является ключом к определению причинных факторов плацентарной недостаточности, материнской гипертензии, вызванной беременностью, и FGR [6].
При беременности у человека развитие плаценты начинается при имплантации эмбриона, за которым следует регулируемый набор событий, включая пролиферацию ТБ и миграцию в децидуальную оболочку, кульминацией которой является инвазия и ремоделирование спиральных артерий матери [7].На ранних стадиях имплантации эмбриона пролиферация и миграция ТБ происходят в условиях низкого содержания O 2 в децидуальной оболочке матери [7]. За этим следует ремоделирование спиральной артерии матери при инвазивном туберкулезе, усиление кровоснабжения и оксигенации плаценты [7, 8]. Роль O 2 в опосредовании дифференциацию ТБ и эндоваскулярного вторжение является спорным из-за конфликтующих в пробирке результаты, показывающие, что низкий O 2 условия способствуют распространению туберкулеза и уменьшение вторжения в клеточной культуре [9-11], в то время как другие показали, что гипоксические условия (1% O 2 ) увеличивают инвазию культивируемых клеток HRT-8 / Svneo через матригель [12, 13].Эти противоречивые результаты указывают на ограничения упрощенной системы in vitro, отсутствие взаимодействия с материнскими децидуальными клетками и сложной микросредой, которая существует в модели на животных. Еще одно правдоподобное объяснение — это различия в исходных типах клеток ТБ, которые могут находиться на разных стадиях дифференцировки.
У людей патологии плаценты обычно возникают в первом триместре беременности и не выявляются до последнего триместра. Хотя исследования терминальной плаценты позволяют исследовать последствия болезни, они не предоставляют средств для изучения патогенеза болезни.Кроме того, у доношенной плаценты отсутствует плацентарное ложе, что исключает возможность исследования места патогенеза. Эти ограничения требуют исследования заболеваний плаценты до срока и предпочтительно на ранних стадиях плаценты. В то время как беременный павиан является лучшим суррогатом человека для изучения развития плаценты [14], беременная морская свинка представляет собой менее дорогую и идеальную альтернативу из-за близкого сходства с плацентой человека [14–17]. Подобно людям, морская свинка имеет гемомонохориальную плаценту и демонстрирует характерное глубокое проникновение в децидуальную оболочку матери (ограничение в большинстве моделей грызунов) [7].Плацента морской свинки состоит из нескольких долек с материнским артериальным каналом в центре, окруженных одним слоем синцитиотрофобласта плода. Лабиринтные доли представляют собой отдельные единицы кровообращения плода и матери, встроенные в перфузируемую материнскую межлобную оболочку, истощающую лабиринт материнской крови. Уникальной особенностью плаценты морской свинки является субплацента, которая представляет собой сильно сложенное производное оболочки TB, состоящее из клеточного слоя TB, аналогичного клеточным столбцам закрепляющих ворсин хориона плаценты человека [17].В субплаценте растет популяция туберкулеза, которая проникает в эндометрий матери и прослеживается в интерстиции, кровеносных сосудах и миометрии. В дополнение к организации плаценты, беременная морская свинка также имитирует человека, имея профиль материнского прогестерона, который не снижается в срок [14], а также характеристики роста плода (т.е. скорость роста и накопления жира / белка) и относительные показатели. зрелость на момент рождения [14, 15, 18].
В настоящем исследовании модель беременной морской свинки использовалась для изучения реакции плаценты на устойчивый HPX и оценки влияния измененного развития плаценты на фенотипы матери и плода на поздних сроках беременности.Мы предположили, что хроническое снижение уровней O 2 во время развития плаценты нарушает переходный процесс цитотрофобластов от пролиферативного к инвазивному подтипу, тем самым изменяя ремоделирование спиральной артерии и, в конечном итоге, вызывая плацентарную недостаточность и потенциальные симптомы ЛЭ.
Материалы и методы
Поколение гипоксических животных, модель
Все процедуры на животных с использованием морских свинок были одобрены Комитетом по институциональному уходу и использованию животных Университета Мэриленда в соответствии с процедурами, аккредитованными Международной ассоциацией по оценке и аккредитации лабораторных животных.Успешная беременность определялась при пальпации, которая проявлялась в виде твердой шишки диаметром 1 см на 20–23 день беременности [19]. Беременных морских свинок содержали либо в помещении с воздухом (нормоксия [NMX], n = 10), либо в камере, содержащей 16% (n = 4), 12% (n = 5) или 10,5% O 2 (n = 10) HPX на 28–30-й день беременности; каждый из них содержался в соответствующей среде на протяжении всей беременности. У морских свинок инвазия ТБ в маточно-плацентарные артерии плаценты начинается примерно на 3 неделе беременности [19].Мы выбрали время воздействия HPX на мать через несколько дней, чтобы обеспечить успешную имплантацию, но достаточно рано, чтобы повлиять на инвазивный процесс. Уровень HPX при 10,5% O 2 был выбран на основе уровня O 2 , которому естественным образом подвержены высокогорные (3500–4500 м) популяции с риском PE и FGR [20], и минимальный уровень воздействия предотвратить прерывание беременности морской свинки. Кроме того, как мы сообщали ранее, воздействие 10,5% O 2 снижает насыщение материнской артерии O 2 с 97.От 7% до 66,1% (NMX по сравнению с HPX, соответственно) [21], что вызывает HPX плода, о чем свидетельствуют повышенные уровни сердечного белка HIF1 (индуцируемый гипоксией фактор-1) плода [22] и окрашивание гипоксипробом печени плода [23]. Потребление пищи матерью (г / день / кг матери), потребление воды (мл / день / кг матери) и прибавка в весе матери (г / день) измерялись каждые 2 дня в течение последних 14 дней беременности (50–64 дня беременности). беременность). Беременные морские свинки, как NMX, так и HPX, были прерваны незадолго до родов (срок = 65 дней беременности) с выявлением тазового разделения на 1 см.Отдельная группа животных подвергалась воздействию 10,5% O 2 на 28–30-й день беременности, а плаценты и плод были извлечены на 40-й день беременности для оценки эффектов HPX в среднесрочной перспективе. Кроме того, небеременные самки морских свинок подвергались воздействию NMX (n = 8) или HPX (10,5% O 2 , n = 8) в течение той же продолжительности (35 дней), что и беременные животные, и служили в качестве контроля.
Измерение артериального давления
Материнское артериальное давление крови как NMX, так и HPX (16%, 12%, 10.5% O 2 ) беременных морских свинок измеряли в срок (n = 4–10; четыре группы) до извлечения плода. Артериальное давление у небеременных морских свинок-самок измеряли аналогичным образом через 35 дней воздействия 10,5% O 2 HPX или NMX. Животных анестезировали (кетамин, 80 мг / кг внутрибрюшинно [i.p.] и ксилазин, 1 мг / кг внутрибрюшинно), гепаринизировали, и канюлю вводили в правую плечевую артерию для измерения кровяного давления. Систолическое артериальное давление (САД), диастолическое артериальное давление (ДАД) и среднее артериальное давление (САД) регистрировались в системе сбора данных (ADInstruments) и анализировались с использованием ADInstruments Chart версии 4.2 программное обеспечение.
Экстракция тканей и мочи
Материнские (сердце и почки) и плодные органы (сердце, мозг, печень и почки) были извлечены после терминальной анестезии у доношенных беременных животных NMX и HPX. Были измерены абсолютные веса органов плода, и относительные веса были нормализованы к их соответствующему весу тела (дополнительная таблица S1; дополнительные данные доступны на сайте www.biolreprod.org). Аналогичным образом, плаценты экстрагировали как из NMX, так и из HPX на 40-й и 65-й день беременности животных, взвешивали и хранили при -80 ° C до использования для анализа экспрессии генов.Материнская моча собиралась шприцем из мочевого пузыря во время извлечения органов плода из NMX (n = 6) и HPX (10,5% O 2 , n = 6) морских свинок (65 дней беременности; подгруппа животных использовалась для измерить артериальное давление) и сразу заморозить. Общий белок измеряли методом Брэдфорда, нормализованным по уровням креатинина (Cayman Chemicals).
Иммуногистохимия
Для изучения морфологии плаценты кровеносных сосудов матери в среднесрочной перспективе, NMX и HPX (10.5% O 2 ) животных (40 дней беременности, n = 3 в каждой группе) фиксировали перфузию 4% параформальдегидом на материнской стороне после катетеризации маточной артерии и дренирования маточной вены. Фиксированные плаценты заливали парафином по стандартному протоколу. Иммуногистохимию проводили на срезах размером 5 мкм, подвергнутых индуцированному нагреванием извлечению антигена при 95 ° C в течение 20 мин в 10 мМ Трис, 1 мМ этилендиаминтетрауксусной кислоте, pH 9,0, промытых в TBST (20 мМ Трис, 150 мМ NaCl и 0.1% твин, pH 7,4), блокировали с помощью Dako Protein Block, а затем инкубировали с первичными антителами (цитокератин 7 / KRT7, PCNA, актин гладких мышц, фактор фон Виллебранда; дополнительная таблица S2) в течение ночи при 4 ° C. На следующий день срезы промывали TBST и инкубировали со вторичными антителами (антителами, конъюгированными с флуорофором или ферментом, т.е. щелочной фосфатазой [AP] или пероксидазой хрена [HRP]) в течение 1 часа при комнатной температуре. Для иммунофлуоресценции срезы инкубировали со следующими вторичными антителами, разведенными в TBST — Alexa Fluor 488 козьими антителами против мышиных IgG2a (1: 500) и / или Alexa Fluor 568 козьими антителами против кроликов (1: 500) — затем слайды монтировали с Prolong -Gold Antifade Mount с 4 ‘, 6-диамидино-2-фенилиндолом (DAPI) (Life Technologies), окрашивающее ядра.Для ферментативной иммуногистохимии срезы инкубировали со следующими вторичными антителами, разведенными в TBST: козьим антимышиным IgG2a, конъюгированным с HRP (1: 100), и козьим антителом против кролика, конъюгированным с AP (1: 100). Набор субстратов VECTOR Blue Alkaline Phosphatase Substrate (Vector Laboratories) использовали для колориметрического обнаружения вторичных антител AP, а набор субстратов DAB-Plus (Invitrogen) использовали для обнаружения вторичных антител HRP в соответствии с инструкциями производителей. Затем срезы контрастировали с помощью Nuclear Fast Red (Sigma-Aldrich) для окрашивания ядер и затем помещали в среду ImmunoHistomount (Abcam).Во всех экспериментах проводили отрицательные контроли, в которых не использовали первичные антитела.
Чтобы продемонстрировать местный плацентарный HPX, гипоксипроб-1 (пимонидазола гидрохлорид, набор Hypoxyprobe-1; Chemicon) вводили (80 мг / кг, внутрибрюшинно) одной беременной морской свинке с NMX и HPX (10,5% O 2 ). на 40 день беременности за 90 мин. Животных анестезировали и плаценту извлекали, фиксировали и заделывали для иммунофлуоресцентного окрашивания восстановленных аддуктов пимонидазола для обнаружения плацентарного HPX.Аддукты пимонидазола, которые образуются в условиях ткани O 2 с уровнем <10 мм рт. Ст. [24], были исследованы с использованием антитела к гипоксипробу-1 (полный протокол см. В дополнительных методах).
Гистологические исследования плаценты
Для получения изображений всей плаценты срезы ткани 5 мкм были окрашены гематоксилином и эозином (H&E) с помощью стандартных процедур, и несколько изображений 1,8 × были захвачены и собраны в одно изображение с высоким разрешением с помощью Adobe Photoshop.Площади были измерены вручную с помощью инструмента выделения от руки и функции расчета площади программного обеспечения ImageJ (Национальные институты здравоохранения). Чтобы уменьшить вариабельность и устранить предвзятость пользователей, все измерения были выполнены по три раза двумя отдельными людьми. Площадь усредняли для трех плацент из каждой группы лечения.
Количественная ОТ-ПЦР тканей плаценты
Плаценты 40 дней и 65 дней беременности морских свинок NMX и HPX (10,5% O 2 ) использовали для измерения уровней мРНК выбранных генов.Тотальную РНК выделяли из замороженных тканей с помощью TRIzol (Life Technologies) в сочетании с реагентами RNeasy Mini Kit (Qiagen), а ДНК удаляли с помощью набора TURBO DNA-free (Ambion). Два микрограмма общей РНК подвергали обратной транскрипции с использованием системы синтеза первой цепи Superscript III (Invitrogen) со случайными гексамерными праймерами в соответствии с протоколом производителя. Количественную ПЦР в реальном времени проводили с использованием SYBR Green PCR Master Mix (Life Technologies) в системе ПЦР в реальном времени Applied Biosystems 7500 с использованием специфичных для генов праймеров (дополнительная таблица S3).Сравнительный метод ΔCT [25] был использован для анализа изменений экспрессии генов между группами лечения. Было от пяти до шести биологических повторов и два технических повтора ПЦР для каждого образца плаценты из четырех групп лечения, которые включали NMX (n = 5) и HPX (10,5% O 2 , n = 6) на 40-й день беременности и NMX. (n = 5) и HPX (10,5% O 2 , n = 5) на 65 день беременности.
Статистический анализ
Данные выражены как среднее ± SEM.Сравнение между группами проводилось с использованием однофакторного дисперсионного анализа рангов с обработкой HPX в качестве независимой переменной. Если было обнаружено, что средние значения среди множественных сравнений различаются ( P <0,05), для анализа отличий от контролей NMX применяли апостериорный тест Данна для неравных чисел образцов. Для сравнения массы тела плода и массы плаценты для сравнения были включены все плоды и плаценты из пометов четырех групп лечения. Для гистологического анализа и анализа экспрессии генов отдельные плаценты из одного помета были выбраны для анализа как репрезентативные для помета и представляют собой n = 1.Статистические сравнения MAP и веса плода и плаценты выполняли с помощью программного обеспечения SigmaStat, а сравнения данных ПЦР в реальном времени анализировали с помощью непарного теста t с использованием программного обеспечения Prism 7 с использованием метода обобщенной линейной модели PROC.
Результаты
Влияние HPX на материнские параметры
Было измерено артериальное давление крови у беременных и небеременных животных у морских свинок, подвергшихся воздействию NMX или трех различных уровней условий HPX (рис.1А). У беременных животных САД, САД и ДАД были значительно повышены ( P <0,05) при 10,5% O 2 HPX по сравнению с контролем NMX (САД: 57,9 ± 2,3 против 40,4 ± 2,3; САД: 65 ± 2,8. по сравнению с 47,0 ± 2,4; ДАД: 50,6 ± 1,9 против 34,5 ± 2,1 мм рт. ст. для HPX при 10,5% O 2 по сравнению с NMX, соответственно) (рис. 1A и дополнительный рис. S1). Однако MAP у беременных животных, подвергшихся воздействию 12% или 16% O 2 HPX, не был значительно повышен. Аналогичным образом, 10,5% O 2 HPX не приводило к повышенному MAP (50.9 ± 2,6 мм рт. Ст. Против 47,6 ± 2,6 мм рт. Ст., HPX и NMX, соответственно) у небеременных животных.
Рис. 1
Влияние системной гипоксии (HPX) на самку морской свинки, плаценту и плод. A ) Влияние HPX на среднее артериальное кровяное давление (MAP) небеременных и беременных (срок беременности 65 дней) морских свинок. Значения MAP небеременных самок морских свинок (NMX, открытая полоса, n = 8; HPX, закрытая полоса, n = 8, 10,5% O 2 ) показаны слева и беременных морских свинок (NMX , n = 10) и HPX (16%, n = 4; 12%, n = 5; 10.5%, n = 10) справа. На рисунке звездочка (*) указывает на P <0,05 по сравнению с беременными NMX. Абсолютный вес плода ( B ) и вес плаценты (г) ( C ) и относительный вес плаценты (соотношение масса плаценты / масса тела плода) ( D ) показаны для нормоксических (NMX, открытая полоса, n = 36) и гипоксические (HPX, штриховые столбцы, 16%, n = 12; 12%, n = 15; и 10,5% O 2, n = 38) животных. Значения были получены от всех плодов пометов от беременных животных.На рисунке звездочка (*) указывает P <0,05 по сравнению с контролями NMX. E ) Иммунофлуоресцентное окрашивание гипоксипроба-1 (пимонидазол-флуоресцентный, зеленый) и DAPI (синее ядерное окрашивание) NMX и HPX (10,5% O 2 ) плаценты на 40 днях беременности. Плацента HPX (200 ×) демонстрирует флуоресцентное окрашивание цитотрофобластов по всему лабиринту, тогда как плацента NMX не показывала флуоресцентного окрашивания ни в одном из просматриваемых срезов. Эритроциты идентифицируются как оранжевая флуоресценция в просвете кровеносных сосудов.В качестве отрицательного контроля использовали мышиную сыворотку, которая не показывала флуоресцентного окрашивания (не показано).
Рис. 1
Влияние системной гипоксии (HPX) на самку морской свинки, плаценту и плод. A ) Влияние HPX на среднее артериальное кровяное давление (MAP) небеременных и беременных (срок беременности 65 дней) морских свинок. Значения MAP небеременных самок морских свинок (NMX, открытая полоса, n = 8; HPX, закрытая полоса, n = 8, 10,5% O 2 ) показаны слева и беременных морских свинок (NMX , n = 10) и HPX (16%, n = 4; 12%, n = 5; 10.5%, n = 10) справа. На рисунке звездочка (*) указывает на P <0,05 по сравнению с беременными NMX. Абсолютный вес плода ( B ) и вес плаценты (г) ( C ) и относительный вес плаценты (соотношение масса плаценты / масса тела плода) ( D ) показаны для нормоксических (NMX, открытая полоса, n = 36) и гипоксические (HPX, штриховые столбцы, 16%, n = 12; 12%, n = 15; и 10,5% O 2, n = 38) животных. Значения были получены от всех плодов пометов от беременных животных.На рисунке звездочка (*) указывает P <0,05 по сравнению с контролями NMX. E ) Иммунофлуоресцентное окрашивание гипоксипроба-1 (пимонидазол-флуоресцентный, зеленый) и DAPI (синее ядерное окрашивание) NMX и HPX (10,5% O 2 ) плаценты на 40 днях беременности. Плацента HPX (200 ×) демонстрирует флуоресцентное окрашивание цитотрофобластов по всему лабиринту, тогда как плацента NMX не показывала флуоресцентного окрашивания ни в одном из просматриваемых срезов. Эритроциты идентифицируются как оранжевая флуоресценция в просвете кровеносных сосудов.В качестве отрицательного контроля использовали мышиную сыворотку, которая не показывала флуоресцентного окрашивания (не показано).
Гистологический анализ материнских почек не выявил патогенеза в клубочках HPX по сравнению с животными NMX, соответственно (дополнительный рисунок S2). Кроме того, не было значимой разницы в соотношении белок / креатинин в моче (n = 6 в каждой группе; 0,184 ± 0,034 против 0,212 ± 0,044 мг белка / мг креатинина). Среднее потребление пищи (50,8 ± 3,9 против 49,5 ± 4,0 г / сут / кг, NMX против HPX соответственно), потребление воды (208.7 ± 33,0 по сравнению с 231,0 ± 36,8 мл / день / кг, NMX по сравнению с HPX, соответственно) и увеличение веса матери (12,6 ± 2,3 против 15,9 ± 6,5 г / день, NMX по сравнению с HPX, соответственно) не были значимыми. различается у животных NMX и HPX (10,5% O 2 ).
Влияние HPX на параметры плода
Воздействие на мать 10,5% O 2 HPX (но не 12% или 16% O 2 ) привело к снижению веса плода ( P <0,05) на 16,1% по сравнению с контролем NMX (рис.1B и дополнительная таблица S1), но увеличились ( P <0,05) как абсолютная, так и относительная масса плаценты на 10,1% и 31,8%, соответственно (рис. 1, C и D, и дополнительная таблица S1). Однако уменьшение веса плода или увеличение абсолютного или относительного веса плаценты не наблюдалось в условиях 12% или 16% O 2 (рис. 1, C и D, и дополнительная таблица S1). Гипоксипробный анализ подтвердил, что воздействие материнского HPX (10,5% O 2 ) на 40-й день беременности индуцировало местный тканевый HPX в плаценте морской свинки, который отсутствовал в контроле NMX (рис.1E). Средний размер помета одной беременной морской свинки колеблется от трех до четырех детенышей в помете (3,7 ± 0,2 для NMX, 3,0 ± 0,6 для HPX 16% O 2 , 3,2 ± 0,4 для HPX 12% O 2 и 3,5 ± 0,2 для HPX 10,5% O 2 ).
Воздействие HPX оказало переменное и асимметричное воздействие на вес органов плода (мозг, сердце, печень и почки). Хронический 10,5% O 2 HPX привел к уменьшению ( P <0,05) веса мозга и печени плода (дополнительная таблица S1). Однако относительный вес (отношение веса органов к весу плода) печени плода уменьшился, тогда как мозг и сердце плода увеличились ( P <0.05) с HPX (10,5% O 2 ). Абсолютный или относительный вес почек оставался неизменным при всех обработках HPX. В относительно мягких условиях HPX, в частности, при 16% и 12% O 2 , только абсолютная масса мозга плода продемонстрировала значительное снижение при 12% O 2 условиях ( P <0,05; дополнительная таблица S1).
Влияние HPX на морфологию среднесрочной (40 дней) плаценты
Плаценты NMX и HPX (10,5% O 2 ), собранные на 40-й день беременности, исследовали на предмет морфологии субплаценты и лабиринта, а также инвазии ТБ в зоне соединения.Субплацента представляет собой ворсинчатую структуру (рис. 2) и является источником инвазивного ТБ в плаценте морской свинки, заметной на 40-й день беременности, но исчезающей в срок [26]. Иммунофлуоресцентное окрашивание актина гладких мышц (SMA) (зеленый; рис. 2A), который окрашивает материнские кровеносные сосуды и децидуальные клетки, в плацентах NMX (верхний ряд) и HPX (нижний ряд) выявило заметное расширение зоны соединения в материнская децидуальная оболочка 10,5% O 2 HPX животных. С материнской стороны плаценты HPX претерпевали усиленный децидуальный ответ, что приводило к расширению зоны соединения (рис.2, A и B, и дополнительный рис. S3). Изображения с низким (рис. 2A) и высоким (рис. 2B) увеличением показывают чистую пролиферацию децидуальных клеток, содержащих эозинофильную цитоплазму, выстилающую миометрий (дополнительный рис. S3) в HPX (видимой как четкая и широкая граница в зоне соединения. ) по сравнению с плацентой NMX.
Рис.2
Влияние гипоксии (HPX) на соединительную зону (JZ) и децидуальную оболочку нормоксической (NMX) и гипоксической (HPX, 10,5% O 2 ) плаценты морской свинки на 40-й день беременности (срок = 65 дней беременности).В A и D иммунофлуоресцентное окрашивание плаценты NMX и HPX идентифицируется для актина гладких мышц (SMA), который окрашивает кровеносные сосуды и децидуальные клетки на участках миометрия (M), децидуальной оболочки матери, JZ и субплаценты. (SP). В плаценте HPX был замечен увеличенный слой децидуальных клеток в JZ по сравнению с плацентой NMX. Панели ( B , C [NMX] и E , F [HPX]) показывают изображения с низким ( B , E ) и высоким ( C , F ) увеличением с сохранением изображения. для децидуальных стромальных клеток — SMA (коричневый) и KRT7-положительные клетки TB (синий).Обратите внимание на увеличенную популяцию SMA-положительных стромальных клеток, указывающую на усиление реакции децидуализации у HPX-животных ( E , F ). Полосы = 1000 мкм ( A , D ), 500 мкм ( B , E ) и 100 мкм ( C , F ).
Рис.2
Влияние гипоксии (HPX) на соединительную зону (JZ) и децидуальную оболочку нормоксической (NMX) и гипоксической (HPX, 10,5% O 2 ) плаценты морской свинки на 40-й день беременности (срок = 65 дни беременности).В A и D иммунофлуоресцентное окрашивание плаценты NMX и HPX идентифицируется для актина гладких мышц (SMA), который окрашивает кровеносные сосуды и децидуальные клетки на участках миометрия (M), децидуальной оболочки матери, JZ и субплаценты. (SP). В плаценте HPX был замечен увеличенный слой децидуальных клеток в JZ по сравнению с плацентой NMX. Панели ( B , C [NMX] и E , F [HPX]) показывают изображения с низким ( B , E ) и высоким ( C , F ) увеличением с сохранением изображения. для децидуальных стромальных клеток — SMA (коричневый) и KRT7-положительные клетки TB (синий).Обратите внимание на увеличенную популяцию SMA-положительных стромальных клеток, указывающую на усиление реакции децидуализации у HPX-животных ( E , F ). Полосы = 1000 мкм ( A , D ), 500 мкм ( B , E ) и 100 мкм ( C , F ).
В субплацентарной области определение одноядерных KRT7-положительных ТБ (синий) и SMA (коричневый; рис. 3A) выявило заметное сужение кровеносных пространств в плаценте HPX. Как показано на рисунке 3B, наблюдалась тенденция к увеличению площади субплаценты как доли от общей площади плаценты (плацента плюс лабиринт; фиг.3B) в плаценте HPX. Сужение кровяных пространств и увеличение площади субплаценты является следствием значительно увеличенной ( P <0,05) пролиферации KRT7-положительных мононуклеарных клеток ТБ, о чем свидетельствует окрашивание пролиферативного маркера PCNA (рис. 3, C и D). Окрашивание как KRT7-положительных ТБ (красный, средняя панель; рис. 3C), так и маркера пролиферирующих клеток PCNA (зеленый, правая панель; рис. 3C) увеличивалось в субплаценте плаценты HPX (рис. 3D). В лабиринтной области HPX вызывал расширение кровеносных каналов, на что указывало увеличение диаметра материнских артериальных каналов (рис.3, E и F).
Рис.3
Гистологическая и иммуногистохимическая оценка нормоксической (NMX) и гипоксической (HPX, 10,5% O 2 ) плаценты (субплаценты, A — D ; и лабиринта, E — F ) на 40 сутки беременности. A ) Типичные H&E полные изображения плаценты NMX и HPX показаны в верхней части рисунка. На приведенных ниже изображениях ( A ) определение стоимости KRT7-положительных ТБ (синий), актина гладких мышц (SMA, коричневый) и ядер (розовый) показывает повышенную пролиферацию ТБ и сужение кровеносных сосудов в субплаценте гвинейского HPX. свиньи. B ) Морфометрический анализ площади субплаценты, нормализованной к площади лабиринта (процент двоичной площади) для плаценты NMX (черная полоса, n = 3) и HPX (серая полоса, n = 3). C ) В субплаценте окрашивание H&E (левые панели) и иммунофлуоресценция используются для идентификации KRT7-позитивных TB (красный), SMA (зеленый), DAPI (ядра, синий, средние панели) и пролиферации в цитотрофобластах (PCNA , зеленый, правые панели). D ) Количественный анализ изображений показывает увеличение как KRT7 (TB), так и PCNA (пролиферация) (* P <0.05) окрашивание субплаценты HPX (черные полосы) по сравнению с плацентой NMX (серые полосы). E ) Влияние HPX на морфологию лабиринта в плаценте NMX и HPX. Репрезентативные полные изображения плаценты NMX и HPX (слева), H&E (в центре) и флуоресцентного окрашивания (справа) KRT7-положительных ТБ (красный), SMA (зеленый) и DAPI / ядер (синий) показывают расширение кровеносных пространств в плаценте HPX. F ) Показан морфометрический анализ материнских артериальных каналов (MAC) в HPX (черные столбцы) по сравнению с NMX (серые столбцы), нормализованных к площади лабиринта.
Рис.3
Гистологическая и иммуногистохимическая оценка нормоксической (NMX) и гипоксической (HPX, 10,5% O 2 ) плаценты (субплаценты, A — D ; и лабиринта, E — F — F ) на 40 день беременности. A ) Типичные H&E полные изображения плаценты NMX и HPX показаны в верхней части рисунка. На приведенных ниже изображениях ( A ) определение стоимости KRT7-положительных ТБ (синий), актина гладких мышц (SMA, коричневый) и ядер (розовый) показывает повышенную пролиферацию ТБ и сужение кровеносных сосудов в субплаценте гвинейского HPX. свиньи. B ) Морфометрический анализ площади субплаценты, нормализованной к площади лабиринта (процент двоичной площади) для плаценты NMX (черная полоса, n = 3) и HPX (серая полоса, n = 3). C ) В субплаценте окрашивание H&E (левые панели) и иммунофлуоресценция используются для идентификации KRT7-позитивных TB (красный), SMA (зеленый), DAPI (ядра, синий, средние панели) и пролиферации в цитотрофобластах (PCNA , зеленый, правые панели). D ) Количественный анализ изображений показывает увеличение как KRT7 (TB), так и PCNA (пролиферация) (* P <0.05) окрашивание субплаценты HPX (черные полосы) по сравнению с плацентой NMX (серые полосы). E ) Влияние HPX на морфологию лабиринта в плаценте NMX и HPX. Репрезентативные полные изображения плаценты NMX и HPX (слева), H&E (в центре) и флуоресцентного окрашивания (справа) KRT7-положительных ТБ (красный), SMA (зеленый) и DAPI / ядер (синий) показывают расширение кровеносных пространств в плаценте HPX. F ) Показан морфометрический анализ материнских артериальных каналов (MAC) в HPX (черные столбцы) по сравнению с NMX (серые столбцы), нормализованных к площади лабиринта.
Одной из основных функций инвазивного ТБ является ремоделирование материнских артерий. В 40-дневной плаценте NMX KRT7-положительные клетки были идентифицированы в кровеносных сосудах, выстилающих просвет как в проксимальных, так и в дистальных материнских артериях (фиг. 4 и дополнительные фиг. S4 и S5). В плаценте HPX практически не было KRT7-положительных клеток, расположенных внутри материнских кровеносных сосудов. Несмотря на то, что некоторые KRT7-положительные клетки были замечены в сосудах ближе к субплаценте, не было обнаружено окрашивания KRT7 в стенках сосудов, расположенных близко к миометрию и дистальным артериям, а также не было никаких свидетельств расширения просвета плаценты HPX.Вместо этого наблюдалось повышенное количество SMA-положительных децидуальных стромальных клеток, выстилающих кровеносные сосуды, и меньшее количество KRT7-положительных цитотрофобластных клеток (фиг.4 и дополнительные рисунки S4 и S5). Количественный анализ изображений нескольких образцов (полученный из рисунка 4 и дополнительного рисунка S4; NMX и HPX, n = 3) показал уменьшение отношения KRT7 к сигналу фактора фон Виллебранда (нормализованному к SMA; дополнительный рисунок S6) в соединительная зона HPX-плаценты, что указывает на то, что HPX оказывает ингибирующее действие на способность вневорсинчатых TBs проникать и ремоделировать эндотелиальную выстилку материнских спиральных артерий в соединительной зоне.
Рис.4
Влияние HPX на эндоваскулярную инвазию трофобластами (TBs) проксимальных (верхние панели) и дистальных (нижние панели) сосудов в нормоксической (NMX) и гипоксической (HPX, 10,5% O 2 ) плаценте в возрасте 40 лет. дни беременности (срок = 65 дней беременности). TB и актин гладких мышц (SMA) идентифицируются (средние панели) с помощью KRT7-положительного (синий) и коричневого колориметрического окрашивания, соответственно. TB (положительный KRT7, красный), SMA (зеленый) и эндотелиальные клетки (EC, фактор фон Виллебранда, белый) были идентифицированы иммунофлуоресцентным окрашиванием (правые панели).Во всех просматриваемых срезах было явное отсутствие как колориметрического синего (положительный KRT7), так и иммунофлуоресцентного красного (положительный KRT7).
Рис. 4
Влияние HPX на эндоваскулярную инвазию трофобластами (TBs) проксимальных (верхние панели) и дистальных (нижние панели) сосудов в нормоксической (NMX) и гипоксической (HPX, 10,5% O 2 ) плаценте при 40 дней беременности (срок = 65 дней беременности). TB и актин гладких мышц (SMA) идентифицируются (средние панели) с помощью KRT7-положительного (синий) и коричневого колориметрического окрашивания, соответственно.TB (положительный KRT7, красный), SMA (зеленый) и эндотелиальные клетки (EC, фактор фон Виллебранда, белый) были идентифицированы иммунофлуоресцентным окрашиванием (правые панели). Во всех просматриваемых срезах было явное отсутствие как колориметрического синего (положительный KRT7), так и иммунофлуоресцентного красного (положительный KRT7).
Влияние HPX на экспрессию гена плаценты
Мы исследовали влияние хронического материнского HPX (10,5% O 2 ) на экспрессию гена плаценты на 40-й (среднесрочный) и 65-й (доношенный) дни беременности по сравнению с контрольными NMX (рис.5, А и Б). Среднесрочные и доношенные плаценты подвергались воздействию HPX в течение 15 и 40 дней соответственно. Это предоставило средства для оценки того, как экспрессия гена плаценты отличается от продолжительности HPX по сравнению с его контролем NMX соответствующего возраста. 1,4-кратное изменение считалось пороговым уровнем для повышающей или понижающей регуляции (пунктирная линия), а значения P <0,05 (*) и P <0,01 (**) считались статистически значимыми (рис. 5, A и Б).
Рис.5
Влияние гипоксии (HPX, 10,5% O 2 ; n = 6, 40 дней; n = 6, 65 дней) на экспрессию мРНК плаценты по сравнению с нормотоксическим препаратом соответствующего возраста (NMX, n = 5 для каждого гестационного возраста). ) контролирует. A ) Показаны кратные изменения экспрессии специфических для плаценты генов, вызванные HPX, по сравнению с контрольными NMX возрастными группами при среднесрочной (40 дней, светло-серые столбцы) и доношенной (65 дней, темно-серые полосы) беременности. Данные нормализованы по эндогенному бета-актину и выражены относительно NMX. Пунктирная линия обозначает 1.4-кратное изменение, одинарная или двойная звездочка обозначает статистическую разницу P <0,05 или P <0,01 от контроля NMX, соответственно. B ) В таблице показаны изменения направления (стрелки), полученные из данных экспрессии гена слева, а также идентификация роли каждого гена.
Рис. 5
Влияние гипоксии (HPX, 10,5% O 2 ; n = 6, 40 дней; n = 6, 65 дней) на экспрессию мРНК плаценты по сравнению с нормотоксичными по возрасту (NMX, n = 5). для каждого срока беременности). A ) Показаны кратные изменения экспрессии специфических для плаценты генов, вызванные HPX, по сравнению с контрольными NMX возрастными группами при среднесрочной (40 дней, светло-серые столбцы) и доношенной (65 дней, темно-серые полосы) беременности. Данные нормализованы по эндогенному бета-актину и выражены относительно NMX. Пунктирная линия указывает на 1,4-кратное изменение, одинарная или двойная звездочка обозначает статистическое отличие P <0,05 или P <0,01 от контроля NMX, соответственно. B ) В таблице показаны изменения направления (стрелки), полученные из данных экспрессии гена слева, а также идентификация роли каждого гена.
В среднесрочной перспективе HPX увеличил экспрессию специфичного для плаценты транскрипта, ESX1, и фактора роста плаценты ( PGF ), в то время как экспрессия синцитина ( ERVW1 ), маркера синцитиотрофобласта и основного подтипа ТБ в лабиринте, была уменьшилось (рис. 5А). Это согласуется с повышенной пролиферацией и сниженной дифференцировкой, наблюдаемой в субплацентарной и лабиринтной зонах с HPX (Рис. 3) в середине беременности. Экспрессия HAND1, гигантского маркера клеток ТБ, не претерпевала значительных изменений под действием HPX ни в среднесрочные, ни в ближайшие сроки беременности.Маркеры, характерные для ПЭ и пораженной плаценты, такие как FLT и PAPPA , были значительно увеличены в HPX, тогда как PTGS2, маркер простагландинсинтазы, был снижен. Другие маркеры, такие как фактор роста эндотелия сосудов ( VEGF ), катехол-O-метилтрансфераза ( COMT ) и тканевой фактор ( TF, фактор свертывания крови), существенно не отличались от контроля, хотя и имели тенденцию к снижению выражение.
В срок (65 дней беременности) плаценты HPX (10,5% O 2 ) демонстрировали повышенные уровни мРНК для VEGF, PGF, и ESX1 по сравнению с контрольными NMX, что объясняет компенсаторное увеличение абсолютного или относительного веса плаценты при сроке (рис. 5, А и Б). Экспрессия HAND1 повышалась, в то время как экспрессия ERVW1 не затрагивалась. Хронический HPX приводил к снижению уровней экспрессии PAPPA, PTGS2, и COMT , повышению уровня фактора свертывания крови (TF) и не влиял на уровни FLT .Таким образом, длительное воздействие HPX индуцировало компенсаторные изменения в экспрессии гена плаценты, на что указывало увеличение VEGF и PGF и снижение PAPPA, PTGS2, и COMT .
Обсуждение
Морская свинка имеет гемомонохориальную и лабиринтообразную плаценту и состоит из отдельных долей, каждая из которых имеет независимое кровообращение [27]. Отличительной чертой плаценты морской свинки является сильно сложенная и ворсинчатая оболочка ТБ, называемая субплацентой.Подплацента аналогична заякоренным ворсинкам плаценты человека и является источником инвазивных клеток ТБ [27, 28]. Во время нормального развития плаценты локальный тканевый HPX в децидуальной оболочке матери стимулирует быстрое распространение ТБ и пассивную миграцию ТБ из субплаценты. По мере прогрессирования васкулогенеза происходит усиление натяжения ткани и фенотипическое переключение TBs с пролиферативного на инвазивный подтип [29], что завершается инвазией материнских спиральных артерий и ремоделированием сосудов [30].В настоящем исследовании материнский HPX генерировал устойчивый плацентарный HPX и предотвращал развитие сосудов и ремоделирование спиральной артерии. Плацентарный ответ на депривацию O 2 — усиление пролиферации туберкулеза и субплацентарной площади, расширение децидуальной оболочки и соединительной зоны, неремоделированные материнские спиральные артерии в соединительной зоне, компенсаторное увеличение объема кровеносных пространств в лабиринте и увеличение в общей массе плаценты.
Хронический 10,5% O 2 HPX увеличивал САД, ДАД и САД у беременных животных, но не влиял на артериальное давление у небеременных животных.Воздействие HPX у матери на кровяное давление связано с серьезностью проблемы HPX, поскольку уровни не были значительно повышены до 10,5% O 2 HPX. Это связано с наличием гипоксической плаценты, что было подтверждено окрашиванием гипоксипробом, и отсутствием повышения артериального давления у небеременных морских свинок в результате HPX. В соответствии с результатами этого исследования, HPX, как сообщается, ингибирует ремоделирование маточной артерии и снижает сосудорасширяющую реактивность на поток изолированных артерий беременных морских свинок, находящихся на большой высоте, но не влияет на артерии небеременных морских свинок [31, 32] .Несколько механизмов могут объяснять вызванное HPX повышение артериального давления, которые включают увеличение маточно-плацентарного сосудистого сопротивления в результате плохого ремоделирования сосудов и / или высвобождения вазоактивных факторов из плаценты в кровоток матери [33], или и того, и другого. При ПЭ хорошо известно высвобождение сосудосуживающих факторов, таких как растворимый FLT1, ангиотензин II, норэпинефрин и другие, из плаценты в кровоток матери [6, 34]. Однако модель морской свинки не имитирует симптомы, подобные ПЭ, о чем свидетельствует отсутствие почечной дисфункции и клубочкового эндотелиоза [6, 34].Кроме того, остается неясным, выделяют ли плаценты HPX сосудосуживающие вещества для учета материнской гипертензии в текущем исследовании. Несмотря на это, вполне вероятно, что оба механизма снижения перфузии плаценты и ремоделирования маточно-плацентарных сосудов [35] могут способствовать повышению материнского кровяного давления у животных с HPX. Данные этого исследования указывают на то, что плохое ремоделирование сосудов является вероятным фактором повышения артериального давления. Однако высвобождение вазоконстрикторных факторов, продуцируемых плацентой HPX [6], наряду со сдвигом эндотелиальной выстилки спиральной артерии, может высвобождать компоненты мембраны в материнское кровообращение [20], что не исследовалось в этом исследовании, что способствует увеличению системного сосудистого сопротивление и артериальное давление.
Доношенная плацента морской свинки HPX претерпела компенсаторный рост в течение беременности. Увеличение как абсолютного, так и относительного веса плаценты указывает на адаптивный ответ на снижение оксигенации. Это может быть связано с увеличением объема ткани плаценты, вызванным HPX [36], а также увеличением как кровеносных пространств, так и диаметров сосудов в лабиринте. Другие сообщили об увеличении [37, 38], снижении [39] и отсутствии изменений [36, 40] в массе плаценты при использовании HPX, что указывает на различия в тяжести гипоксии, сроках беременности и видах животных.Несмотря на увеличенную массу плаценты, масса тела плода снижена по сравнению с контрольной группой NMX, что явно указывает на неэффективность плаценты. Фетальные морские свинки HPX демонстрировали асимметричный рост с сохранением сердца и мозга, снижение относительной массы печени и отсутствие изменений относительной массы почек. Реакция роста плода морских свинок HPX согласуется с исследованиями на людях, в которых измеряли ограниченный рост детей, рожденных от беременных женщин, живущих на большой высоте [41–43]. Хотя гипофагия может сопровождать воздействие HPX в зависимости от степени тяжести, это не было фактором в текущем исследовании, потому что не было ни снижения веса матери, ни потребления пищи, ни потребления воды с помощью HPX матери (10.5% О 2 ). Однако, несмотря на предположительно неизменное потребление калорий, HPX может снижать массу тела плода, вызывая метаболические изменения [34] в плаценте, которые способствуют нарушению нормального транспорта питательных веществ, таких как глюкоза, к плоду [44].
Морфологические изменения, выявленные в плаценте HPX на 40-й день беременности, включают расширенную зону соединения, усиление пролиферации ТБ, уменьшение площади субплаценты и уменьшение инвазии туберкулезом материнских артерий. Расширение зоны соединения было связано с децидуализацией материнского эндометрия, вызванной HPX.Несмотря на усиление распространения ТБ в эндометрии матери, наблюдалось заметное снижение инвазии ТБ как в проксимальные, так и в дистальные артерии матери. Более того, уменьшение диаметра сосудов в субплаценте указывает на морфологические изменения, которые могут ограничивать перфузию плаценты и вызывать прогрессирующее снижение оксигенации тканей в течение беременности. Повышенное распространение ТБ и увеличение диаметра сосудов в лабиринте, по-видимому, является компенсаторной реакцией на HPX.В других исследованиях материнский HPX также увеличивал лабиринтную зону у крыс, подвергшихся воздействию 12–13% O 2 на поздних сроках беременности [40, 45, 46], но снижался, если уровни O 2 были снижены до 10% O 2 [46], что указывает на порог HPX, который может быть неадаптивным. HPX при 12–13% O 2 у морских свинок [36, 47] и мышей [37, 46] увеличивает площадь поверхности обмена и диффузионную способность материнского плода в качестве дополнительной адаптивной реакции. Таким образом, вероятно, существуют как адаптивные, так и дезадаптивные конкурирующие влияния, которые ограничивают перфузию плаценты на материнской стороне, увеличивая при этом способность транспорта питательных веществ в лабиринте.Этот ответ связан с серьезностью HPX и может проявляться как FGR.
Последствия аномального развития плаценты для матери и плода, такие как ПЭ и недостаточность плаценты, связаны с уменьшением ремоделирования спиральной артерии с помощью механизмов, которые не полностью изучены. Текущая животная модель беременной морской свинки HPX предоставляет доказательства того, что плацентарный HPX стимулирует пролиферацию ТБ в децидуальной оболочке матери, но подавляет их инвазию как в проксимальные, так и в дистальные артерии.Это указывает на роль регуляции in vivo O 2 в переключении ТБ на инвазивный фенотип в 40-дневной плаценте морской свинки и подтверждается 1) наличием тканевого HPX в плаценте, 2) повышенной пролиферацией ТБ в плаценте. децидуальная оболочка матери и лабиринтная зона; 3) заметное снижение инвазии ТБ в просвет материнских артерий. Наши данные иллюстрируют несколько примеров, когда было полное отсутствие инвазии ТБ в плаценте HPX в отличие от присутствия инвазии ТБ в плаценте NMX.Неясно, связано ли снижение инвазии ТБ с механизмами, предотвращающими инвазию в стенку сосудов в условиях HPX [48], или же стресс HPX ингибирует дифференцировку TB [49, 50]. Исследования in vitro показали, что ТБ остаются в пролиферативном фенотипе в условиях низкого содержания O 2 , а дифференцировка в инвазивный фенотип предотвращается в условиях HPX [9, 51]. Кроме того, было показано, что HPX (10,5% O 2 in vitro) изменяет нормальную дифференцировку стволовых клеток ТБ путем ингибирования митохондриальной активности [50].Напротив, беременные крысы, подвергшиеся воздействию 11% O 2 HPX в период между 6,5–13,5 днями беременности (срок = 21 день беременности), демонстрировали усиление эндоваскулярной инвазии мезометриальных артерий матки за счет индуцированной HIF передачи сигналов дифференцировки туберкулеза в инвазивный подтип [ 52, 53]. Объяснение этих противоречивых результатов неясно. Это может отражать различия в характеристиках ТБ между морской свинкой и крысой, поскольку ТБ морских свинок более тесно связаны с ТБ плаценты человека [18].Кроме того, это может отражать различия во времени гестационного стимула HPX в критические моменты пролиферации и / или дифференцировки ТБ в плаценте. Тем не менее, модель морской свинки HPX обеспечивает средства использования инвазии ТБ в качестве отдельной конечной точки ремоделирования спиральной артерии, поскольку исследуются эффекты материнской депривации O 2 и плацентарного HPX на сосудистое сопротивление матки и рост плода.
Экспрессия генов плаценты NMX и HPX была измерена для выявления специфических для плаценты изменений, связанных с HPX, и определения временных изменений, которые потенциально способствуют адаптивным ответам плаценты в течение беременности.Наблюдались четкие различия в экспрессии генов в ответ на HPX на 40-м и 65-м днях беременности. На 40 день беременности экспрессия PGF и ESX1 была увеличена и, вероятно, стимулировала рост плаценты, измеренный в срок. Во время родов повышенная экспрессия VEGF , по-видимому, адаптивна в стимулировании васкулогенеза, на что указывают увеличенные кровяные пространства, измеренные в лабиринтной зоне плаценты HPX. Экспрессия PAPPA вариабельна, показывая увеличение HPX плаценты на 40-й день беременности с последующим значительным снижением экспрессии в срок.Его роль в снижении доступности фактора роста инсулина для развивающегося плода может способствовать измерению FGR в срок. Снижение экспрессии синцитина ( ERVW1 ) в среднесрочных плацентах HPX свидетельствует об увеличении пролиферации ТБ и снижении дифференцировки или приверженности популяции синцитиотрофобластов. Наблюдалось последовательное снижение нескольких специфичных для плаценты генов, таких как PTGS2 и COMT, , который генерирует 2-метоксиэстрадиол. Удаление COMT и снижение уровня 2-метоксиэстрадиола приводит к появлению у мышей симптомов, подобных ПЭ, и снижение экспрессии COMT наблюдается в доношенной плаценте HPX.Повышенный sFLT1 вызывает повреждение сосудов и ТЭЛА у людей. В то время как sFLT1 не аннотирован у морских свинок, FLT1, ближайший ортолог , показал тенденцию к усилению регуляции с помощью HPX, хотя и не был статистически значимым в срок. Тем не менее, при доношенных сроках наблюдалась повышенная регуляция фактора свертывания крови (TF) в плаценте HPX, и мы идентифицировали образование отложений фибрина в двух из трех плаценты HPX (дополнительный рисунок S7). Обилие отложений фибрина в плаценте HPX объясняется плохой перфузией плаценты и плацентой PE [43], вызванной прокоагулянтной активностью антигенов, высвобождаемых апоптотическими клетками ТБ [43], которые также могут быть факторами в нашей модели (дополнительный рис.S8). Следует отметить, что состав плаценты у среднесрочных и доношенных морских свинок имеет четко различающийся состав (например, потеря субплаценты во время родов). Более того, сайт-специфическая экспрессия генов в плацентарных областях (т.е. внутри лабиринта, а также между лабиринтной и соединительной зонами) может быть важным фактором при согласовании временных изменений морфологии плаценты с воздействием хронического HPX.
Таким образом, это исследование показывает, что плацентарный HPX индуцирует компенсаторное расширение кровеносных сосудов в лабиринте морской свинки в ответ на ингибированное ремоделирование артерий выше по течению, которое вызывает материнскую гипертензию и FGR.Несмотря на изменения в компартментах матери, плаценты и плода, подобные тем, которые наблюдаются в условиях ПЭ, функция и морфология почек у матери не затрагиваются и, вероятно, отражают плацентарную недостаточность, а не симптомы, подобные ПЭ. Таким образом, плацентарный HPX морской свинки отрицательно влияет на эндоваскулярную инвазию ТБ, которая может быть основной причиной материнской гипертензии и FGR. Необходимы дальнейшие исследования, чтобы понять временные изменения при уменьшении ремоделирования сосудов плаценты, поскольку это связано с компенсаторной реакцией плаценты.
Список литературы
1Hutter
D
Kingdom
J
Jaeggi
E.
Причины и механизмы внутриутробной гипоксии и ее влияние на сердечно-сосудистую систему плода: обзор
.Int J Pediatr
2010
;2010
:401323
,2Herrera
EA
Riquelme
RA
Ebensperger
G
Reyes
RV
KrauseУллоузе BJ
Parer
JT
Giussani
DA
Llanos
AJ.
Длительное пребывание в условиях высокогорной хронической гипоксии во время беременности вызывает неонатальную легочную гипертензию на уровне моря
.Am J Physiol Regul Integr Comp Physiol
2010
;299
:R1676
—R1684
.3Илекис
СП
Редди
UM
Робертс
JM.
Преэклампсия — насущная проблема: резюме семинара Национального института детского здоровья и развития человека
.Reprod Sci
2007
;14
:508
—523
.4Pennington
KA
Schlitt
JM
Jackson
DL
Schulz
LC
Преэклампсия: множественные подходы при многофакторном заболевании
.Dis Model Mech
2012
;5
:9
—18
.5Nardozza
LM
Araujo Júnior E, Barbosa MM, Caetano AC, Lee DJ, Moron AF.Ограничение роста плода: текущие знания общего профиля Obs / Gyn
.Arch Gynecol Obstet
2012
;286
:1
—13
,6Redman
CW
Sargent
IL
Персонал
ACIFPA.
Лекция для старших сотрудников: понимание преэклампсии — две плацентарные причины преэклампсии?
Плацента
2014
;35
(Доп.)
:S20
—S25
.7Kaufmann
P
Black
S
Huppertz
B.
Эндоваскулярная инвазия трофобласта: последствия для патогенеза задержки внутриутробного развития и преэклампсии
.Biol Reprod
2003
;69
:1
—7
,8Pringle
кг
Kind
KL
Sferruzzi-Perri
AN
Thompson
J4G
Beyond Oxygen: комплексная регуляция и активность индуцируемых гипоксией факторов во время беременности
.Обновление Hum Reprod
2010
;16
:415
—431
.9Genbacev
O
Zhou
Y
Ludlow
JW
Fisher
SJ.
Регуляция развития плаценты человека напряжением кислорода
.Science
1997
;277
:1669
—1672
.10Genbacev
O
Joslin
R
Damsky
CH
Polliotti
BM
Fisher
SJ.
Гипоксия изменяет дифференцировку / инвазию цитотрофобластов человека на ранних сроках беременности in vitro и моделирует дефекты плаценты, которые возникают при преэклампсии
.J Clin Invest
1996
;97
:540
—550
.11Caniggia
I
Mostachfi
H
Winter
J
Gassmann
M
L0007Пост
М.
Фактор-1, индуцируемый гипоксией, опосредует биологические эффекты кислорода на дифференцировку трофобластов человека через TGFbeta (3)
.Дж. Клин Инвест
2000
;105
:577
—587
.12Graham
CH
Postovit
LM
Park
H
Консервная банка
MT
FitzАдриана и Луиза Кастеллуччи наградная лекция 1999: роль кислорода в регуляции экспрессии и инвазии гена трофобласта
.Плацента
2000
;21
:443
—450
.13Graham
CH
Lala
PK.
Механизмы проникновения плаценты в матку и их контроль
.Biochem Cell Biol
1992
;70
:867
—874
,14Mitchell
BF
Taggart
MJ.
Соответствуют ли модели животных ключевым аспектам деторождения человека?
Am J Physiol Regul Integr Comp Physiol
2009
;297
:R525
—R545
.15Картер
AM.
Животные модели плацентации человека — обзор
.Плацента
2007
;28
(Suppl A)
:S41
—S47
,16Valdes
G
Erices
R
Chacon
C
9000iCortMegen
и сосудорасширяющая сеть в маточно-плацентарных отделениях во время беременности у морских свинок (Cavia porcellus).Репрод Биол Эндокринол
2008
;6
:13
.17Mess
A
Zaki
N
Kadyrov
M
Korr
H
Kaufmann
Kaufmann asntastom
P. Вторжение
.Плацента
2007
;28
:1234
—1238
.18Кастанеда-Гутьеррес
E
Pouteau
E
Pescia
G
000000 MoulinMacein
К.Морская свинка как модель метаболического программирования ожирения
.Am J Clin Nutr
2011
;94
:1838S
—1845S
,19Kaufmann
P.
Морская свинка Cavia porcellus
. :Benirschke
K
,Сравнительная плацентация
. .20Мур
LG
Чарльз
SM
Джулиан
CG.
Люди на большой высоте: гипоксия и рост плода
.Respir Physiol Neurobiol
2011
;178
:181
—190
.21Аль-Хасан
YM
Pinkas
GA
Thompson
LP.
Пренатальная гипоксия снижает уровни митохондриального белка и активность цитохром с оксидазы в сердцах потомства морских свинок
.Reprod Sci
2014
;21
:883
—891
.22Thompson
LP
Dong
Y.
Хроническая гипоксия снижает экспрессию эндотелиального белка синтазы оксида азота в сердцах плодов морских свинок
.J Soc Gynecol Investig
2005
;12
:388
—395
.23Oh
C
Dong
Y
Liu
H
Thompson
LP.
Внутриутробная гипоксия активирует провоспалительные цитокины и матриксные металлопротеиназы в сердцах плодов морских свинок
.Am J Obstet Gynecol
2008
;199
:78
e71
—e76
.24Chou
SC
Azuma
Y
Varia
MA
Raleigh
JA.
Доказательства того, что инволюкрин, маркер дифференцировки, регулируется кислородом при плоскоклеточном раке человека
.Br J Cancer
2004
;90
:728
—735
.25Schmittgen
TD
Livak
кДж.
Анализ данных ПЦР в реальном времени методом сравнительной КТ
.Протоколы природы
2008
;3
:1101
—1108
.26Дэвис
J
Демпси
EW
Аморосо
EC.
Подплацента морской свинки: развитие, гистология и гистохимия
.Дж Анат
1961
;95
:457
—473
.27Kaufmann
P
Mayhew
TM
Charnock-Jones
DS.
Аспекты фетоплацентарного васкулогенеза и ангиогенеза человека. II. Изменения при нормальной беременности
.Плацента
2004
;25
:114
—126
,28Mess
A.
Подплацента Octodon degus и Petromus typicus — два грызуна-гистрикогната без значительной дольчатой плаценты
.J Exp Zool B Mol Dev Evol
2007
;308
:172
—188
,29Huppertz
B
Gauster
M
Orendi
K
Konig
J
Ремоделирование сосудов матки матери во время беременности
.Анат
2009
;215
:14
—20
.30Гупперц
B.
Оксигенация плаценты и ее роль в преэклампсии
.Беременность. Гипертоническая болезнь
2014
;4
:244
—245
.31Матеев
S
Силлау
AH
Mouser
R
McCullough
DA
MM MMМур
LG.
Хроническая гипоксия препятствует вызванному беременностью усилению вазодилататорного ответа маточной артерии на кровоток
.Am J Physiol Heart Circ Physiol
2003
;284
:H820
—H829
.32Rockwell
LC
Keyes
LE
Moore
LG.
Хроническая гипоксия снижает связанный с беременностью синтез ДНК в маточно-плацентарных артериях морской свинки
.Плацента
2000
;21
:313
—319
.33Burton
GJ
Jauniaux
E
Charnock-Jones
DS.
Влияние внутриутробной среды на развитие плаценты человека
.Int J Dev Biol
2010
;54
:303
—312
.34Myatt
L
Webster
RP.
Сосудистая биология преэклампсии
.J Thromb Haemost
2009
;7
:375
—384
.35Osol
G
Moore
LG.
Ремоделирование сосудов матки матери во время беременности
.Микроциркуляция
2014
;21
:38
—47
,36Бэкон
BJ
Гилберт
RD
Кауфманн
P
Смит
AD
Треугольник ТреугольникАнатомия плаценты и диффузионная способность у морских свинок после длительной гипоксии матери
.Плацента
1984
;5
:475
—487
.37Matheson
H
Veerbeek
JH
Charnock-Jones
DS
Burton
G4000 G4000Морфологические и молекулярные изменения плаценты мышей, подвергшейся нормобарической гипоксии на протяжении всей беременности
.J Physiol
2016
;594
:1371
—1388
.38Рихтера
HG
Camm
EJ
Modi
BN
Naeem
F
Cross
CM
Cindrova-
000 Spyder
C
Mudway
IS
Kelly
FJ
Burton
GJ
Poston
L
et al.Аскорбат предотвращает оксидативный стресс плаценты и увеличивает массу тела при рождении при гипоксической беременности у крыс
.J Physiol
2012
;590
:1377
—1387
.39Kimball
R
Wayment
M
Merrill
D
Wahlquist
JroyoГипоксия снижает плацентарную активацию mTOR в индуцированной гипоксией модели ограничения внутриутробного развития (IUGR)
.Physiol Rep
2015
;3
:e12651
.40Cuffe
JS
Walton
SL
Singh
RR
Spiers
JG
Bielefeldt-Ohmann
H
Wilkinson
Wilkinson КМ.
Средне- и поздняя гипоксия у мышей изменяет морфологию плаценты, пути регуляции глюкокортикоидов и переносчики питательных веществ в зависимости от пола
.J Physiol
2014
;592
:3127
—3141
.41Moore
LG
Shriver
M
Bemis
L
Hickler
B
Wilson
M
Brutsaert
Адаптация матери к высокогорной беременности: эксперимент природы — обзор
.Плацента
2004
;25
(Дополнение A)
:S60
—S71
.42Zamudio
S.
Высотная гипоксия и преэклампсия
.Передняя Biosci
2007
;12
:2967
—2977
.43Keyes
LE
Armaza
JF
Niermeyer
S
Vargas
E
Ограничение внутриутробного развития, преэклампсия и внутриутробная смертность на большой высоте в Боливии
.Pediatr Res
2003
;54
:20
—25
.44Zamudio
S
Torricos
T
Fik
E
Oyala
M
Echalar
Echalar
Тутино
E
Martin
B
Belliappa
S
Balanza
E
Illsley
NP.
Гипогликемия и причина снижения темпов роста плода человека, вызванного гипоксией
.PLoS One
2010
;5
:e8551
.45Льюис
RM
Доэрти
CB
Джеймс
LA
Burton
GJ
Хейлз
Хейлз
Хейлз.
Влияние ограничения материнского железа на васкуляризацию плаценты у крыс
.Плацента
2001
;22
:534
—539
.46Higgins
JS
Vaughan
OR
Fernandez de Liger
E
Fowden
AL
Sferruzzi-Perri
AN.
Фенотип плаценты и распределение ресурсов для роста плода изменяются в зависимости от времени и степени гипоксии во время беременности мыши
.J Physiol
2016
;594
:1341
—1356
.47Гилберт
RD
Каммингс
LA
Juchau
MR
Longo
LD.
Плацентарная диффузионная способность и развитие плода у физических или гипоксических морских свинок
.J Appl Physiol Respir Environ Exerc Physiol
1979
;46
:828
—834
.48Steegers
EA
von Dadelszen
P
Duvekot
JJ
Pijnenborg
PijnenborgЛанцет
2010
;376
:631
—644
.49Huppertz
B.
Дифференциация трофобластов, ограничение роста плода и преэклампсия
.Беременность. Гипертоническая болезнь
2011
;1
:79
—86
.50Се
Y
Чжоу
S
Цзян
Z
Dai
J
Puscheck EParker
G
Huttemann
M
Rappolee
DA.
Гипоксический стресс вызывает, но не может поддерживать дифференцировку стволовых клеток трофобласта в лабиринтную плаценту из-за митохондриальной недостаточности
.Stem Cell Res
2014
;13
:478
—491
.51Caniggia
I
Winter
J
Lye
SJ
Post
M.
на первом месте и на первом месте. значение для патофизиологии преэклампсии.Плацента
2000
;21
(Suppl A)
:S25
—S30
.52Rosario
GX
Konno
T
Soares
MJ.
Гипоксия матери активирует эндоваскулярную инвазию клеток трофобласта
.Дев Биол
2008
;314
:362
—375
.53Soares
MJ
Chakraborty
D
Kubota
K
Renaud
SJ 9000 Rumi
SJ 9000
Адаптивные механизмы, контролирующие ремоделирование спиральной артерии матки во время установления беременности
.Int J Dev Biol
2014
;58
:247
—259
.Заметки автора
© Общество изучения репродукции, Inc., 2016
Антиоксиданты | Бесплатный полнотекстовый | Пренатальная гипоксия и оксидативный стресс плаценты: выводы от животных моделей к клиническим доказательствам
Пренатальная гипоксия — это состояние, ответственное за заболевание и гибель плода или новорожденного [18].Плацента — важный орган для общения беременной женщины и плода. Правильное функционирование этого органа важно для развития плода. Гипоксия определяется как снижение O 2 , необходимого для физиологических функций тканей [19]. Повышение уровней ROS, вызванное неполным восстановлением O 2 , является одним из наиболее распространенных механизмов, вызывающих гипоксию. Обычно плацента производит ROS, такие как супероксид-анион (O 2 — ), гидроксильный радикал (HO — ) и перекись водорода (H 2 O 2 ) [20].Эти молекулы очень нестабильны и обладают сильной химической реакционной способностью из-за наличия неспаренных электронов на внешней орбитали [21]. Из-за этой нестабильности АФК склонны отдавать или приобретать электрон от других электрически нестабильных молекул, чтобы достичь стабильного энергетического состояния. Таким образом, они проводят серию окислительно-восстановительных реакций, которые важны для выживания клетки. Нормальное производство ROS обеспечивается балансом между производством этих молекул и системой антиоксидантной защиты.Основная антиоксидантная система обеспечивается за счет активности антиоксидантных ферментов, таких как супероксиддисмутаза (SOD), глутатионпероксидаза (GPx) и каталаза (CAT). Неферментативные антиоксиданты, такие как тиолы (например, глутатион, GSH), протеиновые тиолы; витамины A, B6, B12, C и E; селен; фолиевая кислота; и β-каротиноиды, билирубин и мочевая кислота, представляют собой еще один защитный механизм, способный снизить чрезмерную продукцию ROS [22]. Во время беременности нормальные уровни АФК могут участвовать в пролиферации и дифференцировке трофобластов и в модуляции сосудистых ответов плаценты [19].Однако повышение уровня АФК отвечает за функциональные изменения плаценты. После гипоксии плода низкие уровни O 2 приводят к снижению активности митохондриальной цепи переноса электронов. Таким образом, это снижение способствует увеличению процентного содержания не полностью восстановленного O 2 с последующим образованием ROS, таких как O 2 — [20,23]. Митохондриальная электронная транспортная цепь представляет собой основной продуцент АФК. Другой источник АФК — НАДФН-оксидаза, ответственная за эндогенную продукцию O 2 — [24].В эндотелии сосудов цитохром P450 — еще один фермент, ответственный за продукцию OH — и O 2 — [25]. Металлофлавопротеин ксантиноксидаза — еще один фермент, который после окисления гипоксантина до ксантина и мочевой кислоты приводит к образованию O 2 — [26]. В плаценте в условиях гипоксии потребление кислорода митохондриями снижается. Это приводит к уменьшению запасов высокоэнергетических фосфатов, генерирующих высокие уровни ксантина, гипоксантина, NADH, FADH, ионов водорода (H + ) и молочной кислоты [27].Гипоксия вызывает снижение ферментативной активности насосов АТФ-ази-зависимых мембран, снижение мембранного потенциала и повышение уровня цитозольного кальция (Ca 2+ ). В условиях гипоксии увеличение внутриклеточного Ca 2+ из-за активации потенциал-зависимых каналов и высвобождения митохондриями и эндоплазматическим ретикулумом создает петлю, которая запускает механизм апоптоза и некроза нейронов [28]. Особенно в нейронных клетках проникновение Ca 2+ способствует накоплению глутамата.Глутамат, взаимодействуя с рецепторами N-метил-D аспартата (NMDA), усиливает внутриклеточный ток Ca 2+ , дополнительно способствуя повреждению нейронов [29]. Кроме того, Ca 2+ отвечает за активацию синтазы оксида азота ( NOS), участвующий в производстве оксида азота (NO). Среди трех известных изоформ NOS эндотелиальная синтаза оксида азота (eNOS) представляет собой Ca 2+ -зависимый флавоэнзим, который генерирует NO [30]. В этом процессе Ca 2+ играет важную роль в активации eNOS, регулируя связывание eNOS с кальмодулином [31]. NO — мощный эндотелиальный вазодилататор, участвующий в регуляции сосудистого тонуса, в контроле кровотока в тканях и в агрегации тромбоцитов.В плаценте NO играет ключевую роль в расширении сосудов маточно-плацентарных артерий, важном механизме, который определяет инвазию трофобластов и ремоделирование эндотелия [32]. Следовательно, измененный баланс NO и ROS играет решающую роль в модулировании функции сосудов пуповины и плаценты в различных пренатальных условиях. Следовательно, высокие уровни ROS ответственны за повреждение нескольких клеточных компонентов, таких как ДНК, белки и липиды, с последующим нарушением. нормальных клеточных функций [33].Во время беременности в течение 10–12 недель беременности наблюдается усиление притока материнской крови к плаценте, что приводит к локальному увеличению кислорода и, как следствие, к повышению активности антиоксидантных ферментов. Однако чрезмерное увеличение ROS, которому не может противодействовать антиоксидантный ответ, вызывает условия окислительного стресса. Окислительный стресс плаценты, особенно на этой стадии беременности, отвечает за снижение инвазии трофобластов. Этот каскад событий вызывает различные состояния, которые могут быть связаны с изменениями внутриутробного развития плода, а в серьезных случаях — даже с ранней неудачей беременности [34,35].Мозг более чувствителен к изменениям уровня O 2 . Окислительный стресс является основным фактором, вызывающим гибель нейрональных клеток в незрелом мозге [36]. Во время эмбриогенеза гипоксическое повреждение также задерживает миграцию нейронов и изменяет экспрессию многочисленных нейротрансмиттеров [37,38]. Эти механизмы повышают риск врожденных дефектов нервной системы, повреждения головного мозга и долгосрочных когнитивных нарушений в обучении и памяти [39,40]. Более того, он также может предрасполагать потомство к будущему возникновению эпилептических состояний [41].Плацентарно-плодная гипоксия и преэклампсия | Центр исследования трофобластов
Руководитель: профессор Дино Джуссани
Преэклампсия — основная причина материнской и внутриутробной смертности в Великобритании, ложащаяся тяжелым бременем на здоровье и благосостояние нашей страны. Несмотря на это, физиологические механизмы, лежащие в основе преэклампсии, плохо изучены, отчасти потому, что в настоящее время общее мнение состоит в том, что заболевание имеет многофакторную природу и включает сосудистые, генетические, иммунологические и / или экологические факторы.Принято считать, что при преэклампсии происходит неадекватная инвазия спиральных артерий матки матери в трофобласт плаценты. Это приводит к плохой перфузии плаценты и приводит к гипоксии плаценты и плода. Гипоксия является мощным стимулом для эндотелиальной дисфункции, а во время беременности способствует задержке внутриутробного развития. Таким образом, плацентарно-плодная гипоксия может служить подходящим стимулом, связывающим неблагоприятные эффекты преэклампсии на физиологию сосудов матери, плаценты и будущего ребенка.Одним из механизмов, посредством которого плаценто-плодная гипоксия может влиять на несколько кровообращений, является активация окислительного стресса. Генерация активных форм кислорода, таких как супероксид-анион, секвестрирует оксид азота, снижая его биодоступность и тем самым способствуя эндотелиальной дисфункции. Интересно, что маркеры окислительного стресса повышены в плаценте и кровообращении у пораженных женщин.
В Кембриджском университете мы создали 4 индивидуальные изобарические гипоксические камеры, способные поддерживать беременных овец на протяжении всей беременности в контролируемых условиях гипоксии.Мы также разработали специальную беспроводную систему сбора данных, способную записывать сигналы давления и кровотока от матери и плода во время развития гипоксической беременности. В этой докторской диссертации мы будем использовать эти средства для измерения в первый раз непрерывных in vivo изменений кровяного давления матери, частоты сердечных сокращений матери, маточной крови и сопротивления сосудов, артериального давления плода, частоты сердечных сокращений плода и кровотока в пупочной артерии плода. и сосудистое сопротивление при контрольной и хронической гипоксической беременности.Данные по сердечно-сосудистой системе матери и плода будут параллельно с ежедневной оценкой газов артериальной крови матери и плода и метаболического статуса. Также будут взяты образцы суточной мочи матери для анализа на белок. В конце контрольной или гипоксической беременности образцы плаценты фиксируют и замораживают для гистологического и молекулярного анализа окислительного стресса. Ветви маточных артерий будут изолированы и установлены на проволочном миографе in vitro для оценки изменений вазоконстрикторной и сосудорасширяющей реактивности.Все эксперименты будут повторены при контрольной и гипоксической беременности, подвергающейся лечению матери различными антиоксидантами.
Для получения дополнительной информации, пожалуйста, свяжитесь со мной:
Электронная почта: [email protected]
Это исследование показывает, как недостаток кислорода во время беременности может вызвать шизофрению
ИЗОБРАЖЕНИЕ: Эксперименты на крысах показывают, что клетки мозга, подвергшиеся нескольким формам гипоксии, претерпели изменения в механизме производства энергии.Такое состояние может повлиять на плод у беременных женщин, которые … посмотреть еще
Кредит: Луис Фелипе Соуза и Силва
Недостаток кислорода в период антипатии при рождении ребенка — состояние, которое может поражать детей беременных женщин, страдающих нарушением высокого кровяного давления, называемым преэклампсией, — был отмечен как одна из причин шизофрении. В статье, опубликованной в журнале Scientific Reports , исследователи из Медицинской школы Санта-Каса-де-Сан-Паулу (FCM-SCSP) в Бразилии описали, как это явление, называемое на медицинском жаргоне гипоксией, влияет на астроциты, один из наиболее распространенных типов мозга. клетки.
В экспериментах с астроцитами крыс исследователи обнаружили, что гипоксия влияет на функционирование митохондрий, органелл, производящих энергию в клетках. Это исследование прокладывает путь будущей разработке методов лечения, чтобы остановить процесс, ведущий к дисфункции митохондрий, и тем самым предотвратить повреждение мозга плода в случае преэклампсии.
«Мы начали с астроцитов, потому что они наиболее распространены, а также потому, что они метаболизируют нейротрансмиттеры, такие как глутамат, один из наиболее важных и ключевых факторов шизофрении.Сейчас мы исследуем влияние гипоксии на нейроны, — сказала Татьяна Росадо Розенсток, профессор FCM-SCSP и главный исследователь исследования. — Мы хотим выяснить, какие сигналы один тип клетки посылает другой, чтобы избежать повреждения мозга. . «
Астроциты — это звездчатые клетки и наиболее распространенные глиальные клетки, обеспечивающие поддержку и изоляцию нейронов. Глиальные клетки, которые также включают олигодендроциты и микроглию, составляют в среднем 90% мозга. Остальное составляют нейроны.Глии — это динамические клетки, которые регулируют метаболизм центральной нервной системы, поддерживают гомеостаз, образуют миелин, снабжают питательные вещества нейронами и опосредуют образование синапсов.
Три модели
Исследование было частью проекта, финансируемого FAPESP. Его ведущий автор, Луис Фелипе Соуза и Силва, провел исследование во время подготовки к получению степени магистра, получив стипендию от FAPESP.
Исследовательская группа FCM-SCSP использовала три метода для наблюдения за действием гипоксии на астроциты крыс.Сначала они поместили клетки в гипоксическую камеру, не содержащую кислорода. Затем они обработали клетки хлоридом кобальта, который имитирует гипоксию.
Наконец, они проанализировали астроциты крыс со спонтанной гипертонией (SHR) — линии, чьи плоды страдают гипоксией во время беременности. Эти животные демонстрировали поведение, эквивалентное симптомам шизофрении у людей, которые перестали проявлять указанные симптомы при приеме антипсихотических препаратов.
В клетках, подвергшихся различным формам гипоксии, митохондриальный баланс кальция был одной из измененных переменных, которые привлекли внимание исследователей.
Положительный и отрицательный электрические заряды должны быть в равновесии, чтобы митохондрии производили энергию. Поскольку кальций заряжен положительно, изменение уровня кальция может привести к дисбалансу, который в конечном итоге может вызвать гибель клеток.
Было обнаружено, что по сравнению с нормальными астроцитами у тех, кто подвергается трем типам гипоксии, более низкий уровень кальция в цитозоле, растворе на водной основе, в котором органеллы, белки и другие клеточные структуры плавают в пространстве между мембраной и ядром. .
«Это произошло именно потому, что поглощение кальция митохондриями этих клеток увеличилось (поэтому в цитозоле остается гораздо меньшее количество кальция) в попытке защитить себя», — сказал Розенсток. «Однако слишком много митохондриального кальция приводит к несбалансированному заряду в этих органеллах, изменяя мембранный потенциал, перенос электронов и, следовательно, производство энергии».
Кроме того, недостаток кислорода нарушает окислительно-восстановительный гомеостаз, что позволяет клеткам бороться с окислительным стрессом.Любой дисбаланс между молекулами оксиданта и антиоксиданта также может привести к гибели клеток. По мнению исследователей, усиление окислительного стресса — еще одно следствие изменений уровня кальция.
Исследователи были заинтригованы, обнаружив, что гипоксия увеличивает количество митохондрий в астроцитах. В тестах исследователи обнаружили экспрессию гена Pgc1-α, который играет важную роль в митохондриальном биогенезе (создании новых митохондрий).
«В условиях стресса клетка увеличивает количество митохондрий, чтобы получить больше энергии.«Существующие митохондрии могут быть не в состоянии производить достаточно, учитывая расширение клеточной дисфункции», — сказал Розенсток.
В настоящее время исследователи изучают способы улучшения митохондриальной функции не только астроцитов, но и нейронов, которых меньше, но которые жизненно важны для нормального развития мозга.
«Если гипоксия вызывает проблемы в митохондриях, однажды мы сможем улучшить функцию митохондрий в случаях преэклампсии и избежать шизофрении», — сказал Розенсток.«Между тем, лучший способ для будущих мам избежать гипоксии плода — это посещать все необходимые сеансы дородовой помощи и избегать нарушений высокого кровяного давления».
###
О Фонде исследований Сан-Паулу (FAPESP)
Исследовательский фонд Сан-Паулу (FAPESP) — это государственное учреждение, миссией которого является поддержка научных исследований во всех областях знаний путем присуждения стипендий, стипендий и грантов исследователям, связанным с высшими учебными заведениями и исследовательскими учреждениями в штате Сан-Паулу, Бразилия. .FAPESP осознает, что самые лучшие исследования могут быть выполнены только при сотрудничестве с лучшими исследователями со всего мира. Поэтому он установил партнерские отношения с финансирующими агентствами, высшими учебными заведениями, частными компаниями и исследовательскими организациями в других странах, известных качеством своих исследований, и поощряет ученых, финансируемых за счет его грантов, к дальнейшему развитию международного сотрудничества. Вы можете узнать больше о FAPESP на сайте http: // www.
Заявление об отказе от ответственности: AAAS и EurekAlert! не несут ответственности за точность выпусков новостей, размещенных на EurekAlert! участвующими учреждениями или для использования любой информации через систему EurekAlert.
.