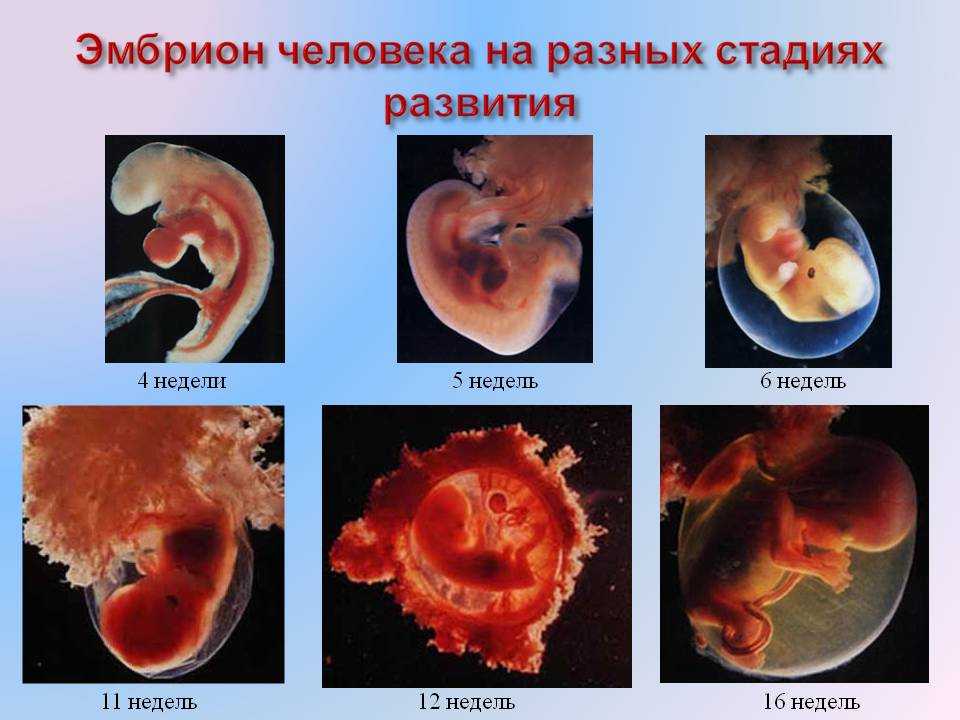
Первые дни развития эмбриона
ЭКО
Список услуг
В ооцит проникает не весь сперматозоид, а только его ядро, несущее гаплоидный набор хромосом (23), которое образует мужской пронуклеус. Последний сближается с ядром ооцита женским пронуклеусом, образуя, так называемый, синкарион. Начинается великое таинство природы — эмбриогенез, или развитие эмбриона.
Первое митотическое деление
После того, как сперматозоид проник в яйцеклетку, она называется зиготой. В зиготе сразу же запускаются механизмы раннего эмбриогенеза: сближение пронуклеусов и удвоение их ДНК. Эта подготовка к первому делению занимает около суток. В первом делении участвуют оба пронуклеуса — их оболочки разрушаются, а хромосомы образуют единую материнскую звезду. Все это сопровождается медленным продвижением зиготы по маточной трубе в сторону матки.
Дробление
В течение последующих 2-4-х суток происходит дробление — деления без роста дочерних клеток. Таким образом общий размер плодного яйца не увеличивается. Клетки, которые называются теперь бластоцистами, делятся неравномерно и их размеры с каждым делением становятся все меньше. Развитие эмбриона в период дробления проходит несколько стадий:
Таким образом общий размер плодного яйца не увеличивается. Клетки, которые называются теперь бластоцистами, делятся неравномерно и их размеры с каждым делением становятся все меньше. Развитие эмбриона в период дробления проходит несколько стадий:
- Стадия бластулы. Характеризуется асинхронным делением бластомеров, которые пока сохраняют равный потенциал развития, то есть разобщив их на этом этапе, можно получить два полноценных зародыша. Плодное яйцо находится в маточной трубе.
- Стадия морулы. Активация процессов, которые запускают дифференцировку клеток — их разделение по виду и потенциалу. Бластомеров в плодном яйце более 10. Яйцо приближается к полости матки. Через четверо суток, когда в моруле уже 32 клетки, в ее центре определяются несколько клеток более темного цвета — предшественники будущего плода.
- Бластоциста. К концу 4-5 суток происходит образование бластоцисты, которая представляет собой зародышевый пузырек, наполненный жидкостью.
 В это время плодное яйцо уже достигает полости матки, где в свободном состоянии находиться до двух суток. В бластоцисте уже четко определяется два компонента — трофобласт, которые являются предшественниками хориона, эмбриобласт, представляющий собой скопление темных клеток у одного из полюсов плодного яйца, а также полость, заполненная жидкостью (бластоцель).
В это время плодное яйцо уже достигает полости матки, где в свободном состоянии находиться до двух суток. В бластоцисте уже четко определяется два компонента — трофобласт, которые являются предшественниками хориона, эмбриобласт, представляющий собой скопление темных клеток у одного из полюсов плодного яйца, а также полость, заполненная жидкостью (бластоцель).
К 5 суткам от момента оплодотворения число клеток эмбриона превышает 100. На этапе бластоцисты в трофобласте появляются выросты, которые постепенно разрушают зону пеллюцида вокруг зародыша, готовя его к имплантации в стенку матки. С этого момент деление клеток сопровождается ростом эмбриона. На 5-7 сутки, с имплантацией зародыша в эндометрий, заканчивается зародышевый и начинается эмбриональный период, который продлиться до 8 недели беременности.
Записаться на прием
Имя
Номер телефона
Вопрос
Я посещаю клинику в первый раз
Выберите врачаКарякина Л..jpg) С.Барашов А. Ю.Дроздик О. В.Иванова А. В.Шамин М. В.Вальшин Т. Ю.Брагин-Мальцев А. И.Соломатина О. А.Массон И. Л.Демченко Д. О.Лунева Е. В.Соловьев В. Б.Неверова Ю. Н.Животовский А. С.Быкова Ю. А.Григоричева Е. В.Дудкина О. А.Кофанова Е. С.Вялова К. В.Жаркова О. Н.Каминская Т. В.Губанков М. В.Корнев В. П.Сохарева И. Г.Корнева О. В.Тришкина Н. Н.Терновая А. С.Власова И. В.Сагателян Г. Р.Фролова Н. А.Лобанова О. Г.Помешкин Е. В.Бушмакин А. Д.Маруев М. Б.Лесников А. И.Безденежных А. В.Сурцев К. С.Шлегель Е. Г.Пискунов А. С.Григорьева О. В.Володина С. С.Изместьев К. В.Кузьмина Т. С.Курганова Л. В.Притчина С. С.Зуева Г. П.Степанова О. В.Бурков А. Н.Барашова Л. П.Стопичева С. Л.Шипицына О. А.Голитенко Е. Ю.Медведева Ю. Д.Сухова Н. А.Елманов А. В.Бочкарникова А. Г.Тришкин А. Г.Луговой К. А.
С.Барашов А. Ю.Дроздик О. В.Иванова А. В.Шамин М. В.Вальшин Т. Ю.Брагин-Мальцев А. И.Соломатина О. А.Массон И. Л.Демченко Д. О.Лунева Е. В.Соловьев В. Б.Неверова Ю. Н.Животовский А. С.Быкова Ю. А.Григоричева Е. В.Дудкина О. А.Кофанова Е. С.Вялова К. В.Жаркова О. Н.Каминская Т. В.Губанков М. В.Корнев В. П.Сохарева И. Г.Корнева О. В.Тришкина Н. Н.Терновая А. С.Власова И. В.Сагателян Г. Р.Фролова Н. А.Лобанова О. Г.Помешкин Е. В.Бушмакин А. Д.Маруев М. Б.Лесников А. И.Безденежных А. В.Сурцев К. С.Шлегель Е. Г.Пискунов А. С.Григорьева О. В.Володина С. С.Изместьев К. В.Кузьмина Т. С.Курганова Л. В.Притчина С. С.Зуева Г. П.Степанова О. В.Бурков А. Н.Барашова Л. П.Стопичева С. Л.Шипицына О. А.Голитенко Е. Ю.Медведева Ю. Д.Сухова Н. А.Елманов А. В.Бочкарникова А. Г.Тришкин А. Г.Луговой К. А.
Выберите клиникуНа СувороваНа Двужильного
Я согласен на обработку персональных данных
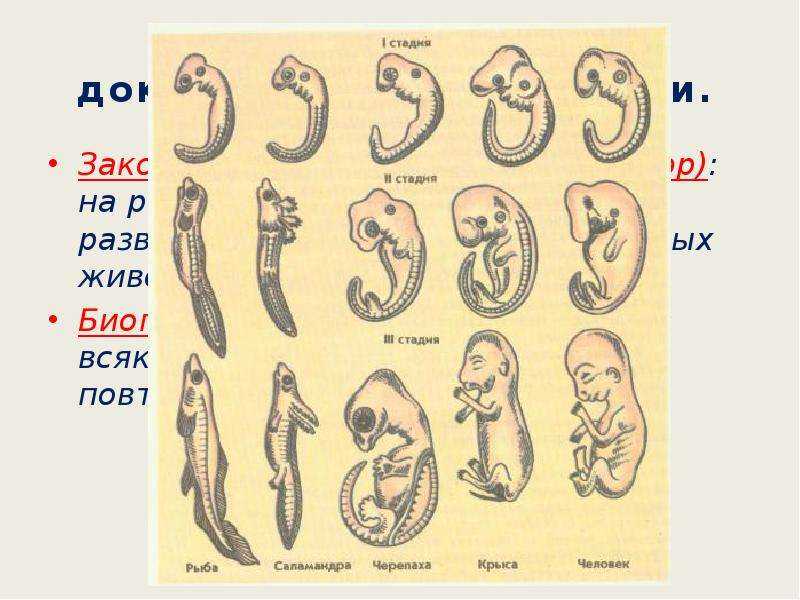
Внутриутробное развитие: от червей до зверей
Вынашивают своих детёнышей не только млекопитающие– у многих членистоногих, червей и моллюсков эмбрионы развиваются прямо в организме матери, напрямую получая от неё питательные вещества.
Вынашивание эмбриона в организме матери, когда он живёт за счёт её ресурсов, стало большим эволюционным шагом вперёд. Конечно, можно сказать, что развитие зародыша в яйце или в икринке тоже происходит за счёт родителя: ведь запас питательных веществ здесь всё равно создаётся материнским организмом. Однако икринка и яйцо, покинув организм самки, становятся во многом предоставлены своей судьбе, даже если родители заботятся о кладке. Если же эмбрион растёт внутри родительского тела, и если, что важно, при этом между ним и матерью образуется тесный контакт, то это даёт и защиту, и сбалансированные физиологические условия, и прямой транспорт «еды».
У некоторых мшанок эмбрион питается клетками зародышевой камеры в теле материнского организма. (Фото Jan Hamrsky / Flickr.com.)
У уховёртки Arixenia esau клетки матки выделяют белковую субстанцию, которой кормится зародыш. (Фото Bernard DUPONT / Flickr.com.)
У живородящих онихофор, или бархатных червей, в матке образуется настоящая плацента, через которую и питается эмбрион. (Фото Art / Flickr.com.)
(Фото Art / Flickr.com.)
‹
›
Открыть в полном размере
Когда мы говорим о таком способе эмбрионального развития, то обычно вспоминаем млекопитающих, у которых питание зародыша осуществляется через специальный орган – плаценту. Она соединяет циркуляционные системы плода и матери, с её помощью происходит снабжение эмбриона не только питательными веществами, но и кислородом; соответственно, удаление продуктов обмена происходит тоже с помощью плаценты. Кроме того, она помогает согласовывать работу иммунных систем: пропуская антитела матери к ребёнку, она всё же не даёт возникнуть иммунным конфликтам между плодом и материнским организмом.
Плацента есть не у всех зверей, многие сумчатые её лишены, не говоря уже о представителях однопроходных – утконосе и ехиднах. С другой стороны, она есть у некоторых живородящих хрящевых рыб (к которым относятся акулы, скаты и химеры), онихофор и ещё у некоторых групп животных. Учитывая преимущества, которые даёт плацента, можно было бы ожидать, что в эволюции будет немало попыток освоить такой способ заботы об эмбрионе.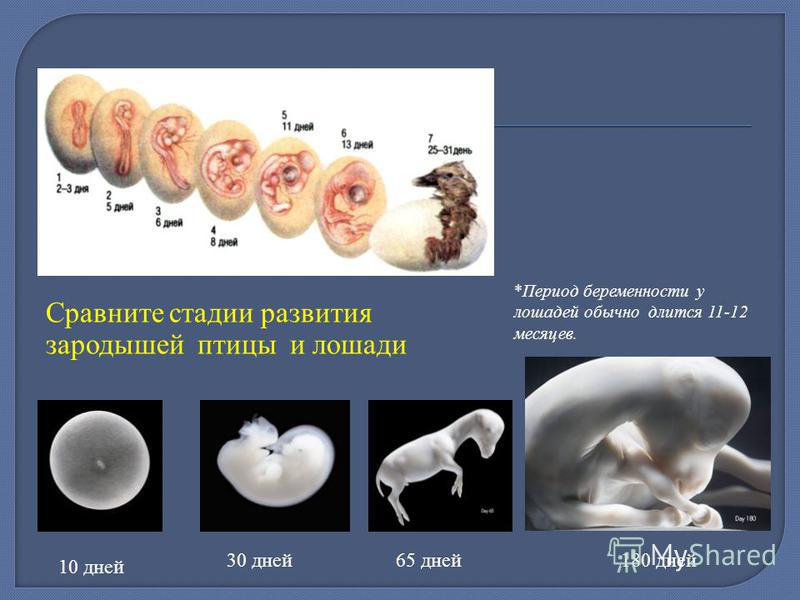
Правда, стоит сразу сказать, что в работе Андрея Островского, Александра Ересковского и их коллег из Австрии, США и Новой Зеландии речь идёт не столько о плацентарном способе вынашивания, сколько о матротрофии – так называют ситуацию, когда зародыш питается за счёт родительского тела. Формирование плаценты – лишь одно их конструктивных решений такой задачи, хотя и очень удачное.
В статье, опубликованной в Biological Reviews, авторы пишут, что матротрофия существует у 21 типа животных из 34 известных. В ходе эволюции такой способ заботы о зародыше возникал более 140 раз, причём и у беспозвоночных животных – так, плоских червей с матротрофией оказалось даже больше, чем млекопитающих. И, хотя примеры прямого питания развивающегося эмбриона за счёт материнского организма у представителей различных групп беспозвоночных не раз были описаны ранее, никто не мог и представить, насколько широко это распространено.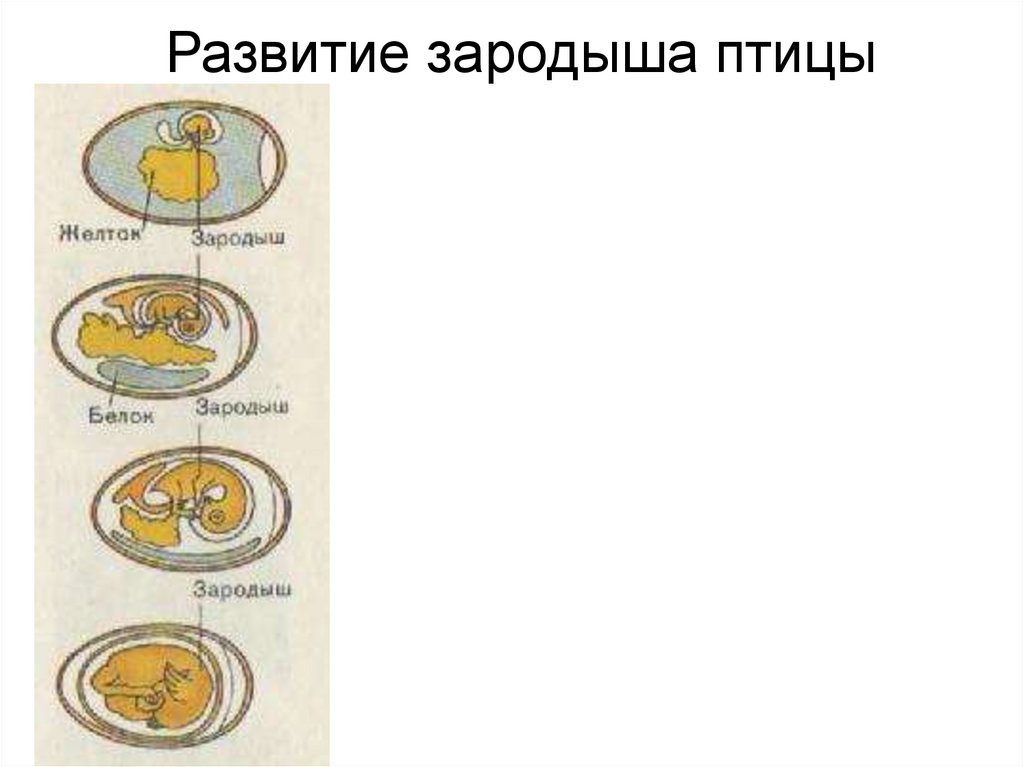
Матротрофия есть у насекомых, ракообразных, моллюсков, червей (в том числе и паразитических), иглокожих, мшанок и многих других. В некоторых случаях прямые «поставки» питательных веществ только дополняет «желточное питание», в некоторых – полностью замещает его. Механизмы здесь могут быть самыми разнообразными (хотя, безусловно, все они уступают по эффективности плаценте зверей). Часто между зародышем и родительским организмом образуется что-то, похожее на плацентарные контакты – так происходит развитие эмбриона у многих насекомых, скорпионов, плоских червей, пиявок. Бывает, что питательные вещества поступают в зародыш не по каким-то специальным структурам, а прямо через его покровы, из околоплодной жидкости (так бывает у ракообразных и двустворчатых моллюсков). У мух и скорпионов есть особые внутриматочные железы, которые выделяют для эмбриона своеобразное «молоко». Есть виды с эмбриональным каннибализмом – когда быстро созревшие зародыши прямо в организме матери поедают тех, кто находится на более ранних этапах развития (у некоторых морских звезд и брюхоногих моллюсков).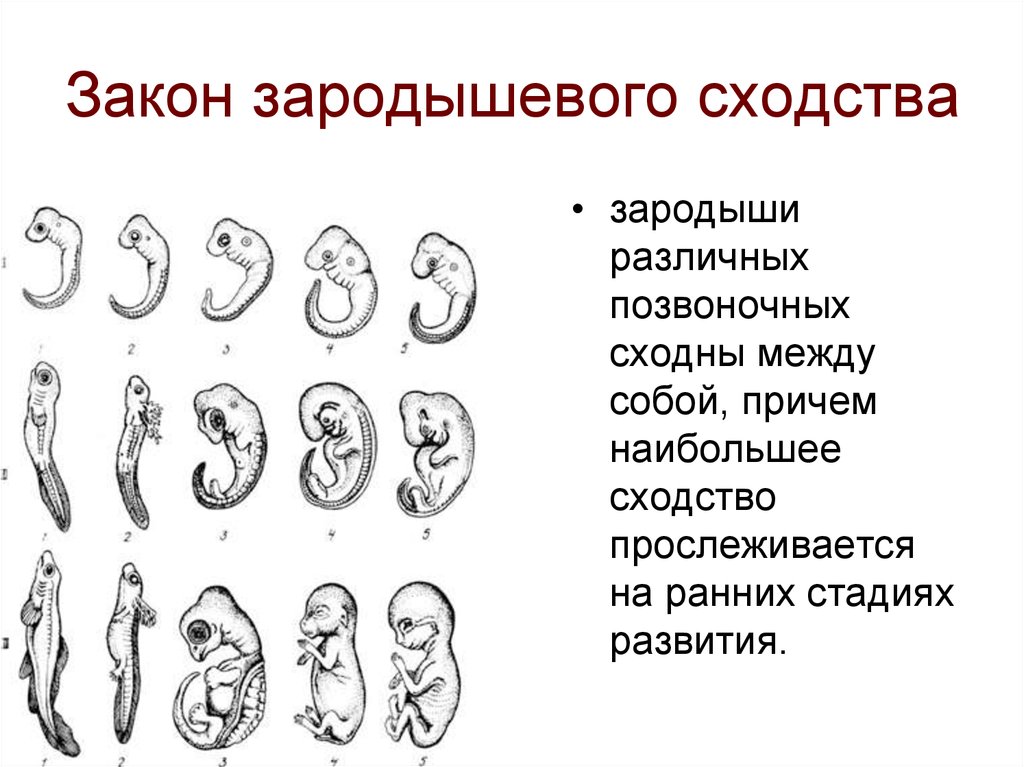
Вопросов, которые поставило данное исследование, куда больше, чем ответов. Если матротрофия много раз возникала у неродственных групп животных, то какие особенности физиологии, жизненных циклов и условий существования могли обеспечить ее появление? Выше мы говорили о преимуществах внутриутробного питания, но ведь икрометание и откладывание яиц не сошли со сцены, масса видов продолжают размножаться таким способом. У наземных видов был мощный аргумент в польщу внутриутробного развития – они сменили среду обитания. На суше икру просто так не оставишь, ты должен или вернуться для этого к воде, или обеспечить яйцо более совершенными оболочками (как рептилии, птицы и наземные членистоногие), или – да, перейти к вынашиванию эмбриона в самом себе. Но матротрофия и живорождение есть и у целиком водных животных. То есть во многих случаях преимущества такого способа размножения нужно оценивать отдельно, подробно рассматривая экологию и эволюционную историю конкретного вида или группы видов, что делает этот вопрос особенно сложным, но в то же время и интригующим.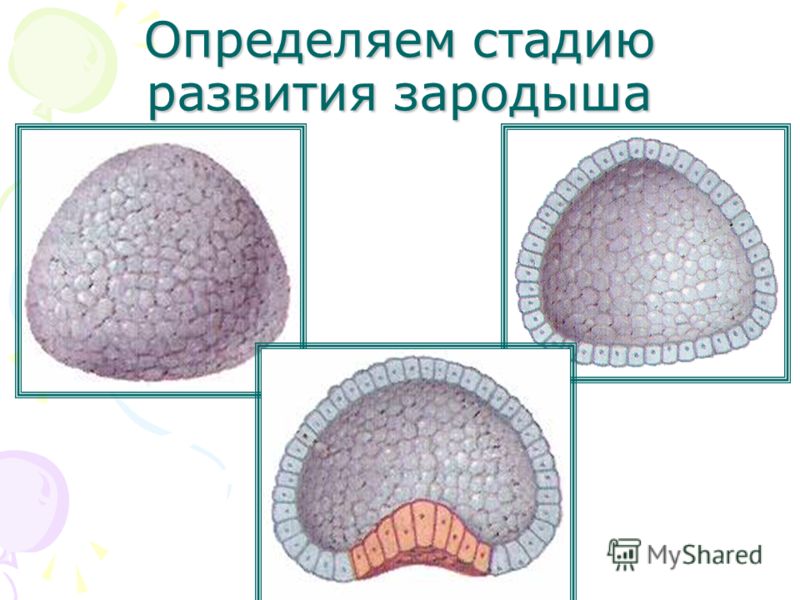
По материалам СПбГУ
Эмбриональное развитие – биология развития
У растений термин эмбриогенез охватывает развитие с момента оплодотворения до наступления периода покоя. Основной план тела спорофита устанавливается во время эмбриогенеза; однако этот план повторяется и дорабатывается после выхода из состояния покоя. Основные проблемы эмбриогенеза:
- 1.
Установить основной план тела. Радиальное формирование рисунка производит три системы тканей и осевой паттерн устанавливает апикально-базальную (отросток-корень) ось.
- 2.
Для выделения меристематической ткани для постэмбриональной выработки строения тела (листья, корни, цветки и т.д.).
- 3.
Для создания доступного запаса пищи для прорастающего эмбриона до тех пор, пока он не станет автотрофным.
Эмбриогенез сходен у всех покрытосеменных с точки зрения установления основного плана тела (Стивс и Сассекс 1989) (см.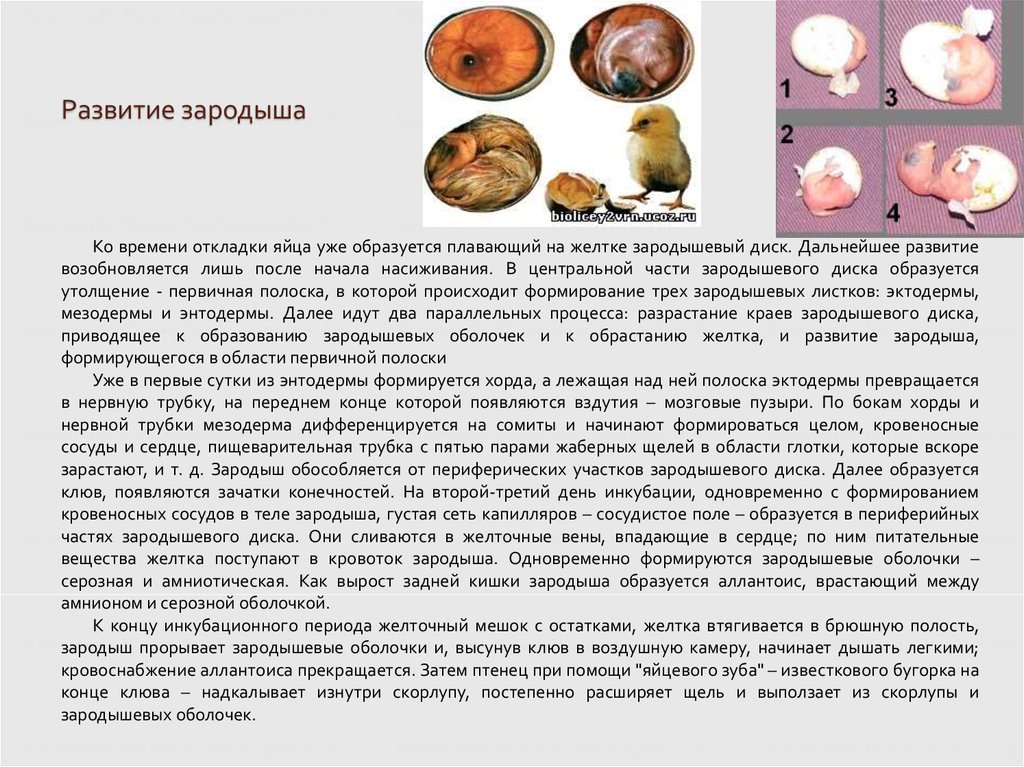 ). Однако существуют различия в разработке паттерна, включая различия в точности паттернов клеточного деления, степени развития эндосперма, развития семядолей и степени развития меристемы побега (Esau 1977; Johri et al. 1992).
). Однако существуют различия в разработке паттерна, включая различия в точности паттернов клеточного деления, степени развития эндосперма, развития семядолей и степени развития меристемы побега (Esau 1977; Johri et al. 1992).
Рисунок 20.15
Эмбриогенез покрытосеменных. Показан репрезентативный двудольный; однодольное растение разовьет только одну семядолю. Хотя у покрытосеменных существуют основные модели эмбриогенеза, между видами существуют огромные морфологические различия.
Полярность устанавливается при первом клеточном делении после оплодотворения. Установление полярности было исследовано с использованием бурых водорослей в качестве модельной системы (Belanger and Quatrano 2000). Зиготы этих растений не зависят от других тканей и поддаются манипуляциям. В результате первоначального клеточного деления образуется одна меньшая клетка, которая образует ризоид (гомолог корня) и закрепляет остальную часть растения, и одна большая клетка, дающая начало слоевищу (основному телу спорофита).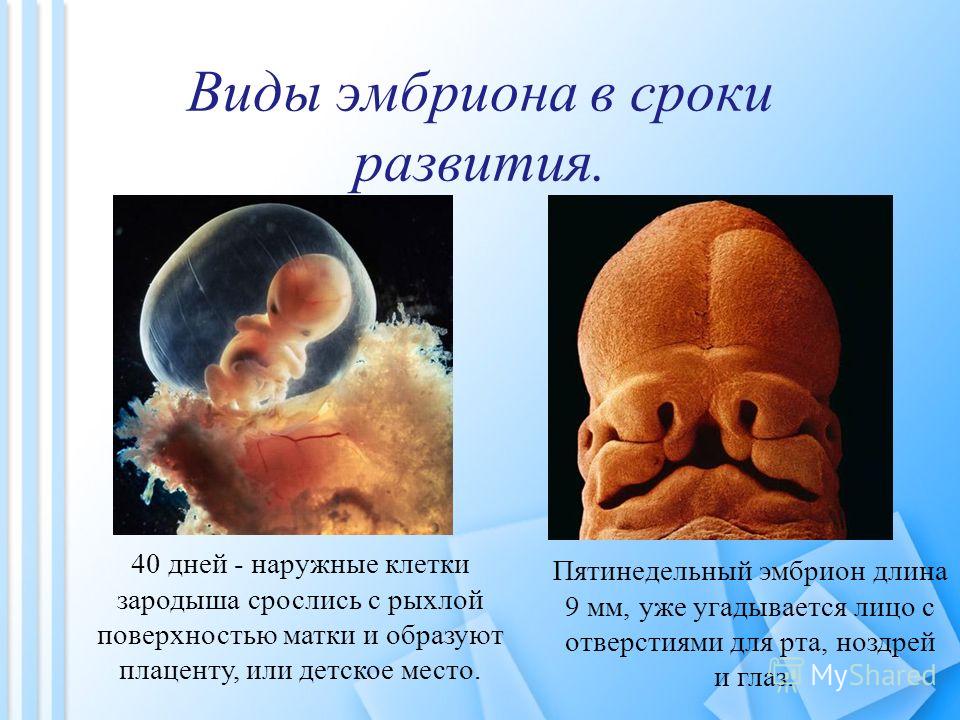 Точка входа спермия фиксирует положение ризоидного конца апикально-базальной оси. Эта ось перпендикулярна плоскости первого клеточного деления. F-актин накапливается на ризоидном полюсе (Kropf et al. 19).99). Однако свет или гравитация могут отменить эту фиксацию оси и установить новое положение для клеточного деления (Alessa and Kropf 1999). Как только апикально-базальная ось установлена, секреторные везикулы направляются к ризоидному полюсу зиготы. Эти везикулы содержат материал для разрастания ризоидов с клеточной стенкой определенного макромолекулярного состава. Целенаправленная секреция может также помочь сориентировать первую плоскость клеточного деления. Сохранение судьбы ризоидов и талломов на ранних стадиях развития зависит от информации в клеточных стенках (Браунли и Бергер 19).95). Информация о клеточных стенках также важна для покрытосеменных растений (rev. Scheres and Benfey 1999).
Точка входа спермия фиксирует положение ризоидного конца апикально-базальной оси. Эта ось перпендикулярна плоскости первого клеточного деления. F-актин накапливается на ризоидном полюсе (Kropf et al. 19).99). Однако свет или гравитация могут отменить эту фиксацию оси и установить новое положение для клеточного деления (Alessa and Kropf 1999). Как только апикально-базальная ось установлена, секреторные везикулы направляются к ризоидному полюсу зиготы. Эти везикулы содержат материал для разрастания ризоидов с клеточной стенкой определенного макромолекулярного состава. Целенаправленная секреция может также помочь сориентировать первую плоскость клеточного деления. Сохранение судьбы ризоидов и талломов на ранних стадиях развития зависит от информации в клеточных стенках (Браунли и Бергер 19).95). Информация о клеточных стенках также важна для покрытосеменных растений (rev. Scheres and Benfey 1999).
Рисунок 20.13
Формирование оси у бурой водоросли Pelvetia Compressa. (A) Пятно F-актина (оранжевое) сначала образуется в точке входа сперматозоида (синее пятно отмечает пронуклеус сперматозоида). (B) Позже в направлении стрелки засиял свет. Ось, индуцированная сперматозоидами (подробнее…)
(A) Пятно F-актина (оранжевое) сначала образуется в точке входа сперматозоида (синее пятно отмечает пронуклеус сперматозоида). (B) Позже в направлении стрелки засиял свет. Ось, индуцированная сперматозоидами (подробнее…)
Рисунок 20.14
Асимметричное деление клеток у бурых водорослей. Временная динамика от 8 до 25 часов после оплодотворения, показывающая клетки водорослей, окрашенные жизненным мембранным красителем для визуализации секреторных пузырьков, которые появляются первыми, и клеточной пластинки, которая начинает появляться примерно (далее…)
Основной план тела покрытосеменных растений, заложенный во время эмбриогенеза, также начинается с асимметричного * клеточного деления, дающего начало терминальной клетке и базальной клетке (). Терминальная клетка дает начало собственно зародышу . Ближайшая к микропиле форма базальной клетки дает начало суспензору . Гипофиз находится на границе между суспензором и собственно зародышем.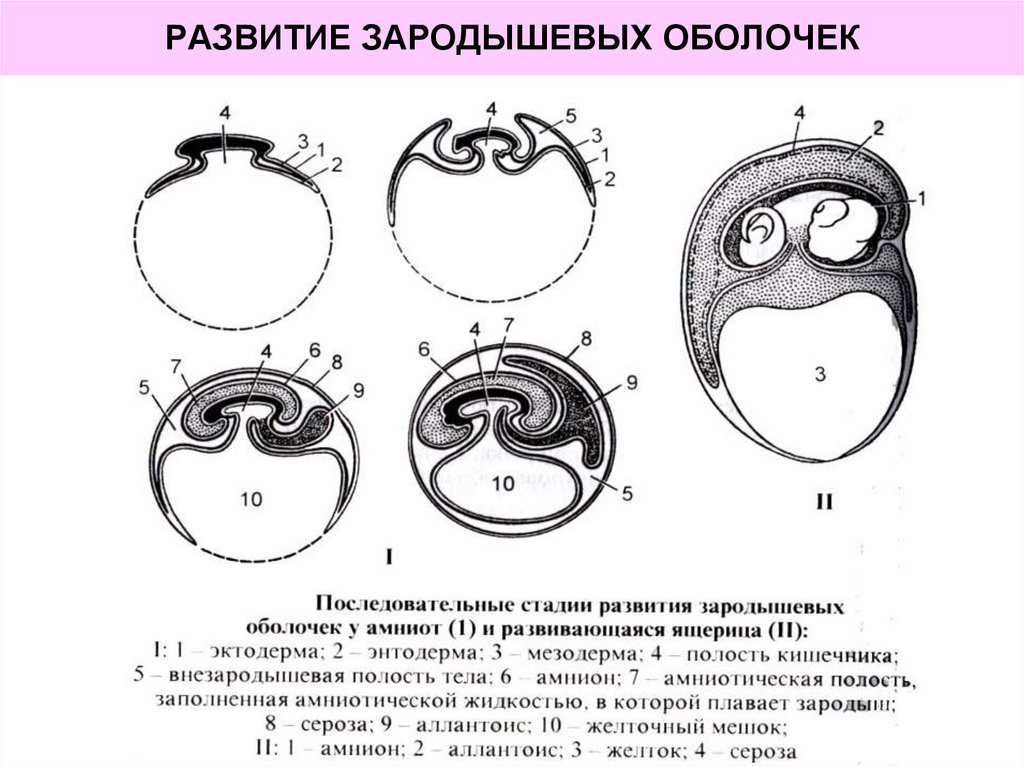 У многих видов он дает начало некоторым корневым клеткам. (Суспензорные клетки делятся с образованием нитевидного или сферического органа, который дегенерирует позже в эмбриогенезе.) И у голосеменных, и у покрытосеменных суспензор ориентирует абсорбирующую поверхность зародыша в сторону источника пищи; у покрытосеменных он также, по-видимому, служит проводником питательных веществ для развивающегося эмбриона. Культивирование изолированных зародышей алой фасоли с суспензором и без него продемонстрировало потребность в суспензоре на стадии сердцевины у двудольных (Yeung and Sussex 19).79). Эмбрионы, культивированные с суспензором, имеют в два раза больше шансов выжить, чем эмбрионы, культивированные без прикрепленного суспензора на этой стадии. Суспензор может быть источником гормонов. У алой побеговой фасоли молодые зародыши без суспензора могут выжить в культуре, если к ним добавляют гормон роста гибберелловую кислоту (Cionini et al., 1976).
У многих видов он дает начало некоторым корневым клеткам. (Суспензорные клетки делятся с образованием нитевидного или сферического органа, который дегенерирует позже в эмбриогенезе.) И у голосеменных, и у покрытосеменных суспензор ориентирует абсорбирующую поверхность зародыша в сторону источника пищи; у покрытосеменных он также, по-видимому, служит проводником питательных веществ для развивающегося эмбриона. Культивирование изолированных зародышей алой фасоли с суспензором и без него продемонстрировало потребность в суспензоре на стадии сердцевины у двудольных (Yeung and Sussex 19).79). Эмбрионы, культивированные с суспензором, имеют в два раза больше шансов выжить, чем эмбрионы, культивированные без прикрепленного суспензора на этой стадии. Суспензор может быть источником гормонов. У алой побеговой фасоли молодые зародыши без суспензора могут выжить в культуре, если к ним добавляют гормон роста гибберелловую кислоту (Cionini et al., 1976).
Рисунок 20.16
Роль суспензора в эмбриогенезе двудольных.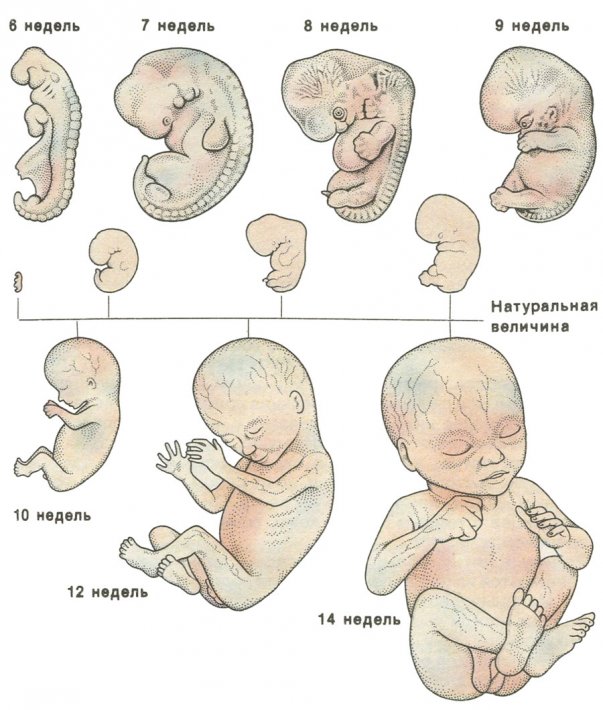 Культивирование зародышей фасоли алой с суспензором и без него показало, что суспензор необходим на стадии сердцевидной формы, но не позже. (После Юнга и Сассекса 1979.)
Культивирование зародышей фасоли алой с суспензором и без него показало, что суспензор необходим на стадии сердцевидной формы, но не позже. (После Юнга и Сассекса 1979.)
Поскольку установление апикально-базальной полярности является одним из ключевых достижений эмбриогенеза, полезно рассмотреть, почему собственно суспензор и зародыш развивают уникальные морфологии. Здесь особенно полезным оказалось изучение эмбриональных мутантов кукурузы и Arabidopsis . Исследования суспензорных мутантов ( sus1, sus2, и raspberry1 ) из Arabidopsis предоставили генетические доказательства того, что суспензор обладает способностью развивать эмбрионоподобные структуры (; Schwartz et al. 1994; Ядегари и др. 1994). У этих мутантов аномалии собственно эмбриона появляются до аномалий суспензора. † Более ранние эксперименты, в которых удаляли собственно эмбрион, также показали, что суспензоры могут развиваться подобно эмбрионам (Haccius 1963). Сигнал от эмбриона, свойственный суспензору, может быть важен для поддержания идентичности суспензора и блокирования развития суспензора как эмбриона. Молекулярный анализ этих и других генов позволяет понять механизмы коммуникации между суспензором и собственно эмбрионом.
Сигнал от эмбриона, свойственный суспензору, может быть важен для поддержания идентичности суспензора и блокирования развития суспензора как эмбриона. Молекулярный анализ этих и других генов позволяет понять механизмы коммуникации между суспензором и собственно эмбрионом.
Рисунок 20.17
Ген SUS подавляет эмбриональное развитие в суспензоре. (A) Эмбрион дикого типа и суспензор. (B) мутант sus с суспензором, развивающимся как эмбрион (стрелка). (C) Модель, показывающая, как собственно эмбрион подавляет эмбриональное развитие в суспензоре (подробнее…)
Гены материнского эффекта играют ключевую роль в установлении эмбрионального паттерна у животных (см. главу 9). Роль экстразиготных генов в эмбриогенезе растений менее ясна, и вопрос осложняется как минимум тремя потенциальными источниками влияния: спорофитной тканью, гаметофитной тканью и полиплоидным эндоспермом. Все эти ткани тесно связаны с яйцеклеткой/зиготой (луч 19).98). На развитие эндосперма также могут влиять материнские гены.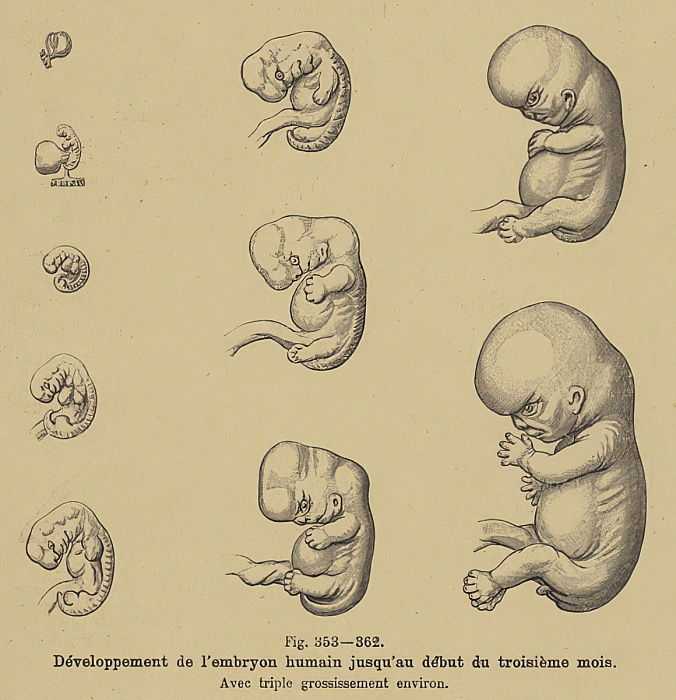 Гены спорофитного и гаметофитного материнского эффекта были идентифицированы у Arabidopsis, , и вполне вероятно, что геном эндосперма также влияет на зиготу. Первый идентифицированный ген материнского эффекта, SHORT INTEGUMENTS 1 ( SIN1 ), должен экспрессироваться в спорофите для нормального эмбрионального развития (Ray et al. 1996). Два фактора транскрипции (FBP7 и FBP11) необходимы в спорофите петунии для нормального развития эндосперма (Columbo et al. 19).97). Ген материнского эффекта женского гаметофита, MEDEA (в честь Медеи Еврипида, убившей своих собственных детей), имеет белковые домены, сходные с доменами гена материнского эффекта дрозофилы (Grossniklaus et al. 1998). Любопытно, что MEDEA относится к группе генов Polycomb (см. главу 9), продукты которых прямо или косвенно изменяют хроматин и влияют на транскрипцию. MEDEA воздействует на импринтированный ген (см. главу 5), который экспрессируется женским гаметофитом и аллелями, унаследованными от матери в зиготе, но не аллелями, унаследованными от отца (Vielle-Calzada et al.
Гены спорофитного и гаметофитного материнского эффекта были идентифицированы у Arabidopsis, , и вполне вероятно, что геном эндосперма также влияет на зиготу. Первый идентифицированный ген материнского эффекта, SHORT INTEGUMENTS 1 ( SIN1 ), должен экспрессироваться в спорофите для нормального эмбрионального развития (Ray et al. 1996). Два фактора транскрипции (FBP7 и FBP11) необходимы в спорофите петунии для нормального развития эндосперма (Columbo et al. 19).97). Ген материнского эффекта женского гаметофита, MEDEA (в честь Медеи Еврипида, убившей своих собственных детей), имеет белковые домены, сходные с доменами гена материнского эффекта дрозофилы (Grossniklaus et al. 1998). Любопытно, что MEDEA относится к группе генов Polycomb (см. главу 9), продукты которых прямо или косвенно изменяют хроматин и влияют на транскрипцию. MEDEA воздействует на импринтированный ген (см. главу 5), который экспрессируется женским гаметофитом и аллелями, унаследованными от матери в зиготе, но не аллелями, унаследованными от отца (Vielle-Calzada et al. 19).99). Насколько значимы гены материнского эффекта в установлении плана тела спорофита, все еще остается без ответа.
19).99). Насколько значимы гены материнского эффекта в установлении плана тела спорофита, все еще остается без ответа.
Радиальные и осевые паттерны развиваются по мере продолжения клеточного деления и дифференцировки (см. также Bowman 1994 для подробных световых микрофотографий эмбриогенеза Arabidopsis ). Клетки собственно зародыша делятся в поперечной и продольной плоскостях, образуя зародыш глобулярной стадии с несколькими ярусами клеток. Внешне эта стадия имеет некоторое сходство с дроблением у животных, но ядерно-цитоплазматическое отношение не обязательно увеличивается. Формирующаяся форма зародыша зависит от регуляции плоскостей клеточного деления и расширения, так как клетки не способны двигаться и изменять форму зародыша. Плоскости клеточного деления во внешнем слое клеток становятся ограниченными, и этот слой, называемый протодерма становится отчетливой. Радиальный паттерн появляется на глобулярной стадии, когда инициируются три тканевые системы (дермальная, основная и сосудистая) растения.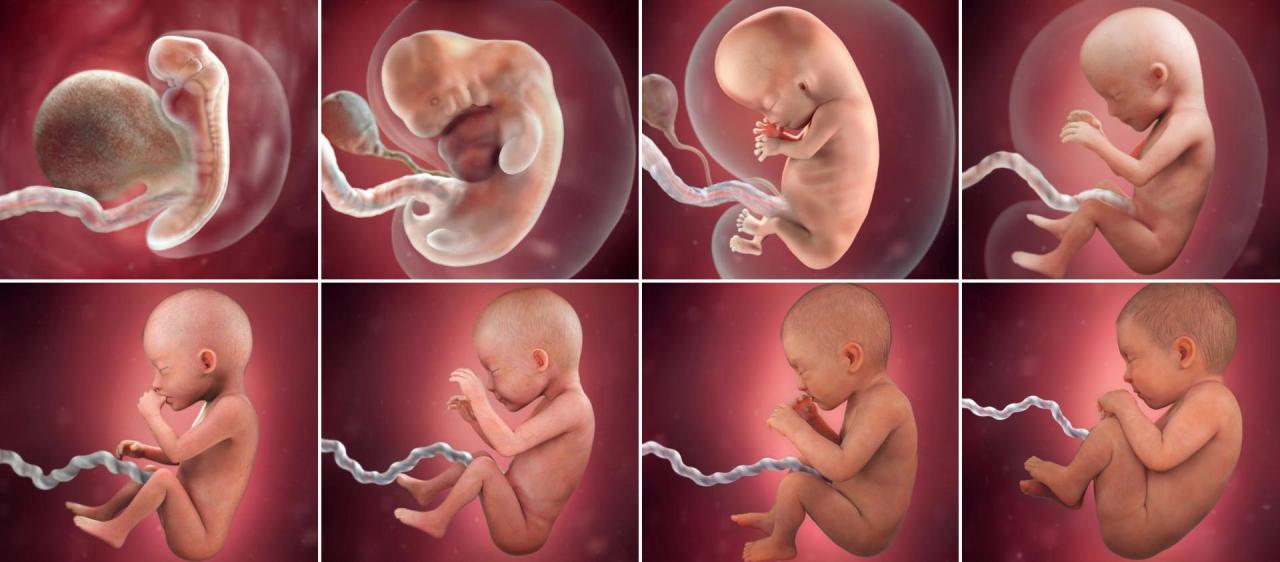 Кожная ткань (эпидермис) будет формироваться из протодермы и вносить вклад в внешние защитные слои растения. Основная ткань (кора и сердцевина) образуется из основной меристемы, лежащей под протодермой. Прокамбий , образующийся в ядре зародыша, дает начало сосудистая ткань (ксилема и флоэма), которая будет поддерживать и транспортировать. Дифференцировка каждой тканевой системы по крайней мере частично независима. Например, у keule мутанта Arabidopsis, кожная система дефектна, в то время как внутренние тканевые системы развиваются нормально (Mayer et al. 1991).
Кожная ткань (эпидермис) будет формироваться из протодермы и вносить вклад в внешние защитные слои растения. Основная ткань (кора и сердцевина) образуется из основной меристемы, лежащей под протодермой. Прокамбий , образующийся в ядре зародыша, дает начало сосудистая ткань (ксилема и флоэма), которая будет поддерживать и транспортировать. Дифференцировка каждой тканевой системы по крайней мере частично независима. Например, у keule мутанта Arabidopsis, кожная система дефектна, в то время как внутренние тканевые системы развиваются нормально (Mayer et al. 1991).
Рисунок 20.18
Радиальное и осевое формирование. (A) Радиальное формирование паттерна у покрытосеменных начинается на глобулярной стадии и приводит к установлению трех тканевых систем. (B) Осевой паттерн (ось отростка-корня) устанавливается стадией сердца.
Шаровидная форма зародыша теряется, когда начинают формироваться семядоли («первые листья»).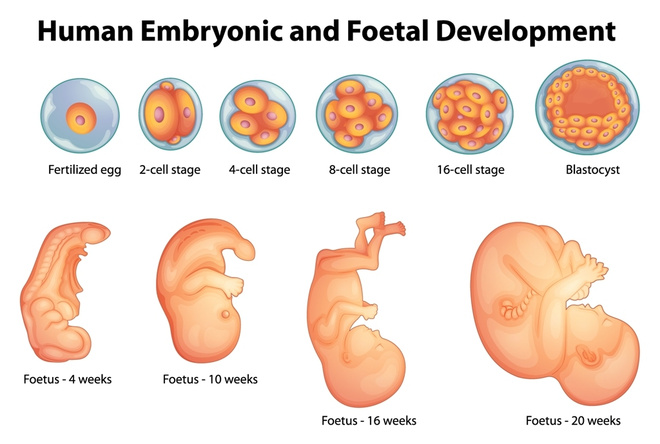 Двудольные имеют две семядоли, которые при формировании зародыша придают ему форму сердца. Осевой план тела очевиден на этой сердечной стадии развития. Гормоны (в частности, ауксины) могут опосредовать переход от радиальной к билатеральной симметрии (Liu et al. 1993). У однодольных, таких как кукуруза, появляется только одна семядоля.
Двудольные имеют две семядоли, которые при формировании зародыша придают ему форму сердца. Осевой план тела очевиден на этой сердечной стадии развития. Гормоны (в частности, ауксины) могут опосредовать переход от радиальной к билатеральной симметрии (Liu et al. 1993). У однодольных, таких как кукуруза, появляется только одна семядоля.
У многих растений семядоли помогают питать растение, становясь фотосинтезирующими после прорастания (хотя у некоторых видов семядоли никогда не появляются из земли). В некоторых случаях, например у гороха, пищевые запасы в эндосперме расходуются еще до прорастания, и источником питания для прорастающего проростка служат семядоли. ‡ Даже при наличии стойкого эндосперма (как у кукурузы) семядоли хранят пищевые запасы, такие как крахмал, липиды и белки. У многих однодольных семядоля вырастает в большой орган, прижатый к эндосперму, и способствует переносу питательных веществ к проростку. Вертикальные семядоли могут придавать зародышу торпедообразную форму. У некоторых растений семядоли вырастают настолько длинными, что им приходится изгибаться, чтобы поместиться в пределах семенной кожуры. Тогда эмбрион выглядит как трость. К этому моменту подвеска дегенерирует.
У некоторых растений семядоли вырастают настолько длинными, что им приходится изгибаться, чтобы поместиться в пределах семенной кожуры. Тогда эмбрион выглядит как трость. К этому моменту подвеска дегенерирует.
Апикальная меристема побега и апикальная меристема корня представляют собой кластеры стволовых клеток, которые сохраняются в постэмбриональном растении и дают начало большей части тела спорофита. У некоторых видов корневая меристема частично происходит из гипофиза. Все остальные части тела спорофита происходят от собственно зародыша. Генетические данные указывают на то, что образование побегов и корневых меристем регулируется независимо. Эту независимость демонстрируют dek23 мутант кукурузы и без побегов ( STM ) мутант Arabidopsis, , оба из которых образуют корневую меристему, но не могут инициировать меристему побега (Clark and Sheridan 1986; Barton and Poethig 1993). Ген STM , который был клонирован, экспрессируется на поздней глобулярной стадии, до образования семядолей. Также были идентифицированы гены, которые специфически влияют на развитие корневой оси во время эмбриогенеза. Мутации ХОББИТ гена Arabidopsis (Willemsen et al. 1998), например, влияет на производные гипофиза и устраняет функцию корневой меристемы.
Также были идентифицированы гены, которые специфически влияют на развитие корневой оси во время эмбриогенеза. Мутации ХОББИТ гена Arabidopsis (Willemsen et al. 1998), например, влияет на производные гипофиза и устраняет функцию корневой меристемы.
Верхушечная меристема побега будет инициировать листья после прорастания и, в конечном итоге, перехода к репродуктивному развитию. У Arabidopsis , семядоли образуются из общей эмбриональной ткани, а не из меристемы побега (Barton and Poethig 1993). У многих покрытосеменных растений во время эмбриогенеза закладывается несколько листьев. В случае 9Клональный анализ 0041 Arabidopsis, указывает на наличие листьев у зрелого зародыша, даже если они морфологически недостаточно развиты (Irish and Sussex 1992). Клональный анализ показал, что семядоли и два первых настоящих листа хлопчатника происходят из эмбриональной ткани, а не из организованной меристемы (Christianson 1986).
Эксперименты по клональному анализу предоставляют информацию о судьбе клеток, но не обязательно указывают, определены ли клетки для конкретной судьбы.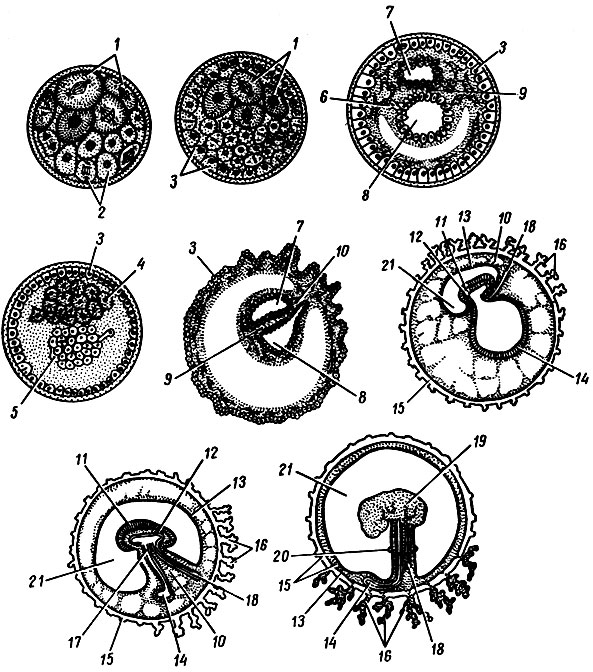 Показано, что клетки, ткани и органы детерминируются, когда они имеют одинаковую судьбу in situ, изолированно и в новом положении в организме (см. McDaniel et al. 19).92 для получения дополнительной информации о стадиях развития растений). Клональный анализ показал, что клетки, которые делятся не в той плоскости и «переходят» в другой слой ткани, часто дифференцируются в соответствии со своим новым положением. Положение, а не клональное происхождение, по-видимому, является критическим фактором в формировании паттерна эмбриона, указывая на некоторый тип межклеточной коммуникации (Laux and Jurgens 1994). Микрохирургические эксперименты на соматических зародышах моркови демонстрируют, что изолированные части зародыша часто могут заменить отсутствующий набор частей (Schiavone and Racusen 19).90; Шерес и Хейдстра, 1999). Семядоли, удаленные с верхушки побега, будут заменены. Изолированные зародышевые побеги могут регенерировать новый корень; изолированная ткань корня регенерирует семядоли, но с меньшей вероятностью регенерирует ось побега.
Показано, что клетки, ткани и органы детерминируются, когда они имеют одинаковую судьбу in situ, изолированно и в новом положении в организме (см. McDaniel et al. 19).92 для получения дополнительной информации о стадиях развития растений). Клональный анализ показал, что клетки, которые делятся не в той плоскости и «переходят» в другой слой ткани, часто дифференцируются в соответствии со своим новым положением. Положение, а не клональное происхождение, по-видимому, является критическим фактором в формировании паттерна эмбриона, указывая на некоторый тип межклеточной коммуникации (Laux and Jurgens 1994). Микрохирургические эксперименты на соматических зародышах моркови демонстрируют, что изолированные части зародыша часто могут заменить отсутствующий набор частей (Schiavone and Racusen 19).90; Шерес и Хейдстра, 1999). Семядоли, удаленные с верхушки побега, будут заменены. Изолированные зародышевые побеги могут регенерировать новый корень; изолированная ткань корня регенерирует семядоли, но с меньшей вероятностью регенерирует ось побега. Хотя большинство эмбриональных клеток плюрипотентны и могут образовывать такие органы, как семядоли и листья, только меристемы сохраняют эту способность в постэмбриональном теле растения.
Хотя большинство эмбриональных клеток плюрипотентны и могут образовывать такие органы, как семядоли и листья, только меристемы сохраняют эту способность в постэмбриональном теле растения.
Модели позволят ученым изучать самые ранние стадии эмбрионального развития
В лаборатории
By Эндрю Джозеф 17 марта 2021 г.
Перепечатки
Эмбрион человека на стадии бластоцисты, примерно через шесть дней после оплодотворения, осмотр под световым микроскопом. Коллекция K. Hardy/WellcomeПара исследовательских групп представила два новых способа воспроизведения ключевой структуры с самых первых дней эмбрионального развития — достижение, которое может дать важные новые сведения о развитии человека и прерывании беременности, но которые также поднимают острые вопросы об исследованиях с эмбрионоподобными модели.
Модели, описанные в двух статьях, опубликованных в среду в журнале Nature, предназначены для имитации человеческих бластоцист.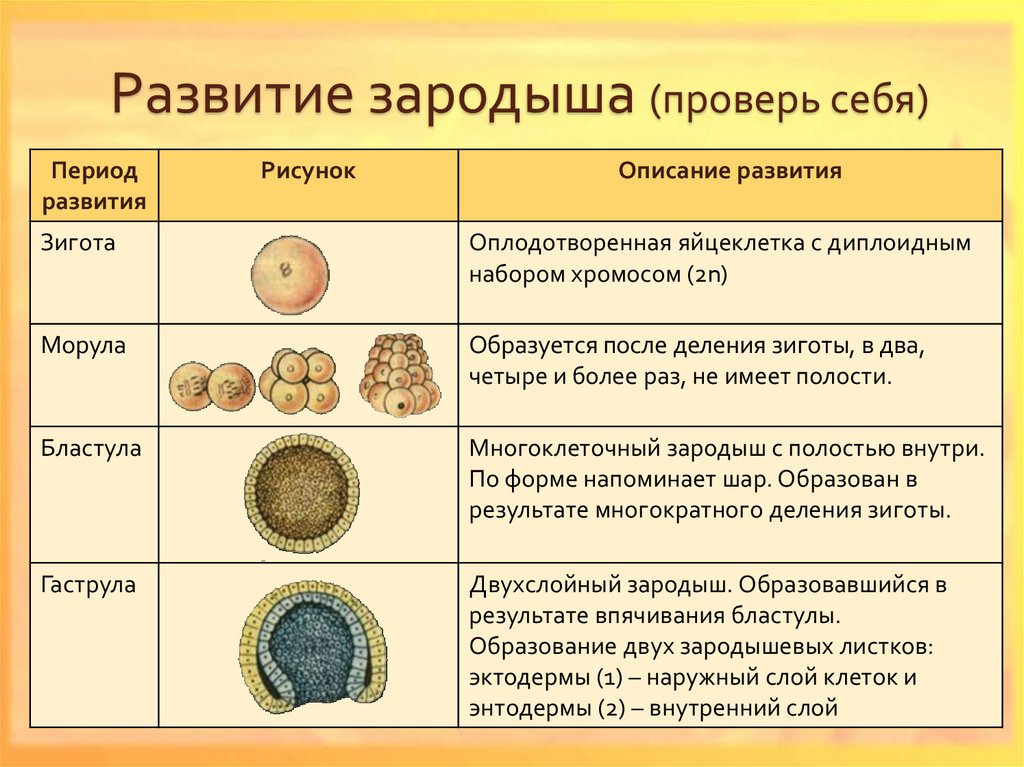 Бластоцисты — это шары, которые образуются примерно через пять дней после оплодотворения яйцеклетки. Каждая из них содержит внешний слой клеток, который в конечном итоге способствует образованию плаценты, и внутреннюю массу клеток, дающую начало самому эмбриону. Это то, что имплантируется в матку по мере формирования беременности.
Бластоцисты — это шары, которые образуются примерно через пять дней после оплодотворения яйцеклетки. Каждая из них содержит внешний слой клеток, который в конечном итоге способствует образованию плаценты, и внутреннюю массу клеток, дающую начало самому эмбриону. Это то, что имплантируется в матку по мере формирования беременности.
Исследователи считают, что лучшее понимание бластоцист, того, как их клетки взаимодействуют и как они закладывают основу для следующих этапов беременности, могло бы расширить наши знания о развитии человека, а также о том, почему на этом этапе происходит так много выкидышей. Но до сих пор запросы были ограничены. Чтобы изучить эту фазу сейчас, ученые полагаются на избыточные бластоцисты, созданные с помощью ЭКО — ограниченный ресурс — или на мышиные модели, называемые бластоидами. Команды, работающие над новой работой, надеются, что их модели, похожие на бластоцисты, смогут обеспечить готовый запас реальных заменителей и лучшую имитацию, чем мышиные бластоиды.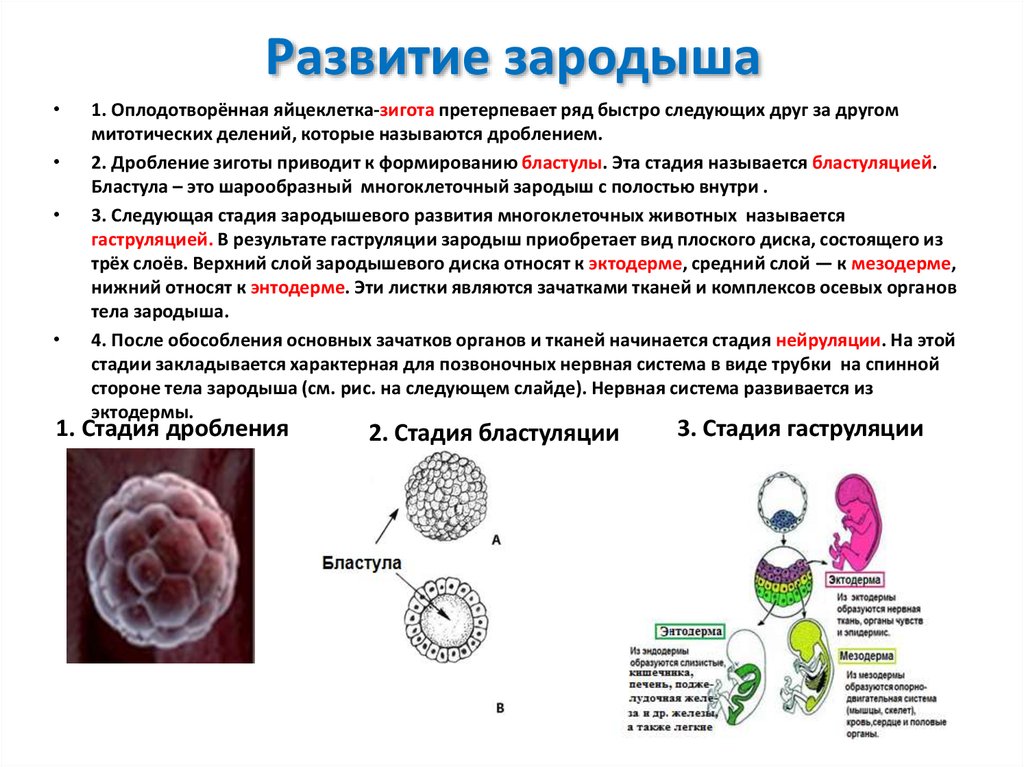 С их помощью ученые могли изучать влияние различных токсинов, патогенов и генетических мутаций на делящиеся клетки.
С их помощью ученые могли изучать влияние различных токсинов, патогенов и генетических мутаций на делящиеся клетки.
реклама
Исследовательские группы, одну из которых возглавлял Хосе Поло из Университета Монаш, а другую — Джун Ву из Юго-западного медицинского центра Техасского университета, назвали свои модели «iBlastoids» и «человеческие бластоиды» соответственно.
«Они позволят нам теперь изучать в масштабе самые ранние этапы человеческого развития без необходимости использовать бластоцисты, полученные в результате ЭКО», — сказал Поло.
реклама
Исследователи подчеркнули, что при всем сходстве, которое делает их бластоиды практическими исследовательскими инструментами, существуют ключевые различия в составе и функциях бластоидов, которые отличают их от настоящих бластоцист и ограничивают их использование в лабораторных экспериментах.
«Мы считаем, что [наши] бластоиды также нежизнеспособны», — сказал Ву, имея в виду, что они не могут стать детьми.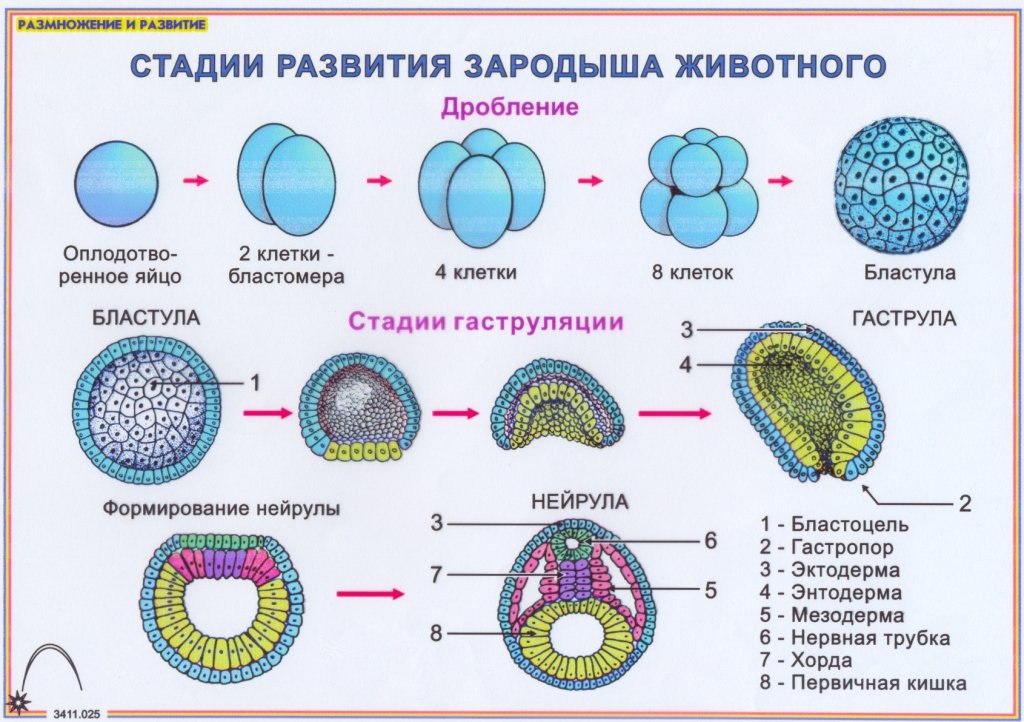
Две команды использовали разные подходы в своих рецептах для создания своих бластоидов, начиная с разных типов клеток и применяя различные биохимические волшебства, чтобы перепрограммировать их на формирование клеточных капель. Но обе модели бластоидов в конечном итоге имели сходную архитектуру, типы клеток и особенности с реальными бластоцистами.
Джанет Россант, специалист по стволовым клеткам и биологу развития из Госпиталя для больных детей в Торонто, не участвовавшая в исследовании, сказала, что модели могут быть полезны для изучения того, как клетки «в основном разговаривают друг с другом, чтобы создать ранний эмбрион и как эмбрион имплантируется в матку». Но она отметила, что процессы, описанные командами для создания бластоидов, не были особенно эффективными, и их нужно было бы усовершенствовать, если для исследований будет создано много структур.
Любые исследования с участием человеческих эмбрионов или даже моделей, имитирующих эмбриональное развитие, неизбежно поднимают этические вопросы.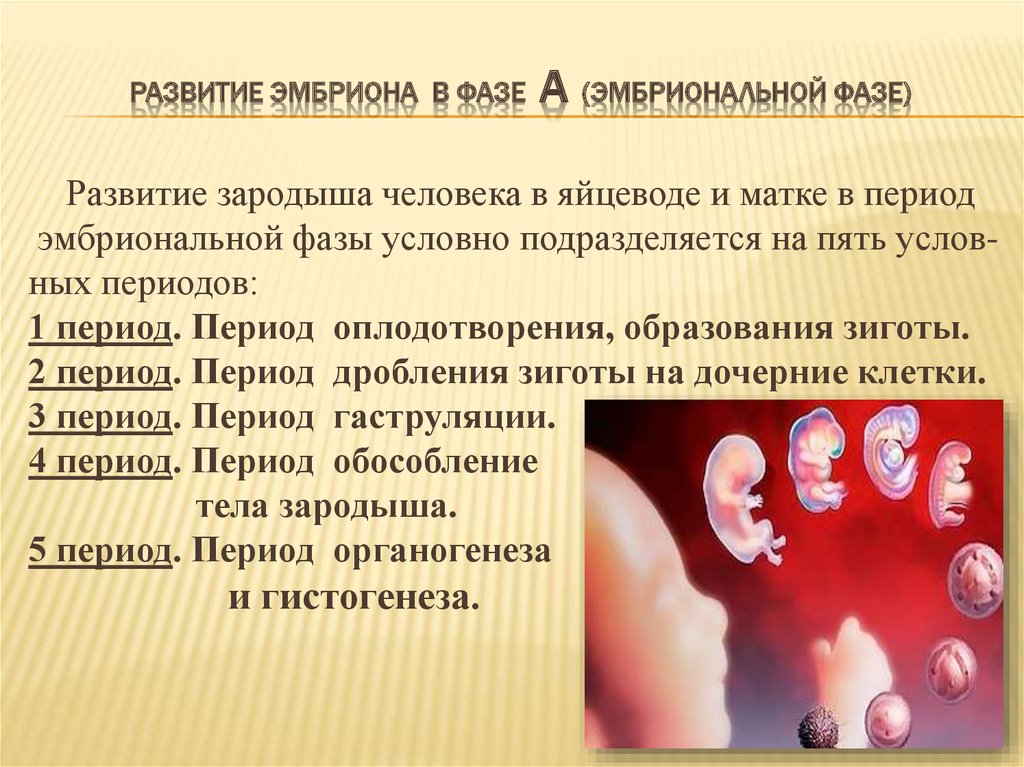 Улучшения в исследованиях стволовых клеток и способность ученых преобразовывать один тип клеток в другой раздвинули границы науки.
Улучшения в исследованиях стволовых клеток и способность ученых преобразовывать один тип клеток в другой раздвинули границы науки.
На данный момент руководящие принципы — а в некоторых странах и законы — запрещают культивирование в лабораторных чашках человеческих эмбрионов в течение более 14 дней после оплодотворения, по сути, до того, как они разовьются слишком далеко. Международное общество исследований стволовых клеток в настоящее время пересматривает свои рекомендации по исследованиям стволовых клеток и эмбрионов, которые могут касаться «правила 14 дней», и планирует выпустить обновленные рекомендации в мае. Во вторник MIT Technology Review сообщил, что в проекте руководства группы будет рекомендовано проводить эксперименты с зеленым светом, которые продлятся более 14 дней, если советы по этике и национальная политика разрешат эту работу.
Ученые выразили надежду, что обновленные рекомендации ISSCR будут специально учитывать исследования с использованием таких моделей, как эти эмбрионоподобные структуры, которые на самом деле нежизнеспособны в качестве эмбрионов.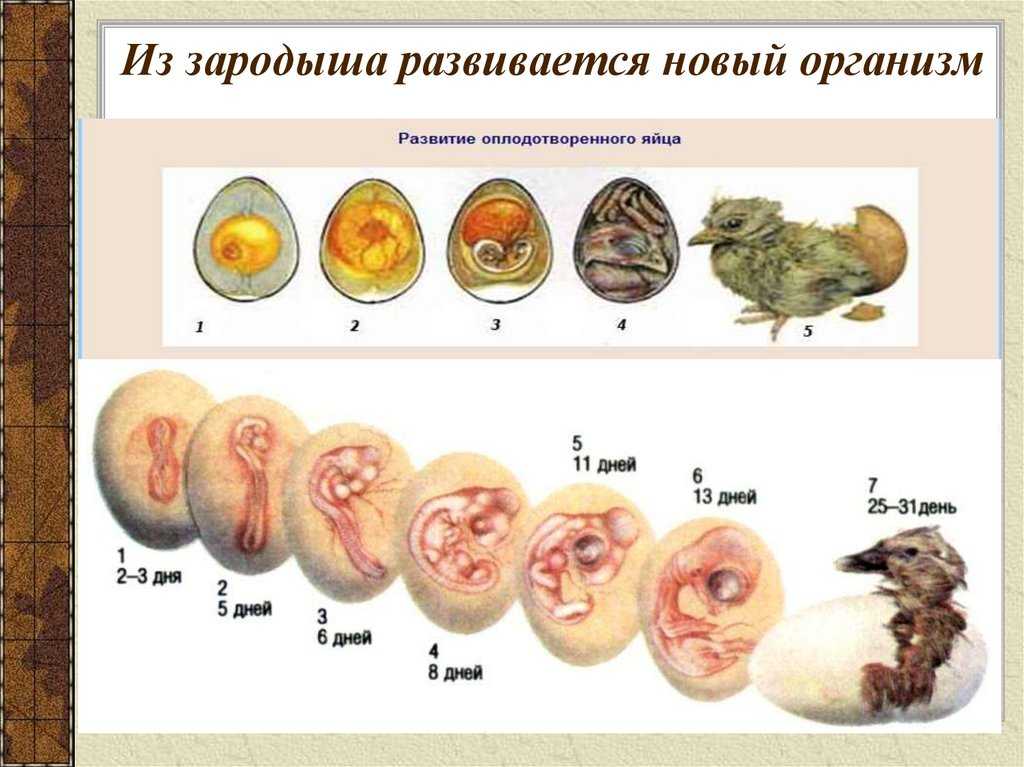 Как написали Йи Чжэн и Цзяньпин Фу из Мичиганского университета в комментарии, опубликованном вместе с двумя исследовательскими работами, «по мере оптимизации протоколов эти бластоиды будут более точно имитировать человеческие бластоцисты. Это неизбежно приведет к биоэтическим вопросам. Каков должен быть этический статус бластоидов человека и как их следует регулировать? Следует ли применять правило 14 дней?»
Как написали Йи Чжэн и Цзяньпин Фу из Мичиганского университета в комментарии, опубликованном вместе с двумя исследовательскими работами, «по мере оптимизации протоколов эти бластоиды будут более точно имитировать человеческие бластоцисты. Это неизбежно приведет к биоэтическим вопросам. Каков должен быть этический статус бластоидов человека и как их следует регулировать? Следует ли применять правило 14 дней?»
В случае с новым исследованием обе команды культивировали свои бластоиды всего несколько дней, достаточно долго, чтобы показать, что они действительно во многих отношениях ведут себя как настоящие бластоцисты. Установлено правило 14 дней, чтобы остановить эксперименты до того, как эмбрион сформирует раннюю структуру, называемую примитивной полосой, — точку, в которой он больше не может делиться на близнецов, — поэтому исследовательские группы остановились до того, как в их моделях могла сформироваться примитивная полоса. Исследователи отметили, что сама концепция 14 дней не может быть применима к их бластоцистоподобным структурам, потому что они произошли не из оплодотворенной яйцеклетки.