Вы знаете, что буква Ш всегда твердая?: janelis — LiveJournal
Вы знаете, что буква Ш всегда твердая?: janelis — LiveJournal ?- Образование
- Cancel
- Mood: Ура! Каникулы!
Пошла и я во Владькину гимназию, отодвинув все свои грандиозные планы до лучших времен (ну не судьба мне попась на вторую ступень моих танцев, подожду до следующего года :-().
Зато в школе порадовали, хвалили моего самостоятельного мальчика на все лады, по всем предметам (кроме письма) он молодец.
 На письме до высшего балла он не дотягивает, хотя на мой взгляд пишет очень красиво. А какая там китайская грамота с цветовыми обозначениями звонких-глухих-твердых-мягких звуков — мама не горюй!!
На письме до высшего балла он не дотягивает, хотя на мой взгляд пишет очень красиво. А какая там китайская грамота с цветовыми обозначениями звонких-глухих-твердых-мягких звуков — мама не горюй!!Каникулы у этих халявщиков аж с 22 декабря, только елка еще 24-го, и все — швабода!!
Значит,будет мой сын в сад с сестрой неделю ходить, пока в Питер не уедет. Не, ну это ж надо — 18 дней каникул, чтоб мы так учились!!
Subscribe
четвергопятница
Замечательный ритм жизни, когда можно каждые выходные уезжать на дачу.
 Я все детство недоумевала на бабушку с дедушкой — зачем они постоянно катаются…
Я все детство недоумевала на бабушку с дедушкой — зачем они постоянно катаются…4.11
Анна 3020 г 49 см Все дома, все в порядке. Тесный ноябрь на дни рождения становится! 🙂
техника в руках дикаря — …
Пролактин делает свое черное дело — логическое мышление отдыхает где-то далеко-далеко. Пыталась сегодня 20 минут взбить белки новым комбайном.…
Photo
Hint http://pics.livejournal.com/igrick/pic/000r1edq
- 13 comments
четвергопятница
Замечательный ритм жизни, когда можно каждые выходные уезжать на дачу. Я все детство недоумевала на бабушку с дедушкой — зачем они постоянно катаются…
4.11
Анна 3020 г 49 см Все дома, все в порядке. Тесный ноябрь на дни рождения становится! 🙂
техника в руках дикаря — .
 ..
..Пролактин делает свое черное дело — логическое мышление отдыхает где-то далеко-далеко. Пыталась сегодня 20 минут взбить белки новым комбайном.…
|
|
4.2: Жесткие и мягкие кислоты и основания
- Последнее обновление
- Идентификатор страницы
- 274911
- Кай Ландскрон
- Университет Лихай
Концепция твердых и мягких оснований (HSAB)
Концепция жестких и мягких кислот и оснований (HSAB) может быть задумана как усовершенствование концепции кислот и оснований Льюиса. Его наиболее полезной особенностью является то, что он может делать прогнозы о силе кислотно-основных взаимодействий. Он также может оценить, являются ли взаимодействия более ионными или более ковалентными.
Его наиболее полезной особенностью является то, что он может делать прогнозы о силе кислотно-основных взаимодействий. Он также может оценить, являются ли взаимодействия более ионными или более ковалентными.
4.2.1 Визуальное представление неполяризованного атома и атома, поляризованного в электрическом поле.
Сначала уточним, что подразумевается под твердым и мягким соответственно. Эти термины относятся к поляризуемости электронов в атоме или молекуле (рис. 4.2.1). Атом мягкий, когда его электроны легко поляризуются. Это означает, что электронное облако легко деформируется в электрическом поле. Легкая деформация согласуется с термином «мягкий». В электрическом поле отрицательно заряженные электроны притягиваются к положительному полюсу электрического поля. Поэтому электронное облако искажается в сторону положительного конца электрического поля, и атом поляризуется. И наоборот, когда электронное облако не поляризуется легко, мы говорим, что атом твердый. Что же тогда подразумевается под жесткой и мягкой кислотой или основанием? Жесткая или мягкая кислота — это жесткая или мягкая кислота Льюиса, а жесткое или мягкое основание — это жесткое или мягкое основание Льюиса. Как упоминалось ранее, концепция HSAB полезна, потому что она делает утверждения о силе кислотно-основных взаимодействий и, следовательно, прочности связей. Он также может делать утверждения о том, является ли связь более ковалентной или более ионной (рис. 4.2.2).
Что же тогда подразумевается под жесткой и мягкой кислотой или основанием? Жесткая или мягкая кислота — это жесткая или мягкая кислота Льюиса, а жесткое или мягкое основание — это жесткое или мягкое основание Льюиса. Как упоминалось ранее, концепция HSAB полезна, потому что она делает утверждения о силе кислотно-основных взаимодействий и, следовательно, прочности связей. Он также может делать утверждения о том, является ли связь более ковалентной или более ионной (рис. 4.2.2).
Как правило, жестко-жесткие взаимодействия, то есть взаимодействия между жесткой кислотой и жестким основанием, имеют тенденцию быть сильными. Связь скорее ионная. Мягко-мягкие взаимодействия также имеют тенденцию быть сильными, но они, скорее всего, ковалентны. Жестко-мягкие взаимодействия имеют тенденцию быть слабыми.
Рисунок 4.2.3 Размер донорных атомов влияет на жестко-мягкое поведение Почему мягко-мягкие и жестко-жесткие взаимодействия сильны, а жестко-мягкие взаимодействия слабы? Чтобы ответить на этот вопрос, мы должны сначала понять, что делает кислоту или основание твердыми или мягкими. В целом можно сказать, что чем более делокализованы электроны, тем мягче частицы. Для отдельного атома или иона это означает, что чем больше атом или ион, тем мягче частицы. Чем больше размер атома, тем более делокализованы его валентные электроны. Размер нейтрального атома определяется его положением в периодической таблице. Как правило, чем выше период, тем мягче атом (рис. 4.2.3).
В целом можно сказать, что чем более делокализованы электроны, тем мягче частицы. Для отдельного атома или иона это означает, что чем больше атом или ион, тем мягче частицы. Чем больше размер атома, тем более делокализованы его валентные электроны. Размер нейтрального атома определяется его положением в периодической таблице. Как правило, чем выше период, тем мягче атом (рис. 4.2.3).
Для ионов также играет роль заряд. Для катионов более высокий положительный заряд делает катион более жестким, для анионов более высокий отрицательный заряд делает анион более мягким (рис. 4.2.4).
Рисунок 4.2.5 Влияние π-связи на жесткость и мягкость Размер донорно-акцепторного атома — не единственный фактор, определяющий твердость. Также важна способность вида образовывать π-связь. Виды, у которых есть орбитали, подходящие для π-связей, имеют тенденцию быть мягкими, даже если аргументы размера предполагают, что они твердые. Это связано с тем, что π-связь увеличивает делокализацию электронов (рис. 4.2.5).
4.2.5).
Например, у переходных металлов есть доступные d-орбитали, которые подходят для π-связи с лигандами, а у щелочных металлов нет. Следовательно, относительно небольшой катион переходного металла, такой как Cu + , мягче, чем крупные ионы щелочного металла, такие как Cs + . Для анионов также важна π-связь. Например, анионы CN — являются мягкими основаниями, хотя донорный атом углерода мал, потому что лиганд CN — имеет π-орбитали, доступные для π-связи с кислотами Льюиса.
Рисунок 4.2.6 Критерий перекрытия орбит Итак, вернемся к вопросу: почему взаимодействия мягкого-мягкого и жесткого-жесткого являются сильными, а взаимодействия жесткого-мягкого слабыми? По сути, это сводится к правилу 2 критерия перекрытия орбит (см. главу 3 по теории МО). Две маленькие орбитали обычно имеют хорошее перекрытие, а две большие орбитали также имеют хорошее перекрытие, и поэтому взаимодействие сильное. Однако большие и малые орбитали, как правило, имеют слабое перекрытие орбиталей и, следовательно, слабое связывание.
Теперь к вопросу о том, почему взаимодействия мягко-мягко имеют тенденцию быть более ковалентными, тогда как взаимодействия жестко-жестко имеют тенденцию быть более ионными. Ответ связан с тем фактом, что в меньших атомах разница энергий между атомными орбиталями, как правило, больше, чем в больших атомах. Как следствие, статистически более вероятно, что ВЗМО и НСМО двух мягких видов имеют более близкие энергии по сравнению с двумя твердыми видами. Когда ВЗМО и НСМО кислоты Льюиса и основания Льюиса имеют одинаковую энергию, тогда связь является более ковалентной. Когда они значительно различаются, то связь более ионная.
Рис. 4.2.7 Жестко-жесткие ковалентные взаимодействия в оксиде лития Проиллюстрируем это двумя качественными примерами. Оксид лития состоит из анионов O 2- и катионов Li + . Если рассматривать ионную связь между ионами О 2- и ионами Li + как крайний случай полярной, дательной связи, то оксид-анион выступает в роли основания Льюиса, а ион Li + — в роли основания Льюиса.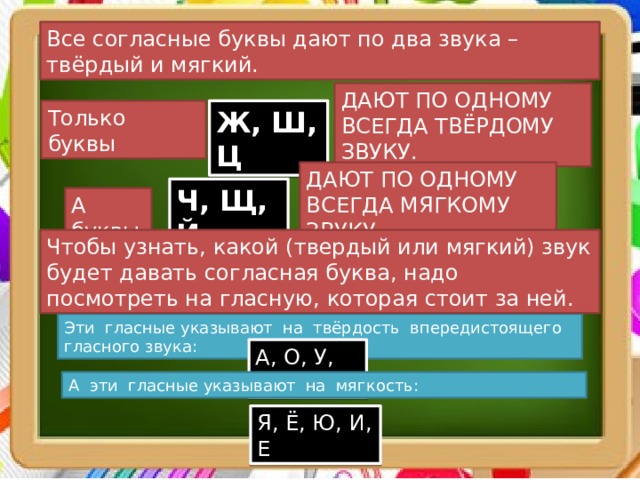 кислота Льюиса. Как можно объяснить высокую ионность? И Li + , и O 2- — маленькие ионы, поэтому они оба жесткие. Небольшой размер также означает, что разница энергий между атомными орбиталями велика. Из-за этого маловероятно, что высшая занятая атомная орбиталь иона O 2- имеет такую же энергию, как и низшая незанятая атомная орбиталь иона Li + . Из-за большой разности энергий связывающая МО будет практически полностью локализована на анионе О 2-, а связь будет ионной (рис. 4.2.7).
кислота Льюиса. Как можно объяснить высокую ионность? И Li + , и O 2- — маленькие ионы, поэтому они оба жесткие. Небольшой размер также означает, что разница энергий между атомными орбиталями велика. Из-за этого маловероятно, что высшая занятая атомная орбиталь иона O 2- имеет такую же энергию, как и низшая незанятая атомная орбиталь иона Li + . Из-за большой разности энергий связывающая МО будет практически полностью локализована на анионе О 2-, а связь будет ионной (рис. 4.2.7).
Примером соединения с сильными мягкими-мягкими взаимодействиями является иодид серебра. Хотя AgI считается ионным соединением, взаимодействия имеют значительно более сильный ковалентный характер. Мягкую природу Ag + легко понять из того факта, что Ag + представляет собой ион переходного металла периода 5 с низким положительным зарядом и d-орбиталями, доступными для π-связи. Йод является элементом 6-го периода, поэтому йодид довольно мягкий. Поскольку Ag и I являются элементами периода 5 и 6 соответственно, разница их орбитальной энергии значительно меньше, чем у O и Li, которые являются элементами периода 2. Таким образом, ВЗМО I — и НСМО Ag + , естественно, ближе по энергии, что приводит к более ковалентному взаимодействию (рис. 4.2.8).
Йод является элементом 6-го периода, поэтому йодид довольно мягкий. Поскольку Ag и I являются элементами периода 5 и 6 соответственно, разница их орбитальной энергии значительно меньше, чем у O и Li, которые являются элементами периода 2. Таким образом, ВЗМО I — и НСМО Ag + , естественно, ближе по энергии, что приводит к более ковалентному взаимодействию (рис. 4.2.8).
Мы должны понимать, что к этим соображениям нужно относиться с осторожностью. Например, связи В-О довольно ковалентны, несмотря на то, что и В, и О довольно жесткие. ВЗМО донора и НСМО акцептора твердых частиц не обязательно сильно различаются. Другие параметры, такие как различия в электроотрицательности, также имеют значение, и их необходимо учитывать, чтобы правильно предсказать природу химической связи.
Примеры — Основания
Чтобы получить представление о правильной оценке твердости породы, рассмотрим несколько примеров. Начнем с некоторых основ.
Рисунок 4.2.9 Пример оснований Какие утверждения о твердости можно сделать для серий F — , Cl — , Br — , I — (рис. 4.2.9). Все они представляют собой ионы галогенидов с одинаковым отрицательным зарядом. Размер увеличивается от фторида до хлорида, от бромида до йодида. Таким образом, мягкость должна увеличиваться в том же порядке. Ф — — это небольшой ион с небольшим отрицательным зарядом и должен быть твердым, I — очень тяжелый элемент, поэтому I — очень мягкий. Cl — и Br — являются умеренно жесткими и мягкими ионами соответственно.
4.2.9). Все они представляют собой ионы галогенидов с одинаковым отрицательным зарядом. Размер увеличивается от фторида до хлорида, от бромида до йодида. Таким образом, мягкость должна увеличиваться в том же порядке. Ф — — это небольшой ион с небольшим отрицательным зарядом и должен быть твердым, I — очень тяжелый элемент, поэтому I — очень мягкий. Cl — и Br — являются умеренно жесткими и мягкими ионами соответственно.
Далее рассмотрим ряд H 2 O, OH — , O 2 — , CH 3 O — и PhO — . Все виды содержат небольшие донорные атомы O, поэтому все их следует считать жесткими. ОН 9Ион 0052 — несколько мягче, чем H 2 O из-за отрицательного заряда, который увеличивает размер донорного атома O. По той же причине O 2- несколько мягче, чем OH —. CH 3 O — несколько мягче, чем O 2- из-за положительного индуктивного эффекта метильной группы. Ион фенолята является самым мягким, потому что отрицательный заряд O может быть делокализован в ароматическом кольце. Делокализация отрицательного заряда приводит к большей поляризуемости и, следовательно, к мягкости. Мы могли бы также подумать о том, если бы F — , вероятно, будет тверже или мягче, чем H 2 O. F немного меньше, чем O, но F несет отрицательный заряд, поэтому случай неоднозначен.
Ион фенолята является самым мягким, потому что отрицательный заряд O может быть делокализован в ароматическом кольце. Делокализация отрицательного заряда приводит к большей поляризуемости и, следовательно, к мягкости. Мы могли бы также подумать о том, если бы F — , вероятно, будет тверже или мягче, чем H 2 O. F немного меньше, чем O, но F несет отрицательный заряд, поэтому случай неоднозначен.
Далее рассмотрим ряды NH 3 , CH 3 NH 2 и PhNH 2 (рис. 4.2.11). Донорный атом азота представляет собой небольшой малополяризуемый атом, поэтому его следует считать жестким. Однако N несколько больше, чем O, что означает, что NH 3 несколько мягче, чем H 2 O. CH 3 NH 2 будет немного мягче, чем NH 3 , из-за положительного индуктивного эффекта метильной группы, а анилин будет немного мягче, чем метиламин, потому что о возможности делокализации неподеленной пары при N в ароматическом кольце.
Как насчет H 2 S, алкилтиолов и диалкилтиолов (4.2.12)? Донорный атом S находится в 3-м периоде и достаточно велик, чтобы считаться мягким. Можно было бы ожидать, что мягкость несколько увеличится по сравнению с H 2 S на R-SH на R-S-R из-за положительного индуктивного эффекта алкильной группы.
Рисунок 4.2.13 Пример PR 3Следующим примером является фосфин общей формулы PR 3 (4.2.13). Как и сера, фосфор является донорным атомом периода 3, а фосфины обычно мягкие.
Рисунок 4.2.14 Пример серии с донорными атомами C Наконец, давайте рассмотрим монооксид углерода и цианид (рис. 4.2.14). На первый взгляд эти частицы кажутся твердыми основаниями из-за небольших донорных атомов углерода. Однако на самом деле они довольно мягкие из-за их способности использовать свои π- и π*-орбитали в π-связях с кислотами Льюиса, в частности с ионами переходных металлов. Мы подробнее рассмотрим этот вопрос позже, когда будем подробно обсуждать связи в комплексах переходных металлов.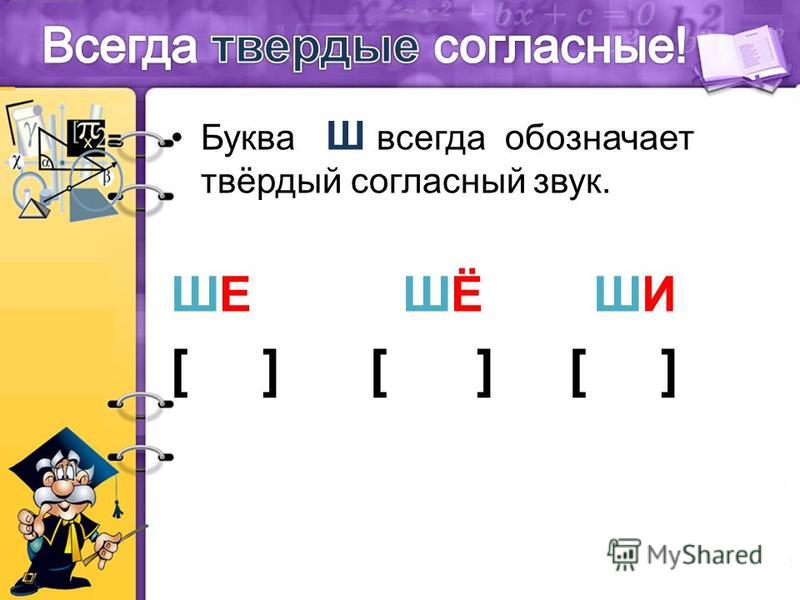
Пример — Кислоты
Теперь давайте подумаем о жесткости кислот.
Рисунок 4.2.15 Пример ряда катионов щелочных металловВ ряду H + , Li + , Na + , K + : Это жесткие или мягкие кислоты и как изменяется жесткость в этом ряду (рис. 4.2.15)? Ответ: Все катионы щелочных металлов считаются жесткими кислотами, даже относительно большой катион К + в 4-м периоде. Это связано с тем, что катионы щелочных металлов имеют только s-валентные орбитали и, следовательно, не имеют орбиталей, подходящих для π-связи. В серии H + — самая твердая, а K + — самая мягкая, потому что ионный радиус увеличивается с увеличением периода.
Рисунок 4.2.16 Пример ряда катионов щелочноземельных металлов Точно так же щелочноземельные металлы Be 2 + , Mg 2+ и Ca 2 + являются твердыми катионами с уменьшением жесткости от Be 2 + до Ca 2 + . Из-за заряда 2+ катионы щелочноземельных металлов считаются более твердыми, чем катионы щелочных металлов того же периода, например Be 2 + следует оценивать сложнее, чем Li + .
Из-за заряда 2+ катионы щелочноземельных металлов считаются более твердыми, чем катионы щелочных металлов того же периода, например Be 2 + следует оценивать сложнее, чем Li + .
В следующей серии BF 3 , BCl 3 , B(CH 3 ) и BH 3 твердость снижается с BF 3 3 3 до BH 3 (рис. 4.2.17). BCl 3 мягче, чем BF 3 , из-за меньшей электроотрицательности Cl по сравнению с F. Более электроотрицательный F забирает больше электронной плотности у бора, делая его меньше и, следовательно, тверже. Из-за положительного индуктивного эффекта B(CH 3 ) 3 мягче, чем BCl 3 . Молекулы BF 3 и BCl 3 в целом считаются жесткими кислотами, B(CH 3 ) 3 является промежуточным случаем. На первый взгляд может показаться, что BH 3 тверже, чем B(CH 3 ) 3 , тем не менее он действует больше как мягкая кислота, возможно, из-за гидридоподобного характера соединения.
Далее рассмотрим ряд ионов переходных металлов Fe 2 + , FE 3+ , CO 2 + , CO 3+ , RH 3 + , IR 3+ (фиг. 4.2.18). Эти катионы обладают способностью образовывать π-связь, но из-за более высокого заряда 2+ и 3+ соответственно ни один из них не является мягким. Все катионы периода 4 с зарядом 3+, а именно Fe 3 + и Co 3 + , являются жесткими кислотами, Fe 2 + и Co 2 + Ионы 0053 находятся на границе между жесткими и мягкими из-за их меньшего заряда. Rh 3 + и Ir 3 + также находятся на границе. Они имеют более высокий положительный заряд, но находятся в периоде 5 и 6 соответственно. Ожидается, что Rh 3 + будет более твердым, чем Ir 3 + , потому что он находится в более низком периоде.
Ti 4 + и Si 4 + — обе жесткие кислоты (рис. 4.2.19). Как правило, все ионы с зарядом +4 и выше являются жесткими кислотами.
Рисунок 4.2.20 Пример ряда ионов переходных металлов 4-го периода Что можно сказать о последнем ряду Cu + , Cd 2+ , Hg 2 + , Pd 2+ 9005 и Pt2253 9005 + (рис. 4.2.20)? Подумай об этом. Все они считаются мягкими кислотами. Cu + представляет собой элемент с относительно низким периодом 4, но имеет заряд только 1+ и имеет d-орбитали для π-связи. ртутного столба 2 + , Pd 2+ и Pt 2 + имеют несколько более высокий заряд 2+, но являются элементами периода 5 и 6, а также имеют d-орбитали для π-связи. Pt 2 + можно было бы ожидать мягче, чем Pd 2 + , из-за его более длительного периода.
Количественные меры жесткости
Из предыдущих рассуждений мы видели, что можно делать качественные, а в некоторых случаях и полуколичественные оценки жесткости кислот и оснований, но они не являются количественной мерой жесткости. Шкала твердости, позволяющая количественно измерить твердость, — это концепция абсолютной твердости Пирсона (уравнение 4.2.1).
Уравнение 4.2.1 Уравнение для количественного расчета абсолютной жесткости
Оно связывает жесткость с разницей между энергией ионизации и сродством к электрону в течение 2. количественный расчет мягкости
Затем мягкость определяется как величина, обратная абсолютной твердости (уравнение 4.2.2).
Уравнение 4.2.3 Уравнение электроотрицательности Малликена
Сразу видно, что абсолютная жесткость связана со шкалой электроотрицательности Малликена, которая представляет собой энергию ионизации + сродство к электрону более 2 (4.2. 3).
3).
В чем идея этого определения? Ранее мы качественно обсуждали, что твердые виды, как правило, имеют большие различия в орбитальной энергии, в то время как мягкие виды, как правило, имеют небольшие различия в орбитальных энергиях. Следовательно, имеет смысл определить разницу энергий между самой высокой занятой атомной или молекулярной орбиталью и самой низкой незанятой атомной или молекулярной орбиталью как количественную меру твердости вида (уравнение 4.2.4).
Уравнение 4.2.4 Расширенное уравнение для расчета абсолютной жесткости сродство минус энергия самой низкой незанятой молекулярной или атомной орбитали: EA=-E(LUMO/LUAO). Следовательно, разница между ВЗМО/ГОАО и НСМО/ЛУАО такая же, как разница между энергией ионизации и сродством к электрону.
Рисунок 4.2.21 Абсолютная жесткость для катионов щелочных металлов /creativecommons.org/licenses/by-nc-sa/3.0/us/) Рисунок 4.2.21 иллюстрирует понятие абсолютной жесткости на примере катионов щелочных металлов.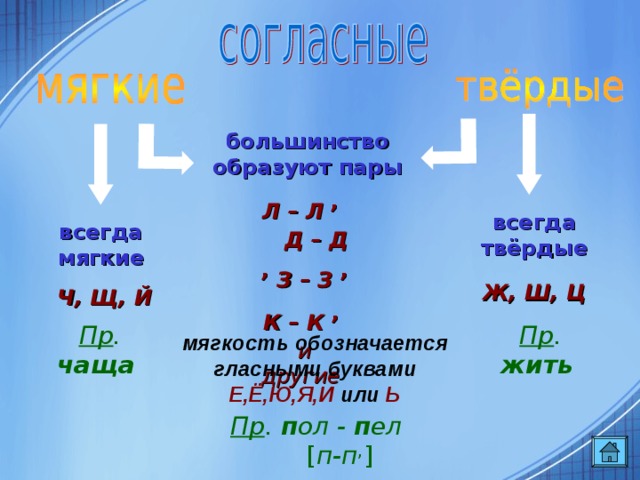 Вы можете видеть, что самые низкие незанятые атомные орбитали довольно близки по энергии, но энергия самой высокой занятой атомной орбитали значительно увеличивается от Li + в Cs +. Таким образом, энергетические различия уменьшаются от Li + к Cs + , а абсолютная твердость η составляет всего половину значения. Энергия по оси Y на полпути между энергиями ВЗМО и НСМО минус энергия, связанная с электроотрицательностью Малликена.
Вы можете видеть, что самые низкие незанятые атомные орбитали довольно близки по энергии, но энергия самой высокой занятой атомной орбитали значительно увеличивается от Li + в Cs +. Таким образом, энергетические различия уменьшаются от Li + к Cs + , а абсолютная твердость η составляет всего половину значения. Энергия по оси Y на полпути между энергиями ВЗМО и НСМО минус энергия, связанная с электроотрицательностью Малликена.
Мы также видим, что мы можем определить относительную твердость, которую невозможно определить с помощью качественного осмотра.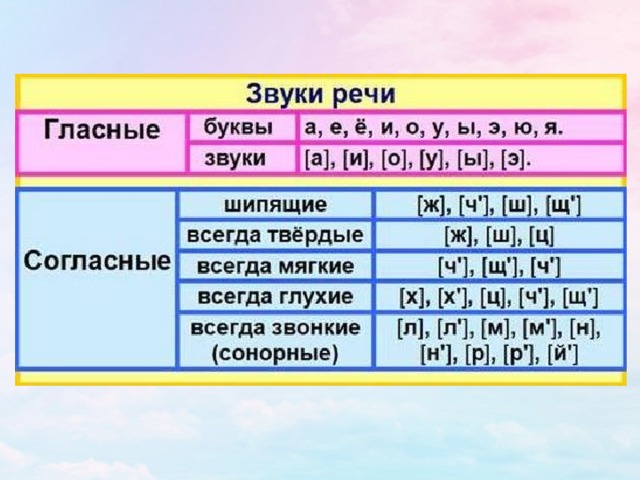 Например, мы можем видеть, что Al 3 + тверже, чем Li + . С точки зрения атомного размера нейтральный Al больше, чем нейтральный Li, и с этой точки зрения Li + должен быть тверже. С другой стороны, положительный заряд Al выше, чем у Li. С этой точки зрения Al должен быть жестче. При качественном осмотре мы не могли сказать, какой параметр преобладает в общей твердости. Концепция абсолютной жесткости показывает, что (в данном случае) заряд важнее, чем размер нейтрального атома. Точно так же мы не могли решить путем проверки, что Mg 2 + был мягче, чем Li + , потому что аргументы в пользу заряда предполагали, что Mg 2 + тверже, в то время как аргументы о размере нейтрального атома говорили, что Li + должен быть тверже. Мы видим, что в этом случае размер нейтрального атома оказывает большее влияние, хотя и незначительное. Согласно нашим ожиданиям, Mg 2 + тверже, чем Na + , так как оба иона соседствуют в один и тот же период и, таким образом, очень похожи по атомному радиусу, но Mg имеет более высокий положительный заряд.
Например, мы можем видеть, что Al 3 + тверже, чем Li + . С точки зрения атомного размера нейтральный Al больше, чем нейтральный Li, и с этой точки зрения Li + должен быть тверже. С другой стороны, положительный заряд Al выше, чем у Li. С этой точки зрения Al должен быть жестче. При качественном осмотре мы не могли сказать, какой параметр преобладает в общей твердости. Концепция абсолютной жесткости показывает, что (в данном случае) заряд важнее, чем размер нейтрального атома. Точно так же мы не могли решить путем проверки, что Mg 2 + был мягче, чем Li + , потому что аргументы в пользу заряда предполагали, что Mg 2 + тверже, в то время как аргументы о размере нейтрального атома говорили, что Li + должен быть тверже. Мы видим, что в этом случае размер нейтрального атома оказывает большее влияние, хотя и незначительное. Согласно нашим ожиданиям, Mg 2 + тверже, чем Na + , так как оба иона соседствуют в один и тот же период и, таким образом, очень похожи по атомному радиусу, но Mg имеет более высокий положительный заряд. Мы также можем видеть, что Ag + и Au + имеют гораздо более низкую твердость, чем K + , которую мы ожидаем. Мы также поняли бы, что Au + имеет более низкое значение, чем Ag + , потому что эти элементы находятся в одной группе, а Au + находится в периоде 6, а Ag + находится в периоде 5.
Мы также можем видеть, что Ag + и Au + имеют гораздо более низкую твердость, чем K + , которую мы ожидаем. Мы также поняли бы, что Au + имеет более низкое значение, чем Ag + , потому что эти элементы находятся в одной группе, а Au + находится в периоде 6, а Ag + находится в периоде 5.
Ниже Au + можно увидеть группу нейтральных молекул. Только молекула BF 3 является кислотой Льюиса, остальные молекулы являются основаниями Льюиса. Мы видим, что BF 3 имеет относительно высокую твердость, но мягче, чем K + . Из оснований H 2 O является самым твердым основанием, за ним следует NH 3 , за ним следует PF 3 , за которым следует PH 3 . Это то, что мы ожидали. О является наименьшим донорным атомом, за ним следует N, за которым следует P. PF 3 тверже, чем PH 3 , из-за более высокой электроотрицательности фтора по сравнению с водородом.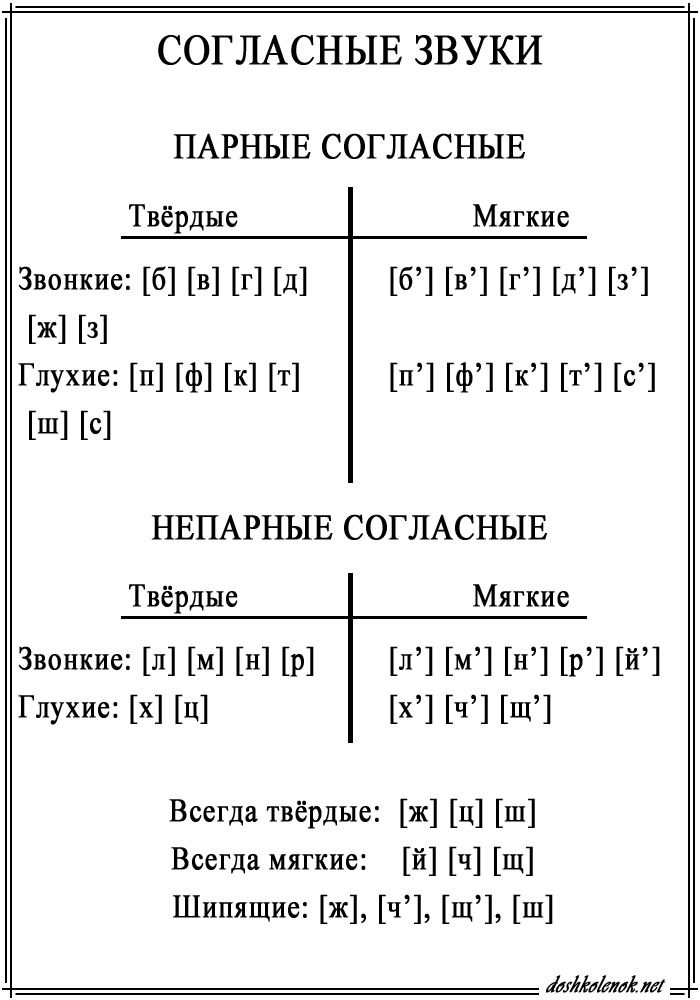
Последнюю группу составляют анионы галогенидов. По ожиданиям F — самые твердые, а I — самые мягкие. Мы видим, что Cl — имеет более низкое значение твердости, чем PH 3 . Химическое поведение последнего соответствует мягкому основанию, в то время как первое по-прежнему считается относительно твердым основанием. Мы видим, что к абсолютным значениям жесткости тоже нужно относиться с некоторой осторожностью, это не всемогущий метод, на поляризуемость могут влиять и другие факторы, кроме значений энергии ВЗМО и НСМО.
При сравнении трех групп мы видим, что катионы, как правило, имеют самые высокие значения жесткости, за которыми следуют нейтральные молекулы. Анионы, как правило, имеют самые низкие значения. Это означает, что жесткая кислота обычно имеет более высокое значение абсолютной жесткости, чем жесткое основание. Следовательно, чтобы интерпретировать значения значений, мы должны сравнивать только кислоты с кислотами и основания с основаниями.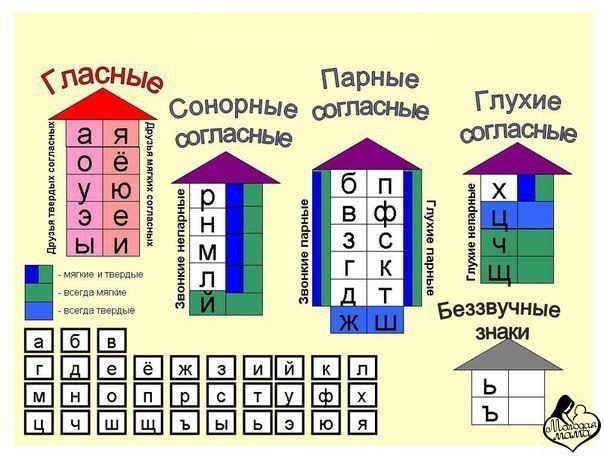
Концепция HSAB и растворимость
Поскольку концепция HSAB позволяет оценить силу взаимодействия между кислотами Льюиса и основаниями Льюиса, она также может оценить ряд других свойств, вытекающих из этой силы взаимодействия. Например, его можно использовать для оценки растворимости. Когда кислотно-основное взаимодействие Льюиса между катионом и анионом сильное, мы ожидаем низкую растворимость, когда взаимодействие слабое, мы ожидаем высокую растворимость.
Рисунок 4.2.23 Растворимость галогенидов серебраНапример, известно, что растворимость галогенидов серебра в воде увеличивается от AgI до AgBr, затем от AgCl до AgF (рис. 4.2.23). Это соответствует концепции HSAB. Ag + считается мягким, и, таким образом, он будет наиболее сильно взаимодействовать с самым мягким анионом, йодидом I — . Ag + будет слабее всего взаимодействовать с F — , потому что он самый тяжелый.
Рисунок 4.2.24 Растворимость галогенидов лития Каковы наши ожидания относительно галогенидов лития (рис. 4.2.24)? В этом случае можно было бы ожидать снижения растворимости от LiI к LiBr, к LiCl и к LiF. Почему? Это потому, что Ли + является жестким катионом, поэтому наиболее сильные взаимодействия должны происходить с F — . Следовательно, LiF будет иметь самую низкую растворимость. I — является самым мягким анионом, поэтому он должен вступать в самые слабые взаимодействия с Li + . Следовательно, LiI будет иметь самую высокую растворимость. Это то, что мы наблюдаем экспериментально? Экспериментально наибольшая растворимость наблюдается у LiBr, за которым следует LiCl, а затем LiI. LiF имеет самую низкую растворимость. Мы видим, что растворимость LiI не такая, как мы ожидали. Вместо того, чтобы иметь самую высокую растворимость, он имеет вторую самую низкую растворимость. Здесь мы видим ограничения концепции HSAB. Есть и другие факторы, определяющие растворимость, в частности энтальпия сольватации. я — имеет очень низкую энтальпию гидратации, что объясняет более низкую, чем ожидалось, растворимость LiI.
4.2.24)? В этом случае можно было бы ожидать снижения растворимости от LiI к LiBr, к LiCl и к LiF. Почему? Это потому, что Ли + является жестким катионом, поэтому наиболее сильные взаимодействия должны происходить с F — . Следовательно, LiF будет иметь самую низкую растворимость. I — является самым мягким анионом, поэтому он должен вступать в самые слабые взаимодействия с Li + . Следовательно, LiI будет иметь самую высокую растворимость. Это то, что мы наблюдаем экспериментально? Экспериментально наибольшая растворимость наблюдается у LiBr, за которым следует LiCl, а затем LiI. LiF имеет самую низкую растворимость. Мы видим, что растворимость LiI не такая, как мы ожидали. Вместо того, чтобы иметь самую высокую растворимость, он имеет вторую самую низкую растворимость. Здесь мы видим ограничения концепции HSAB. Есть и другие факторы, определяющие растворимость, в частности энтальпия сольватации. я — имеет очень низкую энтальпию гидратации, что объясняет более низкую, чем ожидалось, растворимость LiI. В некотором смысле концепция HSAB способна объяснить низкую энтальпию гидратации I — , поскольку она основана на силе взаимодействия между I — и водой. Вода является жесткой кислотой и поэтому слабо взаимодействует с мягким основанием, таким как I —. Это может служить объяснением низкой энтальпии гидратации.
В некотором смысле концепция HSAB способна объяснить низкую энтальпию гидратации I — , поскольку она основана на силе взаимодействия между I — и водой. Вода является жесткой кислотой и поэтому слабо взаимодействует с мягким основанием, таким как I —. Это может служить объяснением низкой энтальпии гидратации.
Другим хорошим примером, иллюстрирующим влияние энтальпии сольватации на растворимость, является растворимость галогенидов серебра в жидком аммиаке (не в водном аммиаке). На самом деле все наоборот, AgF имеет наименьшую растворимость, а AgI имеет самую высокую растворимость. Взаимодействие HSAB между Ag + и ионы галогенидов одинаковы независимо от растворителя. Поэтому они не могут служить объяснением. Скорее, мы можем утверждать, что обратные энтальпии сольватации в жидком аммиаке по сравнению с жидкой водой ответственны за обратное поведение. С точки зрения HSAB молекулы аммиака уже значительно мягче молекул воды, поэтому взаимодействия с мягкими анионами становятся значительно сильнее.
Концепция и стабильность HSAB
Концепция HSAB также может быть использована для оценки термодинамической стабильности соединений, например температуры разложения, точки плавления и т. д. Как правило, чем больше кислотно-щелочное взаимодействие, тем выше ожидаемая термодинамическая стабильность. Давайте сделаем пару упражнений, чтобы попрактиковаться в этой концепции.
Рисунок 4.2.25 Термодинамическая стабильность оксидов щелочных металлов Какой порядок термодинамической стабильности вы ожидаете для оксидов щелочных металлов (рис. 4.2.25)? Ответ: стабильность снижается с увеличением периода щелочного металла. Почему? Оксид-анион считается твердым основанием из-за его относительно небольшого радиуса. Таким образом, самые сильные взаимодействия ожидаются с Li + , который является самым твердым щелочным металлом, и самые слабые взаимодействия можно ожидать для Cs + , который является самым мягким щелочным металлом. Это соответствует экспериментальным наблюдениям. Только Li дает Li 2 O при сжигании в O 2 , Na дает пероксид натрия, а остальные щелочные металлы дают супероксиды.
Только Li дает Li 2 O при сжигании в O 2 , Na дает пероксид натрия, а остальные щелочные металлы дают супероксиды.
Мы можем задать тот же вопрос для оксидов щелочноземельных металлов (рис. 4.2.26). Точно так же стабильность BeO является самой высокой, потому что Be имеет самую высокую твердость. BaO имеет самую низкую стабильность, потому что Ba 2 + – самый мягкий щелочноземельный катион. Ba дает пероксид бария вместо оксида бария при сжигании в O 2 .
Концепция HSAB и кислотность
Концепция HSAB также может объяснить кислотность по Бренстеду. Как?
. 2 Se (рис. 4.2.27). Кислотность по Бренстеду увеличивается от H 2 от O до H 2 от S до H 2 Se. Почему? H + является жесткой кислотой, и поэтому самые сильные взаимодействия следует ожидать с самым твердым основанием, ионом оксида, а самые слабые взаимодействия следует ожидать с самым мягким основанием, анионом Se Следовательно, H 2 Se легче всего теряет протон, что делает ее самой сильной кислотой. Для H 2 O кислотность наименьшая, потому что взаимодействия между H + и O 2- самые большие. Рис. 4.2.28 Кислотность ряда HClO 4 в HClO 3 в HClO 2 в HClO
Следовательно, H 2 Se легче всего теряет протон, что делает ее самой сильной кислотой. Для H 2 O кислотность наименьшая, потому что взаимодействия между H + и O 2- самые большие. Рис. 4.2.28 Кислотность ряда HClO 4 в HClO 3 в HClO 2 в HClO Перейдем к несколько более сложному примеру (рис. 4.2.28). Кислотность хлорной кислоты, хлорноватистой кислоты, хлорноватистой кислоты и хлорноватистой кислоты снижается от HClO 4 до HClO 3 до HClO 2 до HClO. В этом случае все протоны связаны с кислородом, поэтому мы не можем рассуждать, как раньше. Однако можно утверждать, что отрицательный заряд анионов кислот наиболее делокализован в случае хлорной кислоты, потому что для хлорной кислоты можно изобразить наибольшее количество резонансных структур. Поскольку отрицательный заряд наиболее делокализован, электрон наиболее поляризуем и, следовательно, наиболее мягок.
Наконец, давайте подумаем об относительной основности NH 3 , PH 3 1 и AsH 3 1 и (рис. 4.2.29)? Атом N — самое твердое основание, и взаимодействия с протонами самые сильные. Следовательно, NH 3 является самым сильным основанием. AsH 3 — самое слабое основание, потому что As — самый мягкий атом, наиболее слабо взаимодействующий с протонами.
Доктор Кай Ландскрон (Университет Лихай). Если вам нравится этот учебник, рассмотрите возможность сделать пожертвование для поддержки исследований автора в Университете Лихай: нажмите здесь, чтобы сделать пожертвование.
Эта страница под названием 4. 2: Hard and Soft Acids and Bases распространяется под лицензией CC BY 4.0, ее автором, ремиксом и/или куратором является Кай Ландскрон.
2: Hard and Soft Acids and Bases распространяется под лицензией CC BY 4.0, ее автором, ремиксом и/или куратором является Кай Ландскрон.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Кай Ландскрон
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Метки
- абсолютная твердость
- концепция жестких и мягких кислот и оснований
- твердость
- HSAB
- мягкость
6.
 6.2: предпочтения Hard-Hard и Soft-Soft могут быть объяснены и количественно определены с точки зрения электростатической, ковалентной и электронной стабилизации стабильности кислотно-основных аддуктов Льюиса
6.2: предпочтения Hard-Hard и Soft-Soft могут быть объяснены и количественно определены с точки зрения электростатической, ковалентной и электронной стабилизации стабильности кислотно-основных аддуктов Льюиса- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 162917
Принцип твердого и мягкого кислотного основания является концептуальным инструментом для размышлений о моделях кислотно-основной реакционной способности по Льюису
Объяснение тенденций в распределении металлов, растворимости галоидных солей и предпочтительных моделей координации металлов основано на работах Арланда, Чатта и Дэвиса. ‘замечание, что Кислоты и основания Льюиса можно разделить на две группы в зависимости от их склонности к образованию стабильных соединений друг с другом ( например, кислот в одном классе склонны образовывать более стабильные аддукты с основаниями того же класса, чем с основаниями другого Другой). 1 Арланд, Чатт и Дэвис довольно скучно назвали эти группы классом a и классом b, но сегодня они известны под именем Ральфа Пирсона. Пирсон назвал кислоты и основания класса А жесткими, а кислоты и основания класса В — мягкими. Эти термины отражают, насколько «мягки» электронные облака этого вещества к искажению или, другими словами, их поляризуемость (Рисунок \(\PageIndex{1}\)). Пирсон называет кислоты и основания относительно поляризуемыми мягкие и те, которые трудно поляризовать жесткие.
1 Арланд, Чатт и Дэвис довольно скучно назвали эти группы классом a и классом b, но сегодня они известны под именем Ральфа Пирсона. Пирсон назвал кислоты и основания класса А жесткими, а кислоты и основания класса В — мягкими. Эти термины отражают, насколько «мягки» электронные облака этого вещества к искажению или, другими словами, их поляризуемость (Рисунок \(\PageIndex{1}\)). Пирсон называет кислоты и основания относительно поляризуемыми мягкие и те, которые трудно поляризовать жесткие.
Жесткие кислоты и основания бывают двух разновидностей:
- сайты жестких кислот и оснований, которые содержат мало валентных электронов и для которых поляризация, следовательно, включает искажение электронов ядра, которые трудно исказить, потому что они близки к ядру и испытывают высокий ядерный заряд.
 Наиболее распространенными примерами таких веществ являются жесткие кислоты Льюиса, расположенные слева в периодической таблице.
Наиболее распространенными примерами таких веществ являются жесткие кислоты Льюиса, расположенные слева в периодической таблице. - участки жесткой кислоты и основания с высокой плотностью заряда (сильно заряженные относительно размера) и/или с дефицитом электронов. В этих случаях поляризация вызывает искажение электронов, которые уже испытывают сильные неэкранированные электростатические взаимодействия.
Мягкие кислоты и основания также бывают двух разновидностей
- мягкие кислоты и основания, которые имеют много валентных электронов и поэтому легче поляризуются. Следовательно, при прочих равных условиях мягкие кислоты и основания с большей вероятностью будут находиться ближе к середине или справа в периодической таблице.
- мягкие кислоты и основания с небольшой плотностью заряда и/или относительно богатые электронами.
Обратите внимание, что классификацию твердо-мягкой не следует рассматривать так, будто все жесткие кислоты и основания одинаково жесткие, а все мягкие кислоты и основания одинаково мягкие.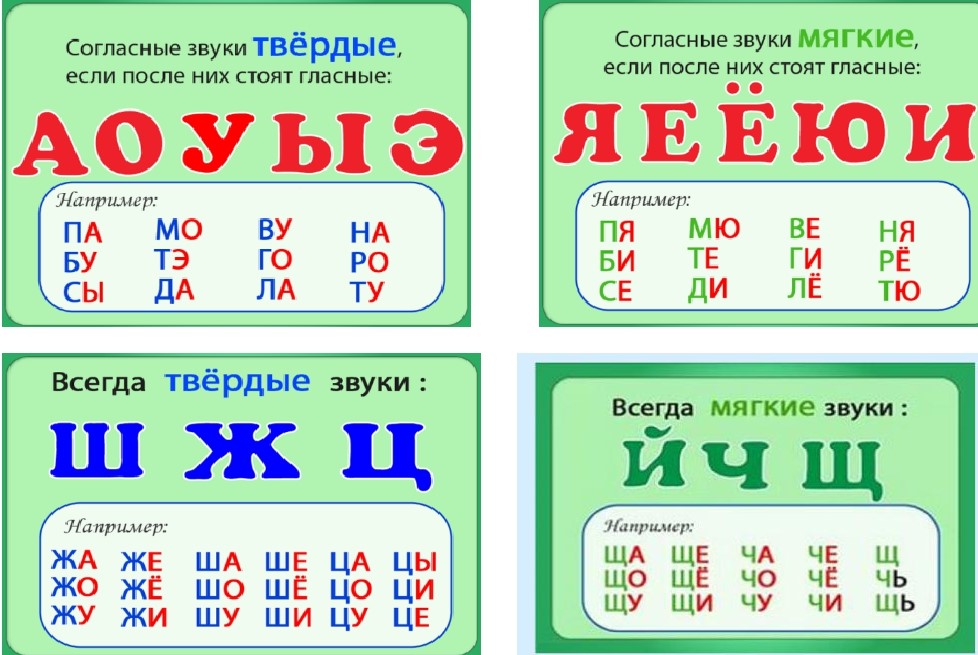 Существует градация жесткости и мягкости, а также ряд промежуточных кислот и оснований, которые не подходят ни к одной из категорий. С учетом этого предостережения представитель жестких, мягких и пограничных кислот приведены ниже. Обратите внимание, как они иллюстрируют только что обрисованные тенденции.
Существует градация жесткости и мягкости, а также ряд промежуточных кислот и оснований, которые не подходят ни к одной из категорий. С учетом этого предостережения представитель жестких, мягких и пограничных кислот приведены ниже. Обратите внимание, как они иллюстрируют только что обрисованные тенденции.
Как и ожидалось, жесткие кислоты, как правило, находятся в левой части периодической таблицы и включают более высокие степени окисления и/или заместители, являющиеся донорами электронов, в то время как мягкие кислоты чаще встречаются в правой части периодической таблицы и имеют более низкие степени окисления. и/или электронодонорные заместители.
Иллюстративные твердые, мягкие и пограничные основания приведены ниже. Опять же, обратите внимание, как эти вещества иллюстрируют общие тенденции.
Качественная оценка относительной жесткости и мягкости кислот и оснований Льюиса
Как видно из приведенных выше примеров, жесткие кислоты относительно бедны электронами, а жесткие основания электронно-богаты, поскольку они имеют сравнительно
- маленькие граничные орбитали, отражающие их относительно небольшие размеры атомов/ионов/фрагментов
- высокая (для кислот) или низкая (для оснований) степень окисления атома основания, что выражается в большом положительном формальном заряде (для кислот) или отрицательном формальном заряде (для оснований)
- низкая поляризуемость из-за потери или приобретения значительного числа электронов или локализации
- положительный заряд электроположительного элемента или атома, содержащего электроноакцепторные заместители
- отрицательный заряд электроотрицательного элемента или атома, несущего электронодонорные заместители
В отличие от жестких кислот и оснований, мягкие кислоты относительно богаты электронами, а мягкие основания крупнее и беднее электронами , так как они имеют относительно
- большие пограничные орбитали, отражающие их относительно большие размеры атомов/ионов/фрагментов
- низкие степени окисления, часто приводящие к малым или отсутствующим атомным зарядам
- обладает высокой поляризуемостью, чего можно ожидать от видов, у которых электрон-электронное отталкивание меньше и электроны распределены по большому объему.
 Иногда на это указывают
Иногда на это указывают- положительный заряд электроотрицательного элемента или атома, несущего электронодонорные заместители
- отрицательный заряд на электроположительном элементе или атоме, имеющем электроноакцепторные заместители
Упражнение \(\PageIndex{1}\)
Расположите кислоты или основания в каждом наборе в порядке возрастания ожидаемой жесткости.
- Cr 2 + и Cr 3 +
- H + , Cs + и Tl +
- SCN — (действующий как база в N) и SCN — (базовый номер S)
- AlF 3 , AlH 3 , AlMe 3
- Боковые цепи следующих протеиногенных аминокислот
- Ответить
(a) Cr 2 + < Cr 3 + При прочих равных условиях твердость увеличивается с увеличением степени окисления.
(б) Tl + < Cs + < H + Порядок отражает больший размер Cs + и Tl + по сравнению с H + (который в любом случае не имеет электронов, которые могут быть поляризованы), и что Tl + все еще обладает двумя валентными электронами. в то время как Cs + не имеет его.
(c) SCN — (действующий как основание в S) < SCN — (действующий как основание в N). Порядок отражает большую электроотрицательность N, чем S, и наличие у N более отрицательного формального заряда -1.
(d) AlH 3 < AlMe 3 < AlF 3 . Жесткость увеличивается по мере того, как заместители в льюисовском кислотном центре Al становятся менее электронодонорными и более электроноакцепторными (и, кстати, более твердые основания) по мере увеличения их электроотрицательности в порядке H — < CH 3 — < F — .
 Обратите внимание, что порядок электронодонорной способности для H — и CH 3 — , напротив, наблюдается для карбокатионов, для которых большую роль играет гиперконъюгация.
Обратите внимание, что порядок электронодонорной способности для H — и CH 3 — , напротив, наблюдается для карбокатионов, для которых большую роль играет гиперконъюгация.(e) Sec < Cys < Ser. Твердость увеличивается по мере увеличения электроотрицательности халькогена основания Льюиса при переходе от селенола к тиолу и к спирту.
Кислотно-основной принцип Hard-Soft (принцип HSAB)
Принцип Hard-Soft кислотно-основный (принцип HSAB) объясняет модели кислотно-щелочной реакции Льюиса с точки зрения подобное реагирует подобным предпочтением . Как термодинамически, так и кинетически жесткие кислоты предпочитают жесткие основания, а мягкие кислоты — мягкие основания. В частности,
- Термодинамически жесткие кислоты образуют более прочные кислотно-основные комплексы с жесткими основаниями, тогда как мягкие кислоты образуют более прочные комплексы с мягкими основаниями.
- Кинетически жесткие кислоты/электрофилы быстрее реагируют с жесткими основаниями/нуклеофилами, тогда как мягкие кислоты/электрофилы быстрее реагируют с мягкими основаниями/нейклеофилами.
Применение принципа HSAB включает
1. Прогнозирование равновесия или скорости Льюиса кислотно-основного метатезиса и реакций замещения. В кислотно-основной реакции Льюиса реакции метатезиса кислоты и основания меняются партнерами \[\ce{A1:B1 + A2:B2 <=>[k_1, K_{eq}] A1:B2 + A2:B1} \nonumber \]
Например, положение равновесия реакции метатезиса между \(\ce{TlF}\) и \(\ce{K2S}\) благоприятствует продуктам:
\[\ce{2TlF + h3S <=>> Tl2S + 2KF} \nonumber \]
в соответствии с предпочтениями HSAB: жесткий-жесткий и мягкий-мягкий.
\[ \nonumber \]
Принцип HSAB также позволяет прогнозировать положение реакций замещения, в которых кислота или основание Льюиса образует аддукт с использованием основания или кислоты из существующего кислотно-основного комплекса Льюиса. В этих реакциях вытеснение кислоты или основания из реагентного комплекса можно рассматривать как своего рода реакцию метатезиса, в которой несвязанная кислота или основание меняются местами с одним в комплексе. Например, реакция между \(\ce{HI}\) и катионом метилртути 9{+}}\) — жесткая кислота.
В этих реакциях вытеснение кислоты или основания из реагентного комплекса можно рассматривать как своего рода реакцию метатезиса, в которой несвязанная кислота или основание меняются местами с одним в комплексе. Например, реакция между \(\ce{HI}\) и катионом метилртути 9{+}}\) — жесткая кислота.
\[ \nonumber \]
Упражнение \(\PageIndex{2}\)
Предскажите положение равновесия для следующей реакции.
\[\ce{Fe2O3 + 3Ag2S <=> Fe2S3 + 3Ag2O} \номер \]
- Ответ
Равновесие будет благоприятствовать реагентам (K<1), так как жестко-жесткие и мягко-мягкие взаимодействия в реагентах более стабильны, чем жестко-мягкие взаимодействия в продуктах.
9{+}}\)- \(\ce{H_3B-NH_3 + F_3B-SH_2 ⇌ H_3B-SH_2 + F_3B-NH_3}\)
- Ответить
а. K < < 1, так как аддукты реагентов являются жестко-жесткими и мягко-мягкими, а продукты включают взаимодействие жестко-мягких.
б. K>>1, так как реагентный комплекс диамин серебра(I) представляет собой комплекс жесткого основания NH 3 с мягкой кислотой Ag + , а продукт представляет собой комплекс той же мягкой кислоты с мягкое основание фосфин.
с. K~1, так как все аддукты среди реагентов и продуктов включают мягкие кислоты и основания.
д. K>>1, так как BH 3 является более мягкой кислотой, чем BF 3 , поэтому он образует более прочный комплекс с более мягким основанием H 2 S, в то время как более твердый BF 3 образует более прочный комплекс с более твердым основанием. NH 3 .
2. Прогнозирование относительной силы данного набора кислот или оснований Льюиса по отношению к конкретному субстрату . Рассмотрим, например, относительную прочность BH 3 , BMe 3 и BF 3 по отношению к гидридам группы 15, таким как NH 3 , PH 3 и AsH 3 .
 Из перечисленных боранов самая жесткая кислота BF 3 является самой сильной кислотой по отношению к жесткому основанию NH 3 , а BH 3 является самой сильной по отношению к AsH 3 . †
Из перечисленных боранов самая жесткая кислота BF 3 является самой сильной кислотой по отношению к жесткому основанию NH 3 , а BH 3 является самой сильной по отношению к AsH 3 . † Упражнение \(\PageIndex{4}\)
Какая кислота образует наиболее устойчивый комплекс с \(\ce{CO}\): \(\ce{Bh4}\), \( \ce{BF3}\) или \(\ce{BMe3}\)?
- Ответить
\(\ce{Bh4}\). Поскольку \(\ce{CO}\) образует комплексы в основном через свою углеродную неподеленную пару, это мягкое основание, и поэтому он образует самый прочный комплекс с самой мягкой кислотой Льюиса.
Упражнение \(\PageIndex{5}\)
Когда лактоны реагируют с нуклеофилами, они могут вступать в реакции раскрытия цикла с образованием либо спирта, либо карбоновой кислоты, как показано ниже для пропиолактона:
В приведенной выше реакции стерически беспрепятственные алкоксиды дают один продукт, а стерически беспрепятственные тиоалкоксиды — другой.
 Объясните, почему это так, и предскажите продукты реакции между пропиолактоном и натриевыми солями этоксида и тиоэтоксида.
Объясните, почему это так, и предскажите продукты реакции между пропиолактоном и натриевыми солями этоксида и тиоэтоксида.- Ответить
Два продукта реакции соответствуют нуклеофильной атаке двух электрофильных углеродных центров лактонов. В частности, кислота образуется путем атаки на более мягкий центр C I CH 2 , непосредственно связанного с кислородом сложного эфира, и спирта путем нуклеофильной атаки на более жесткий центр C III сложноэфирного карбонила.
Следовательно, разумно ожидать, что более твердый этоксид основания будет нуклеофильно атаковать более твердый карбонильный углерод, в то время как более мягкий тиоэтоксид будет атаковать более мягкий метиленовый углерод.
Теоретическая интерпретация принципа «жесткий-мягкий кислотно-основный» заключается в том, что предпочтения «жесткий-жесткий» отражают превосходную электростатическую стабилизацию, а предпочтения «мягкий-мягкий» отражают превосходную ковалентную стабилизацию.

Предпочтения жесткого-жесткого и мягкого-мягкого в кислотно-основных взаимодействиях Льюиса отражают то, что
- Неподеленная пара жесткого основания сильно стабилизируется электростатически жесткой кислотой.
- Неподеленная пара мягкого основания прочно стабилизируется за счет образования ковалентной связи с мягкой кислотой.
- Неподвижная пара твердого или мягкого основания сравнительно слабо стабилизируется кислотой, противоположной ей по жесткости или мягкости, так как общая электростатическая и ковалентная стабилизация аддукта сравнительно слаба.
Чтобы понять, почему это так, полезно разделить вклады в энергию взаимодействия кислоты и основания следующим образом:
\[ \nonumber \]
Из трех вкладов в энергию взаимодействия только ионные и ковалентные термины напрямую относятся к жесткости взаимодействующих кислоты и основания. Один из подходов к размышлению о том, как жесткость влияет на ионный и ковалентный вклад, состоит в том, чтобы рассмотреть граничные орбитали, участвующие в кислотно-щелочном взаимодействии.
 Иногда это делается с помощью уравнения Салема-Клопмана 9.0052 1, * хотя в последующей обработке будет использован более качественный подход.
Иногда это делается с помощью уравнения Салема-Клопмана 9.0052 1, * хотя в последующей обработке будет использован более качественный подход.И жесткие кислоты, и основания будут иметь сравнительно низкие уровни энергии ВЗМО и высокие уровни энергии НСМО, с соответственно большим разрывом ВЗМО-НСМО. Напротив, мягкие кислоты и основания будут иметь сравнительно высокоэнергетические уровни HOMO и низкоэнергетические уровни LUMO, что дает сравнительно меньший разрыв HOMO-LUMO.
Учитывая это, рассмотрим граничные орбитальные взаимодействия, участвующие в формировании кислотно-щелочного комплекса для возможных случаев, как показано схематически ниже.
Большой разрыв в энергии между высокостабилизированными неподеленными парами ВЗМО твердых оснований и высокоэнергетическими НСМО жестких кислот гарантирует, что в аддуктах жесткой кислоты и жесткого основания доминирующее стабилизирующее взаимодействие будет включать электростатическое притяжение между неподеленной парой оснований и электроположительный кислотный центр Льюиса .
 К счастью, поскольку электронные облака в твердых основаниях относительно плотные и богатые электронами, а жесткие кислоты Льюиса сильно заряжены и малы, эти электростатические взаимодействия сильны.
К счастью, поскольку электронные облака в твердых основаниях относительно плотные и богатые электронами, а жесткие кислоты Льюиса сильно заряжены и малы, эти электростатические взаимодействия сильны.Напротив, в аддуктах мягких кислот и оснований преобладающее стабилизирующее взаимодействие будет ковалентным. Это , потому что небольшой энергетический разрыв между ВЗМО мягкого основания и НВМО мягкой кислоты позволяет сформировать хорошо стабилизированную связывающую орбиталь со значительной электронной плотностью между кислотой и основанием.
Взаимодействия орбиталей между жесткими кислотами и мягкими основаниями и мягкими кислотами и жесткими основаниями являются промежуточными между случаями жесткой кислоты и жесткого основания и мягкой кислоты и мягкого основания.
Это означает, что аддукты стабильны по отношению к свободной кислоте и основанию, но не так хорошо стабилизированы, как в случае жесткой кислоты и жесткого основания. В случае жестких кислот и мягких оснований жесткие кислоты менее способны электростатически стабилизировать относительно диффузную электронную пару мягких оснований, и ковалентная стабилизация не так велика, как в аддуктах мягких кислот и оснований из-за высокой энергии жесткой кислоты.
 .
.Ссылки
1. Арланд, С.; Чатт, Дж.; Дэвис, Н. Р., Относительное сродство атомов лиганда к акцепторным молекулам и ионам. Ежеквартальные обзоры, Химическое общество 1958, 12 (3), 265-276.
2. Пирсон Р. Г. Жесткие и мягкие кислоты и основания. Журнал Американского химического общества, 1963, 85 (22), 3533-3539.
3. Флеминг И. Молекулярные орбитали и органические химические реакции. Справочное изд.; Wiley: Hoboken, N.J., 2010.
Notes
* Несмотря на плодотворность этого наблюдения, в целом важно уменьшить вероятность систематической ошибки наблюдателя путем сверки таких наблюдений с соединениями, описанными в химической литературе и базах данных, таких как Inorganic Кристаллическая структура и Кембриджские кристаллографические базы данных.
** Они очень хорошо растворяются в воде, до такой степени, что некоторые растворы, возможно, лучше описать как растворы воды в галогениде.
† Это можно предсказать на основе относительной жесткости BF 3 , BR 3 и BH 3 в списке жестких и мягких кислот.
 Однако для тех из вас, кто может быть смущен тем, почему H считается лучшим донором электронов для целей смягчения кислотного центра Льюиса, в то время как алкильные группы являются лучшими донорами электронов для целей стабилизации карбокатионов в органической химии, доминирующий эффект меньшая электроотрицательность H по отношению к углероду (в CH 3 ). Эффект донорства электронов из-за гиперконъюгации не так велик для термодинамически стабильных оснований, таких как BX 3 /BR 3 .
Однако для тех из вас, кто может быть смущен тем, почему H считается лучшим донором электронов для целей смягчения кислотного центра Льюиса, в то время как алкильные группы являются лучшими донорами электронов для целей стабилизации карбокатионов в органической химии, доминирующий эффект меньшая электроотрицательность H по отношению к углероду (в CH 3 ). Эффект донорства электронов из-за гиперконъюгации не так велик для термодинамически стабильных оснований, таких как BX 3 /BR 3 .†† Подробнее об уравнении Салема-Клопмана см. Флеминг И., Молекулярные орбитали и органические химические реакции. Справочное изд.; Wiley: Хобокен, Нью-Джерси, 2010 г.; стр. 138-143.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.


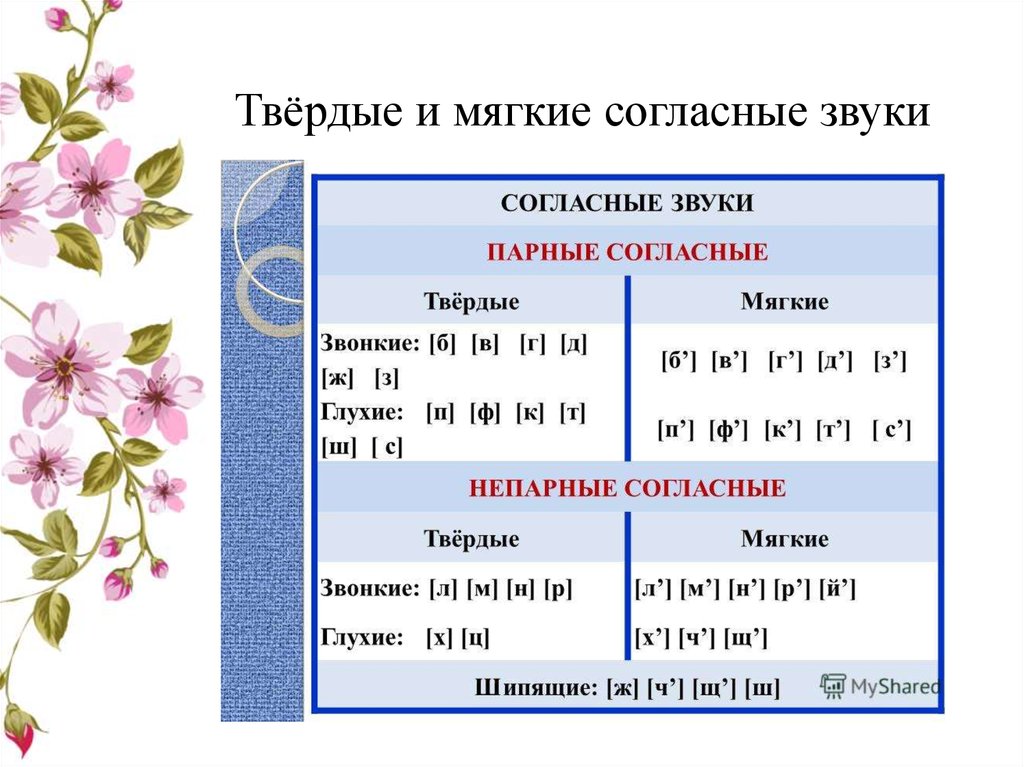
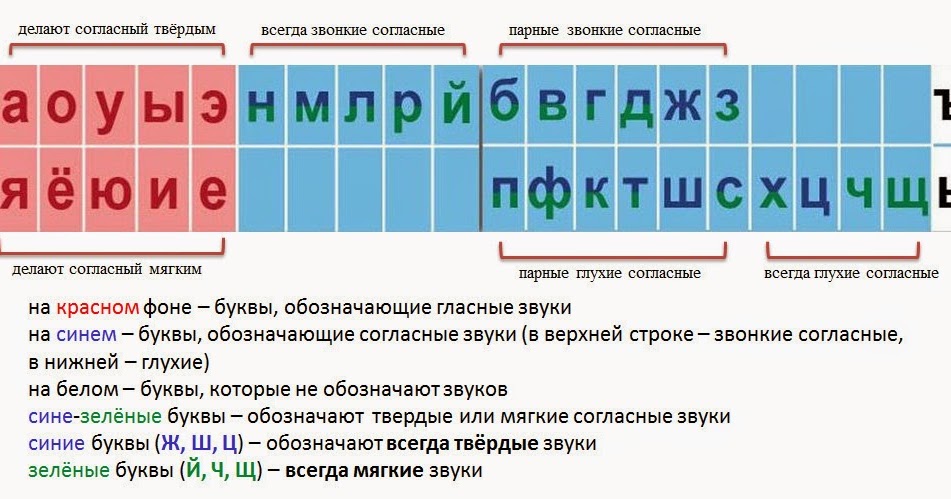
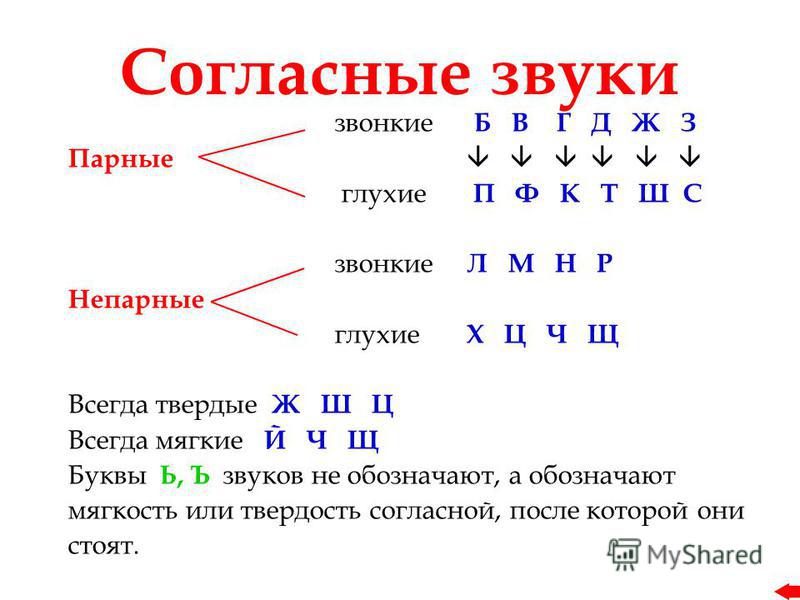
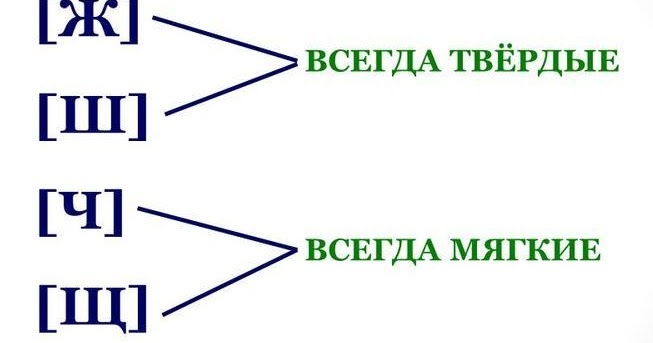
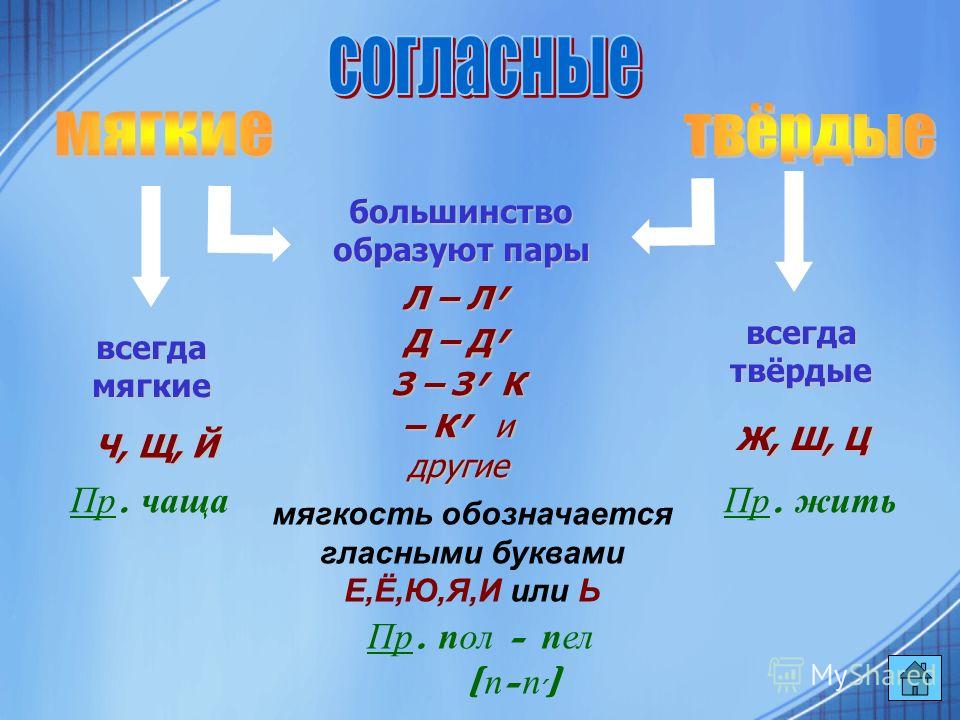
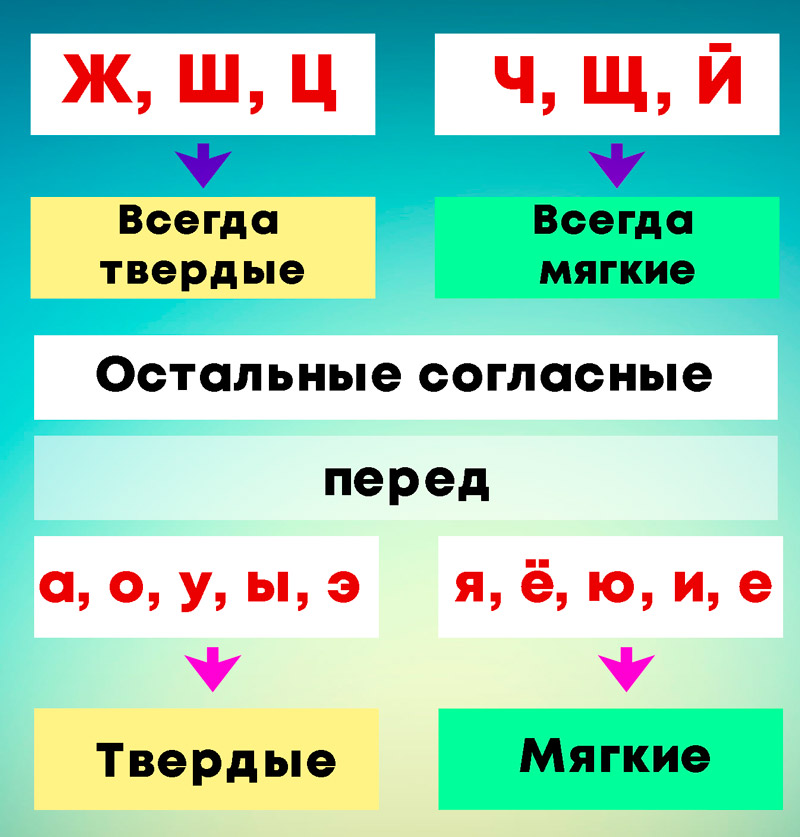
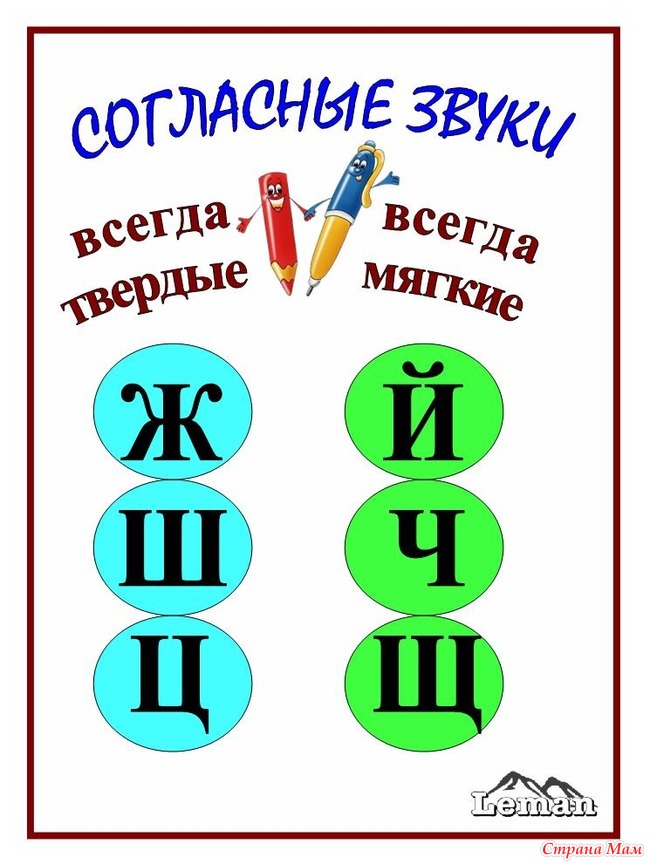
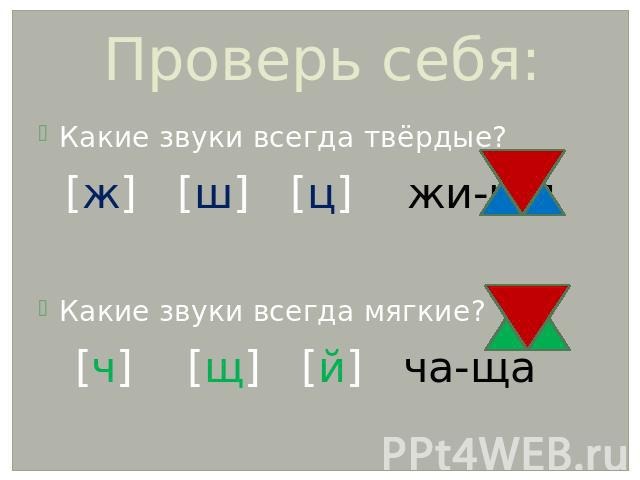 ОРФОЭПИЯ. ГРАФИКА. ОРФОГРАФИЯ
ОРФОЭПИЯ. ГРАФИКА. ОРФОГРАФИЯ