Типичные реакции на прививку
Работаем без выходных и праздников
COVID 19: тесты на антитела
В состав прививочного материала входят микроорганизмы, их компоненты или вырабатываемые токсины. Задача вакцинации – подвергнуть организм небольшой дозе заболевания для выработки иммунитета, чтобы при попадании в организм вируса не возникло заболевания или оно перенеслось в легкой форме.
Существует большое разнообразие действующих вакцин. Некоторые препараты могут вызывать побочные реакции. Среди местных реакций можно выделить повышенную чувствительность в месте укола, легкие покраснения и даже небольшие уплотнения. Общие реакции – это чувство слабости, повышение температуры, тошнота, головные боли.
Причинами возникновения осложнений после вакцинации являются:
- особенности определенного организма;
- ослабленный иммунитет, прививка во время болезни или в стадии выздоровления;
- нарушение правил транспортировки, хранения вакцины или несоблюдение техники введения препарата.

Спровоцировать развитие осложнений может аллергическая реакция на один из препаратов вакцины. Нужно понимать, что нельзя ставить прививки при обострении хронических заболеваний. Если иммунитет ослаблен, он не сможет защитить организм от действия введенного препарата.
Чтобы свести к минимуму риск развития осложнений после вакцинации, непосредственно перед посещением прививочного кабинета нужно проконсультироваться с педиатром или терапевтом. Специалист проведет осмотр, оценит самочувствие пациента и только после этого примет решение о возможности сделать прививку. Если будут выявлены противопоказания, доктор сделает медотвод. В этом случае вакцина будет введена позже.
Побочные реакции говорят о том, что организм реагирует на появление чужеродного антигена. Начинается нормальный процесс формирования иммунитета. Однако, будет не лишним знать о реакциях на отдельные виды прививок. Это позволит подготовиться к вакцинации и не паниковать после нее.
После прививки от дифтерии иногда наблюдается покраснение и небольшое уплотнение. Ненадолго может подняться температура. При появлении фебрильных судорог можно дать жаропонижающее, например, парацетамол.
Ненадолго может подняться температура. При появлении фебрильных судорог можно дать жаропонижающее, например, парацетамол.
Прививка против ХИБ-инфекции может сопровождаться повышением температуры и небольшим уплотнением. Чаще всего реакции нет.
Вакцинация от гепатита сопровождается головной болью, усталостью, недомоганием. В месте укола в течение пары дней будет небольшое уплотнение.
На прививку от кори реагирует каждый шестой ребенок. В течение нескольких дней после укола может подняться температура, а также появиться бледно-розовая сыпь.
Одной из наиболее сложных прививок является АКДС – вакцинация против столбняка, коклюша и дифтерии. В 15-20% случаев после вакцинации наблюдается повышение температуры тела, потеря аппетита, общее недомогание, раздражительность и сонливость.
Реакции на прививки – это индивидуальная особенность организма. Как правило, последствия от введения вакцины исчезают в течение двух-трех дней. Важно понимать, что небольшие изменения в самочувствии и поведении это нормально, а прививки защищают организм от серьезных заболеваний в будущем.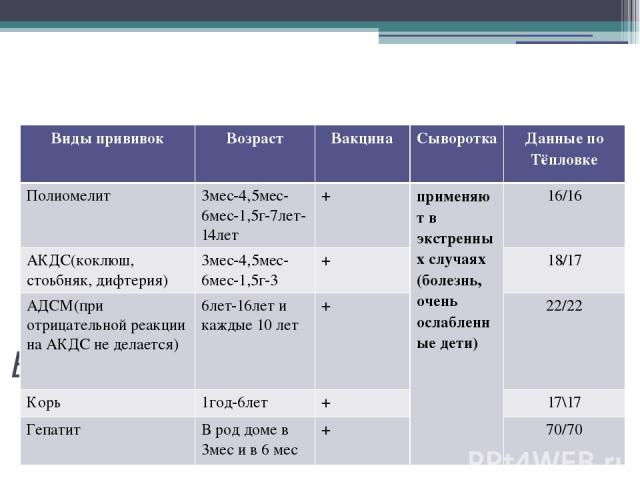
Прививка АКДС — запись на прием, цены на услуги, отзывы Частная детская клиника «Детский Доктор» в Екатеринбурге
Вакцина АКДС, выпускающаяся в двух разновидностях – АДС и АДС-М, защищает от столбняка, дифтерии и коклюша.
Благодаря применению этой вакцины удалось ликвидировать столбняк и дифтерию, а также существенно сократить количество заболеваний коклюшем. Из-за снижения степени охвата прививками против дифтерии и коклюша, в последнее время существенно увеличился уровень заболеваемости этими инфекциями. Из-за такой неблагоприятной обстановки прививка АКДС в Екатеринбурге дополнительно назначена для взрослого населения.
Зачем нужны прививки АКДС
Столбняк – это заболевание нервной системы, которое вызывают попавшие в рану бактерии. Столбняк может возникнуть у людей любого возраста и протекает он очень тяжело.
Коклюш – это заболевание дыхательной системы, главным симптомом которого является «спазматический» кашель. Сильные осложнения возможны у детей первого года жизни и у новорожденных и, поскольку они слишком восприимчивы к данной инфекции.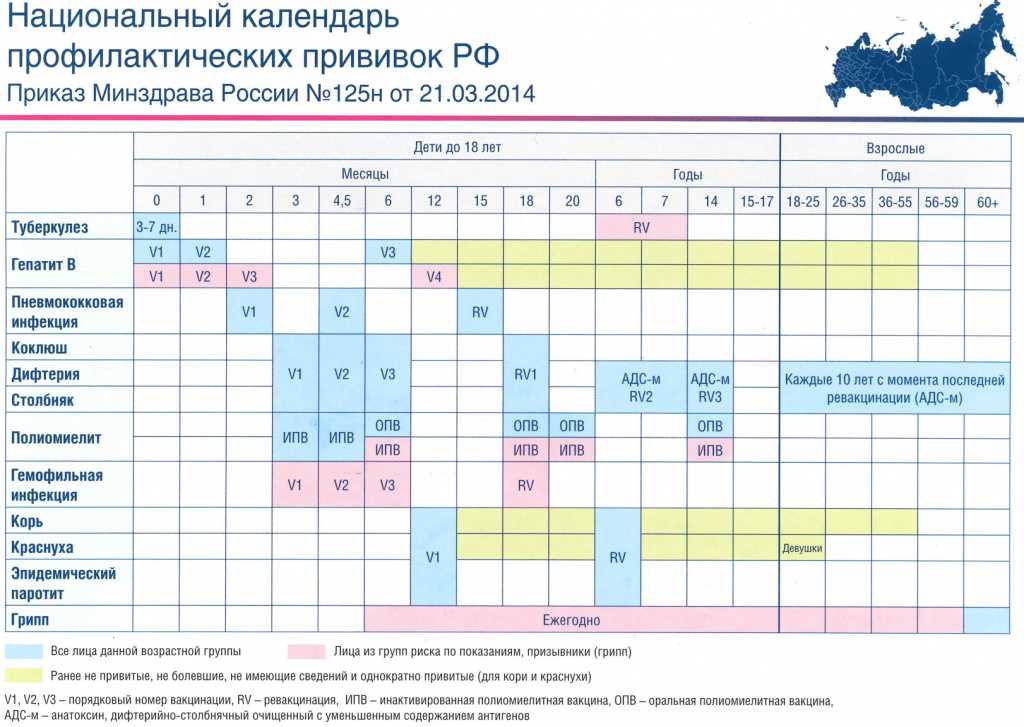
Дифтерия может привести к блокированию дыхательных путей. При дифтерии также возможны такие серьёзные осложнения, как поражение почек и сердца.
Прививка от акд делается в бедро, внутримышечно.
План вакцинации
В Екатеринбурге прививку АКДС детям ставят в 3,4-5 и 6 месяцев с ревакцинацией в 18 месяцев. В соответствии с календарём прививок, ревакцинации взрослых вакциной АДС-М осуществляются каждых 10 лет.
Побочные эффекты
Достаточно редко вакцина АКДС способна вызвать такие умеренные побочные эффекты, как припухание и покраснение в месте инъекции, умеренная болезненность, небольшая лихорадка. На протяжении 1-2 дней после прививки может возникнуть лёгкое недомогание и незначительно подняться температура (не выше 37,5 С). Также может появиться сыпь у тех детей, которые предрасположены к аллергическим реакциям.
Серьёзные осложнения после АКДС-иммунизаци наблюдались очень редко – меньше чем в 1 % случаев. Возможны судороги на фоне очень высокой температуры, и из-за этого тем детям, у которых возможна реакция, сделать прививку акдс нужно на фоне жаропонижающего средства.
Когда вакцинацию откладывают
В том случае, если у ребёнка наблюдается острое заболевание или есть неврологические нарушения. При неврологических нарушениях нужно проконсультироваться с неврологом, чтобы решить вопрос по поводу исключения коклюшного компонента и замещения вакцины АКДС вакциной АДС. Требуется очень хорошо всё обдумать и взвесить, поскольку у детей первого года жизни коклюш протекает слишком тяжело.
При остром заболевании прививку нужно делать после выздоровления ребёнка.
При слишком выраженной реакции после прививки, вопрос о повторном введении АКДС нужно рассматривать в индивидуальном порядке.
Вместо вакцины АКДС можно использовать зарубежный аналог – вакцину «Пентаксим». В этом препарате вместо цельноклеточного коклюшного компонента используется бесклеточный, практически не вызывающий побочных реакций. Кроме того, вакцина защищает от полиомиелита и гемофильной инфекции типа b (Хиб). Прививку «Пентаксимом» можно делать ребёнку в возрасте 4-6 лет, продлив таким образом иммунитет против коклюша.
Частота кожных реакций после введения вакцины против COVID-19 с РНК-мессенджером | Дерматология | JAMA Dermatology
Кожно-слизистые реакции, такие как зуд, крапивница и ангионевротический отек, могут возникать после вакцинации матричной РНК (мРНК) COVID-19. Насколько нам известно, случаи этих реакций и рецидивов при последующей вакцинации не описаны. Кожные реакции могут способствовать ненужному отказу от вакцинации в будущем.
Методы
Мы проспективно изучили сотрудников Mass General Brigham, получивших мРНК-вакцину против COVID-19 (первая доза: с 16 декабря 2020 г. по 20 января 2021 г.; последующее наблюдение до 26 февраля 2021 г.; электронные методы в Приложении). Утверждение институционального наблюдательного совета было предоставлено комитетом по исследованиям человека Mass General Brigham с отказом от информированного согласия. В течение 3 дней после вакцинации сотрудники проводили ежедневные опросы о симптомах с использованием многостороннего подхода, включая электронную почту, текстовые сообщения, телефон и ссылки на приложения для смартфонов.
Мы подсчитали количество и частоту кожных реакций, о которых сообщали сами, с 95% доверительными интервалами, используя в качестве знаменателя респондентов, проводивших обследование по симптомам, в разбивке по дозе. Мы сравнивали частоты, используя тесты χ 2 . Статистический анализ проводился с использованием SAS, версия 9.4 (Институт SAS), и статистическая значимость была установлена на уровне P < 0,05.
Полученные результаты
Из 49197 сотрудников, получивших первую дозу COVID-19вакцины, 12464 (25%) получили вакцину Pfizer-BioNtech и 36733 (75%) получили вакцину Moderna. Как минимум 1 исследование симптомов было проведено 40 640 (83%) после введения первой дозы вакцины.
О кожных реакциях сообщили 776 респондентов после дозы 1 (1,9%; 95% ДИ, 1,8%-2,1%; таблица и рисунок). Сыпь и зуд (кроме места инъекции) были наиболее распространенными кожными реакциями, о которых сообщили 559 (1%; 95% ДИ, 1,8%-2,1%). Средний (SD) возраст тех, кто сообщил о кожных реакциях, составил 41 (14) лет. Кожные реакции чаще встречались у женщин (656 [85%]), чем у мужчин (120 [15%]; P < .001) и различались по расе (62% белых, 7% черных и 12% азиатов;
Сыпь и зуд (кроме места инъекции) были наиболее распространенными кожными реакциями, о которых сообщили 559 (1%; 95% ДИ, 1,8%-2,1%). Средний (SD) возраст тех, кто сообщил о кожных реакциях, составил 41 (14) лет. Кожные реакции чаще встречались у женщин (656 [85%]), чем у мужчин (120 [15%]; P < .001) и различались по расе (62% белых, 7% черных и 12% азиатов;
Из тех, кто самостоятельно сообщил о кожной реакции на первую дозу, 741 (95%) получили вторую дозу. Среди 609 человек, прошедших обследование симптомов после введения второй дозы, 508 (83%) не сообщили о повторных кожных реакциях.
Среди тех, у кого не было кожных реакций на первую дозу, 765 (2,3%) сообщили о кожных реакциях после второй дозы. Сыпь и зуд (кроме места инъекции) были наиболее распространенными (546 [1,6%]; 95% ДИ, 1,5%-1,8%).
Обсуждение
В этой предполагаемой когорте из почти 50 000 медицинских работников 1,9% сообщили о кожных реакциях после получения первой дозы мРНК вакцины против COVID-19. Из более чем 600 сотрудников с кожными реакциями на первую дозу вакцины у 83% не было рецидивов кожных реакций. Еще 2,3% сообщили о кожных реакциях только после введения второй дозы вакцины.
Из более чем 600 сотрудников с кожными реакциями на первую дозу вакцины у 83% не было рецидивов кожных реакций. Еще 2,3% сообщили о кожных реакциях только после введения второй дозы вакцины.
О кожных реакциях чаще сообщалось среди женщин, что было похоже на сообщения о местных реакциях в месте инъекции и анафилаксии после вакцинации мРНК COVID. 1 ,2 Насколько нам известно, основная причина этой разницы еще не известна, хотя лекарственная аллергия чаще встречается у женщин. 3
Ограничения этого исследования включают использование данных, предоставленных самими исследователями. Однако многие сотрудники были клиницистами; таким образом, данные могут быть более надежными. Реакции, о которых сообщают сами, могут способствовать недоверию к вакцинации. Это исследование фиксирует кожные реакции, которые произошли в течение 3 дней после вакцинации, и поэтому не может оценить отсроченные кожные реакции. 2
Кожные реакции, включая зуд, сыпь, крапивницу и отек, наблюдались более чем у 4% тех, кто получил 2 дозы мРНК-вакцины против COVID-19. Спектр зарегистрированных кожных реакций после вакцинации мРНК включает обширные местные реакции, крапивницу и кореподобные реакции. 2 ,4 В отличие от анафилаксии кожные реакции сами по себе не являются противопоказанием к ревакцинации. 5 В этой когорте большинство людей получили вторую дозу без повторных реакций. Направление к аллергологу или дерматологу не требуется при большинстве реакций, но его следует рассмотреть для пациентов с немедленными или тяжелыми реакциями. 6 Эти данные обнадеживают миллионы американцев, у которых в наступающем году после вакцинации могут развиться кожные реакции.
Спектр зарегистрированных кожных реакций после вакцинации мРНК включает обширные местные реакции, крапивницу и кореподобные реакции. 2 ,4 В отличие от анафилаксии кожные реакции сами по себе не являются противопоказанием к ревакцинации. 5 В этой когорте большинство людей получили вторую дозу без повторных реакций. Направление к аллергологу или дерматологу не требуется при большинстве реакций, но его следует рассмотреть для пациентов с немедленными или тяжелыми реакциями. 6 Эти данные обнадеживают миллионы американцев, у которых в наступающем году после вакцинации могут развиться кожные реакции.
Наверх
Информация о статье
Принято для публикации: 3 мая 2021 года.
Опубликовано онлайн: 23 июня 2021 года. DOI: 10.1001/jamadermatol.2021.2114
Соответствующий автор: Lacey B. Robinson, MD, MPH MPH MPH MPH MPH MPH MPH MPH MPH MPH MPH MPH MPH MPH MSPH MSPH MSPH Больница, 55 Fruit St, Cox 201, Boston, MA 02114 (lbrobinson@mgh. harvard.edu).
harvard.edu).
Вклад авторов: Доктора Робинсон и Блюменталь имели полный доступ ко всем данным исследования и несут ответственность за целостность данных и точность анализа данных.
Концепция и дизайн: Робинсон, Блюменталь.
Сбор, анализ или интерпретация данных: Робинсон, Хашимото, Викнер, Шеной, Ландман, Блюменталь.
Составление рукописи: Робинсон, Блюменталь.
Критическая проверка рукописи на наличие важного интеллектуального содержания: Робинсон, Хашимото, Викнер, Шеной, Ландман, Блюменталь.
Получено финансирование: Блюменталь.
Административная, техническая или материальная поддержка: Хашимото, Викнер, Шеной, Ландман, Блюменталь.
Надзор: Блюменталь.
Раскрытие информации о конфликте интересов: Д-р Блюменталь сообщает о грантах Американской академии аллергии, Фонда астмы и иммунологии, CRICO и Массачусетской больницы общего профиля, помимо представленной работы. Д-р Ландман сообщает о личных гонорарах от Совета по кибербезопасности Abbott Medical Device помимо представленной работы. Д-р Викнер сообщает о занятости в CVS Health помимо представленной работы. Других раскрытий не поступало.
Д-р Ландман сообщает о личных гонорарах от Совета по кибербезопасности Abbott Medical Device помимо представленной работы. Д-р Викнер сообщает о занятости в CVS Health помимо представленной работы. Других раскрытий не поступало.
Финансирование/поддержка: Эта работа была поддержана Национальным институтом здравоохранения (NIH) грантом K01 AI125631 и Массачусетской больнице общего профиля (MGH) DOM Transformative Scholar Program.
Роль спонсора/спонсора: Финансирующие организации не участвовали в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; подготовка, рецензирование или утверждение рукописи; и решение представить рукопись для публикации.
Дополнительные взносы: Мы благодарим многих коллег из системы здравоохранения Mass General Brigham за разработку и реализацию программы вакцинации против COVID-19, в том числе Пола Д. Биддингера, доктора медицины, Томаса Д. Секвиста, доктора медицины, магистра здравоохранения, Упека Самаракуна. , MS, PhD, MPH, Раджеш Патель, MD, MPH, Leeann Ouimet, MBA, Аллен Джадд, AB, Алина Банерджи, MD, Анна Р. Вольфсон, MD, Ребекка Сафф, MD, PhD, Эйдан А. Лонг, MD, Лили Ли, доктор медицины, Таня М. Лейдлоу, доктор медицины, Дэвид И. Хонг, доктор медицины, Анна М. Фельдвег, доктор медицины, Катрин Стинсон, магистр здравоохранения, Аманда Дж. Сенти, доктор философии, Линн Симпсон, магистр здравоохранения, Нахал Бейк, доктор медицины, BCPS, Кристиан М. Манчини, бакалавр наук, Амелия С. Коган, магистр здравоохранения, и Обри Э. МакМахон, бакалавр наук. Компенсации получено не было.
, MS, PhD, MPH, Раджеш Патель, MD, MPH, Leeann Ouimet, MBA, Аллен Джадд, AB, Алина Банерджи, MD, Анна Р. Вольфсон, MD, Ребекка Сафф, MD, PhD, Эйдан А. Лонг, MD, Лили Ли, доктор медицины, Таня М. Лейдлоу, доктор медицины, Дэвид И. Хонг, доктор медицины, Анна М. Фельдвег, доктор медицины, Катрин Стинсон, магистр здравоохранения, Аманда Дж. Сенти, доктор философии, Линн Симпсон, магистр здравоохранения, Нахал Бейк, доктор медицины, BCPS, Кристиан М. Манчини, бакалавр наук, Амелия С. Коган, магистр здравоохранения, и Обри Э. МакМахон, бакалавр наук. Компенсации получено не было.
Отказ от ответственности: Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения NIH, Mass General Brigham или MGH.
использованная литература
1.
Симабукуро
ТТ, Коул
М, Вс
младший. Сообщения об анафилаксии после получения мРНК вакцин против COVID-19 в США — 14 декабря 2020 г. — 18 января 2021 г. JAMA . 2021;325(11):1101-1102. дои: 10.1001/jama.2021.1967PubMedGoogle ScholarCrossref
— 18 января 2021 г. JAMA . 2021;325(11):1101-1102. дои: 10.1001/jama.2021.1967PubMedGoogle ScholarCrossref
2.
Блюменталь КГ, Фримен Э.Э., Сафф РР, и другие. Отсроченные крупные местные реакции на вакцину мРНК-1273 против SARS-CoV-2. N Engl J Med . 2021;384(13):1273-1277. doi:10.1056/NEJMc2102131PubMedGoogle ScholarCrossref
3.
Блюменталь кг, Ли Ю, Акер ВВ, и другие. Синдром множественной лекарственной непереносимости и синдром множественной лекарственной аллергии: эпидемиология и связь с тревогой и депрессией. Аллергия . 2018;73(10):2012-2023. doi:10.1111/all.13440PubMedGoogle ScholarCrossref
4.
McMahon
DE, Амерсон
Е, Розенбах
М,
и другие. Кожные реакции, зарегистрированные после вакцинации Moderna и Pfizer против COVID-19: основанное на реестре исследование 414 случаев. J Am Acad Dermatol .S0190-9622(21)00658-7. In Press.PubMedGoogle Scholar
Кожные реакции, зарегистрированные после вакцинации Moderna и Pfizer против COVID-19: основанное на реестре исследование 414 случаев. J Am Acad Dermatol .S0190-9622(21)00658-7. In Press.PubMedGoogle Scholar
5.
Келсо Дж. М., Гринхот MJ, Ли Джей Ти, и другие. Побочные реакции на вакцины, параметр практики, обновление 2012 г. J Allergy Clin Immunol . 2012;130(1):25-43. doi:10.1016/j.jaci.2012.04.003PubMedGoogle ScholarCrossref
6.
Центры США по контролю и профилактике заболеваний. Что делать, если у вас возникла аллергическая реакция после вакцинации против COVID-19. По состоянию на 5 марта 2021 г. https://www.cdc.gov/coronavirus/2019ncov/vaccines/safety/allergic-reaction.html.
Тяжелые аллергические реакции после вакцинации против COVID-19 вакциной Pfizer/BioNTech в Великобритании и США
- Список журналов
- Коллекция чрезвычайных ситуаций в области общественного здравоохранения Nature
- PMC7 4
Аллерго Дж. Междунар. 2021; 30(2): 51–55.
Междунар. 2021; 30(2): 51–55.
Опубликовано в сети 24 февраля 2021 г. doi: 10.1007/s40629-020-00160-4
Заявление о позиции Немецких аллергологических обществ: Медицинская ассоциация немецких аллергологов (AeDA), Немецкое общество аллергологов и клинической иммунологии (DGAKI) и Общество по детской аллергологии и экологической медицине (GPA)
, 1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13, 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 , 27 , 28 , 29 и 30
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности
У двух сотрудников Национальной службы здравоохранения (NHS) в Англии развились тяжелые аллергические реакции после введения вакцины BNT162b2 против COVID-19 (коронавирусная болезнь 2019 г. ). Британский SmPC для вакцины BNT162b2 уже включает ссылку на противопоказание для использования у лиц, у которых была аллергическая реакция на вакцину или любой из ее компонентов. В качестве меры предосторожности Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) выпустило временное руководство для NHS о том, чтобы в принципе не вакцинировать «пациентов с тяжелой аллергией». Аллергические реакции на вакцины очень редки, но известно, что компоненты вакцин вызывают аллергические реакции. BNT162b2 — это вакцина на основе мРНК, встроенной в липидные наночастицы и смешанной с другими веществами для обеспечения ее транспорта в клетки. В основном клиническом испытании фазы III вакцина BNT162b2 в целом хорошо переносилась, но это крупное клиническое испытание, использованное для одобрения вакцины MHRA и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, исключало лиц с «тяжелой побочной реакцией в анамнезе, связанной с вакцины и/или тяжелой аллергической реакции (например, анафилаксии) на компонент исследуемого препарата».
). Британский SmPC для вакцины BNT162b2 уже включает ссылку на противопоказание для использования у лиц, у которых была аллергическая реакция на вакцину или любой из ее компонентов. В качестве меры предосторожности Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) выпустило временное руководство для NHS о том, чтобы в принципе не вакцинировать «пациентов с тяжелой аллергией». Аллергические реакции на вакцины очень редки, но известно, что компоненты вакцин вызывают аллергические реакции. BNT162b2 — это вакцина на основе мРНК, встроенной в липидные наночастицы и смешанной с другими веществами для обеспечения ее транспорта в клетки. В основном клиническом испытании фазы III вакцина BNT162b2 в целом хорошо переносилась, но это крупное клиническое испытание, использованное для одобрения вакцины MHRA и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, исключало лиц с «тяжелой побочной реакцией в анамнезе, связанной с вакцины и/или тяжелой аллергической реакции (например, анафилаксии) на компонент исследуемого препарата». Вакцины признаны одним из наиболее эффективных вмешательств в области общественного здравоохранения. Это повторное введение чужеродного белка (антигена) требует тщательного сбора аллергологического анамнеза перед каждым применением и уточнения диагноза, а также оценки риска и пользы перед каждой инъекцией. Тяжелые аллергические реакции на вакцины случаются редко, но могут быть опасными для жизни, поэтому целесообразно повышать осведомленность об этой опасности среди групп вакцинации и принимать адекватные меры предосторожности, пока не будет накоплен дополнительный опыт использования этой новой вакцины.
Вакцины признаны одним из наиболее эффективных вмешательств в области общественного здравоохранения. Это повторное введение чужеродного белка (антигена) требует тщательного сбора аллергологического анамнеза перед каждым применением и уточнения диагноза, а также оценки риска и пользы перед каждой инъекцией. Тяжелые аллергические реакции на вакцины случаются редко, но могут быть опасными для жизни, поэтому целесообразно повышать осведомленность об этой опасности среди групп вакцинации и принимать адекватные меры предосторожности, пока не будет накоплен дополнительный опыт использования этой новой вакцины.
Ключевые слова: BNT162b2, Тяжелые аллергические реакции, Анафилаксия, Вакцины, мРНК
9 декабря 2020 г. Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) Соединенного Служба здравоохранения (NHS) в Англии после введения вакцины BNT162b2 против COVID-19 (коронавирусная болезнь, 2019 г.). У обоих пациентов в анамнезе была анафилаксия, и, насколько известно в настоящее время, оба быстро и полностью выздоровели от этих тяжелых аллергических реакций. Поскольку неясно, какой компонент вакцины вызвал реакцию, было начато расследование, чтобы полностью понять два инцидента и их причины.
Поскольку неясно, какой компонент вакцины вызвал реакцию, было начато расследование, чтобы полностью понять два инцидента и их причины.
Британская сводка характеристик продукта (SmPC) для вакцины BNT162b2 уже включает ссылку на противопоказание для использования у лиц, у которых была аллергическая реакция на вакцину или любой из ее компонентов [1]. В качестве меры предосторожности MHRA издало временное руководство для NHS, чтобы в принципе не вакцинировать «пациентов с тяжелой аллергией». Вполне вероятно, что ограничение показаний, введенное в настоящее время MHRA, приведет к тому, что значительно меньше пациентов смогут получить вакцину.
Дальнейших сообщений о побочных реакциях можно ожидать после получения разрешения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в чрезвычайных ситуациях (EUA) для BNT162b2, выданного 11 декабря 2020 г., поскольку теперь, вероятно, будет быстро достигнуто очень большое количество вакцин.
Аллергические реакции на вакцины возникают очень редко, от 1 на 1 000 000 до 30 на 100 000 прививок [2–6].
Компоненты вакцины, которые, как известно, вызывают аллергические реакции, включают остатки белков животного происхождения, противомикробные агенты, консерванты, стабилизаторы и адъюванты в дополнение к активному компоненту вакцины (собственному антигену), которые вызывают иммунный ответ [2–6]. Отдельные компоненты вакцины, вызывающие анафилаксию вакцины, включают белок куриного яйца, желатин, белок коровьего молока и другие добавки и микроэлементы, оставшиеся после производственного процесса, в дополнение к компонентам латекса из герметизирующих пробок во множестве флаконов с вакциной [3–6]. .
BNT162b2 «временно лицензирован» в Соединенном Королевстве для активной иммунизации для предотвращения заболевания COVID-19, вызванного вирусом SARS-CoV‑2, у лиц в возрасте 16 лет и старше [7].
Вакцину вводят внутримышечно двумя дозами по 0,3 мл с интервалом 21 день. Размороженная мРНК-вакцина COVID-19 BNT162b2 требует разбавления в оригинальном флаконе (0,45 мл) 1,8 мл неконсервированного 0,9% раствора хлорида натрия для инъекций перед отбором дозы 0,3 мл [7, 8].
Перечисленные вспомогательные вещества в BNT162b2: ALC-0315 ((4-гидроксибутил)азандиил)бис(гексан-6,1-диил)бис(2-гексилдеканоат), ALC-0159 (2-((полиэтиленгликоль)-2000) -N,N-дитетрадецилацетамид), 1,2-дистеароил-sn-глицеро-3-фосфохолин, холестерин, хлорид калия, дигидрофосфат калия, хлорид натрия, дигидрат динатрия гидрофосфата, сахароза и вода для инъекций [7, 8] .
Один флакон (0,45 мл) содержит пять доз по 30 мкг высокоочищенной одноцепочечной 5′-кэпированной мРНК (РНК BNT162b2), полученной путем бесклеточной транскрипции in vitro на соответствующей ДНК-матрице и кодирующей вирусный шип ( S) белок SARS-CoV‑2 [7, 8].
Эта мРНК встроена в липидные наночастицы. мРНК быстро расщепляется рибонуклеазами, легко поглощается мононуклеарными фагоцитами и имеет плохую способность проникать через клеточные мембраны из-за отрицательного электрического заряда и высокой молекулярной массы. Следовательно, мРНК требует защитной оболочки для использования в качестве вакцины. В вакцине BioNTech в качестве невирусных векторов для этой цели используются наночастицы на основе липидов (LNP), содержащие катионные липиды, покрывающие полианионную мРНК ее третичными или четвертичными аминами, дополненные цвиттерионными липидами, имитирующими фосфолипиды клеточной мембраны, и холестерином, который стабилизирует липидный бислой наночастицы.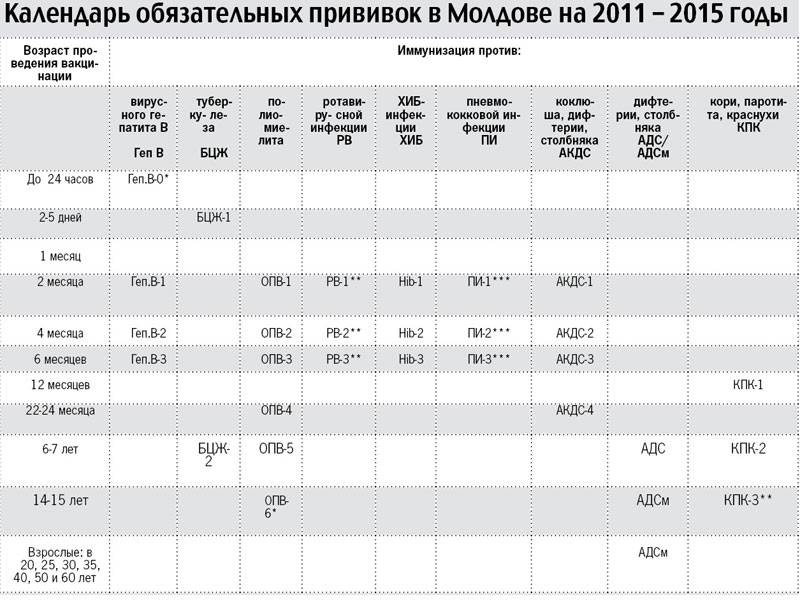 Наконец, липиды, модифицированные полиэтиленгликолем (ПЭГ), позволяют собирать гидратную оболочку, повышая растворимость ЛНЧ.
Наконец, липиды, модифицированные полиэтиленгликолем (ПЭГ), позволяют собирать гидратную оболочку, повышая растворимость ЛНЧ.
ПЭГ или макрогол представляет собой полиэфирное соединение, обычно используемое в качестве добавки в косметике, фармацевтике, а также в пищевых продуктах [9]. ПЭГ существует в типах с молекулярной массой от 200 г/моль до 10 000 000 г/моль, и сообщалось об аллергических реакциях после его использования в различных лекарствах и косметических продуктах [10, 11]. Существует перекрестная реактивность с полисорбатом 80 из-за общих химических мотивов [12, 13]. Аллергические реакции на ПЭГ, вероятно, диагностируются слишком редко, поэтому ПЭГ также считается «скрытым» аллергеном [11]. При диагностических кожных пробах были описаны тяжелые аллергические реакции, поэтому их следует проводить только в специализированных аллергологических центрах в соответствии с опубликованными стандартными схемами.
В опорном клиническом испытании фазы III вакцина BNT162b2 в целом хорошо переносилась [8]. Всего было рандомизировано 43 548 участников, из которых 43 448 получили одну инъекцию, 21 720 — BNT162b2 и 21 728 — плацебо, 18 556 получили вторую дозу BNT162b2 [8]. Наиболее частыми побочными реакциями были местные реакции в месте инъекции (84,7%), утомляемость (62,8%), головная боль (55,1%), мышечная боль (38,3%), озноб (31,9%), боль в суставах (23,6%), лихорадка. (14,2%) [7, 8]. Большинство реакций были легкой или средней степени тяжести. Тяжелые побочные реакции возникали в 4,6% случаев, чаще после второй дозы и реже у взрослых старше 55 лет. Лимфаденопатия была зарегистрирована в 0,3%. Системные побочные реакции обычно были легкой или средней степени тяжести, как правило, возникали на следующий день после вакцинации и продолжались от одного до двух дней после нее [7, 8]. Возникновение аллергических реакций было зарегистрировано в одинаковых количествах как в группе вакцины, так и в группе плацебо (0,63% против 0,51%) [7, 8]. Однако это крупное клиническое испытание, использованное для поддержки одобрения вакцины MHRA и FDA, исключило лиц с «тяжелой побочной реакцией, связанной с вакциной, и/или тяжелой аллергической реакцией (например, анафилаксией) на компонент вакцины в анамнезе.
Всего было рандомизировано 43 548 участников, из которых 43 448 получили одну инъекцию, 21 720 — BNT162b2 и 21 728 — плацебо, 18 556 получили вторую дозу BNT162b2 [8]. Наиболее частыми побочными реакциями были местные реакции в месте инъекции (84,7%), утомляемость (62,8%), головная боль (55,1%), мышечная боль (38,3%), озноб (31,9%), боль в суставах (23,6%), лихорадка. (14,2%) [7, 8]. Большинство реакций были легкой или средней степени тяжести. Тяжелые побочные реакции возникали в 4,6% случаев, чаще после второй дозы и реже у взрослых старше 55 лет. Лимфаденопатия была зарегистрирована в 0,3%. Системные побочные реакции обычно были легкой или средней степени тяжести, как правило, возникали на следующий день после вакцинации и продолжались от одного до двух дней после нее [7, 8]. Возникновение аллергических реакций было зарегистрировано в одинаковых количествах как в группе вакцины, так и в группе плацебо (0,63% против 0,51%) [7, 8]. Однако это крупное клиническое испытание, использованное для поддержки одобрения вакцины MHRA и FDA, исключило лиц с «тяжелой побочной реакцией, связанной с вакциной, и/или тяжелой аллергической реакцией (например, анафилаксией) на компонент вакцины в анамнезе. исследуемое лекарство» [7, 8]. Исходя из этого, во вкладыше к упаковке в Великобритании говорится, что вакцину не следует вводить лицам, страдающим аллергией на активный ингредиент или любой другой из перечисленных ингредиентов. В этом отношении информация о пациенте соответствует критериям исключения из клинического исследования.
исследуемое лекарство» [7, 8]. Исходя из этого, во вкладыше к упаковке в Великобритании говорится, что вакцину не следует вводить лицам, страдающим аллергией на активный ингредиент или любой другой из перечисленных ингредиентов. В этом отношении информация о пациенте соответствует критериям исключения из клинического исследования.
Вакцины признаны одним из наиболее эффективных средств общественного здравоохранения. Основной целью программ вакцинации является защита вакцинированных лиц. Кроме того, во многих случаях они также направлены на защиту непривитых людей. Конечной целью является создание коллективного иммунитета, т. е. устойчивости к распространению заразного заболевания в популяции, которое возникает, когда достаточно высокая доля людей невосприимчива к этому заболеванию, особенно с помощью вакцинации [14].
Для развития такого коллективного иммунитета требуется уровень вакцинации >60% всего населения [14].
Однако для достижения эффективной индивидуальной иммунизации >95% с помощью BNT162b2 необходима вторая вакцинация («ревакцинация»). Это повторное введение чужеродного белка (антигена) требует тщательного сбора аллергологического анамнеза перед каждым применением и, при необходимости, уточнения диагноза, а также оценки риска и пользы перед каждой инъекцией.
Это повторное введение чужеродного белка (антигена) требует тщательного сбора аллергологического анамнеза перед каждым применением и, при необходимости, уточнения диагноза, а также оценки риска и пользы перед каждой инъекцией.
На этом фоне констатируем, что
Пациенты и лица, которым предстоит вакцинация против COVID-19, также должны регулярно информироваться о возможных тяжелых аллергических/анафилактических реакциях и опрашиваться относительно таких инцидентов в прошлом.
Аллергические реакции на добавки, в частности ПЭГ и перекрестно-реактивные аналоги ПЭГ, необходимо систематически исследовать, чтобы выявить пациентов с риском.
При подозрении на заболевание необходимо провести аллергологическое уточнение (кожные прик-тесты, лабораторная диагностика) и консультацию аллерголога.
Персонал, выполняющий вакцинацию против COVID-19, всегда должен быть готов к возможности тяжелых аллергических/анафилактических реакций, а вакцинационные бригады и центры вакцинации должны быть обучены лечению анафилаксии в соответствии с рекомендациями действующего руководства AWMF по острой терапия и лечение анафилаксии [15].
Будет важно понять конкретную причину двух зарегистрированных тяжелых аллергических реакций и историю болезни вовлеченных лиц, чтобы можно было более точно определить любые риски аллергических реакций и, если возможно, обойти их.
Текущие официальные рекомендации в Великобритании исключают пациентов с тяжелой аллергией от вакцинации BNT162b2.
Необходимы более точные определения типа, причины и тяжести тяжелых аллергических реакций, поскольку, учитывая высокую заболеваемость пациентов с «тяжелыми» аллергиями (значительная доля всего населения в Европе и США, в зависимости от определение), исключение всех таких пациентов из вакцинации может оказать значительное влияние на достижение цели коллективного иммунитета. С другой стороны, более точное определение (например, «пациенты, склонные к анафилаксии») предполагает лишь 1–3 % населения, для которого вакцинация невозможна или возможна только при соблюдении специальных мер защиты.
Необходимо собрать дополнительные данные как из клинических испытаний, так и из клинической практики, которые улучшат наши знания о профиле безопасности вакцин против COVID-19, особенно в отношении тяжелых аллергических реакций.

Тяжелые аллергические реакции на вакцины случаются редко, но могут быть опасными для жизни, и разумно повышать осведомленность об этой опасности среди групп вакцинаторов и принимать адекватные меры предосторожности, пока не будет накоплен дополнительный опыт использования этой новой вакцины. Пациенты с тяжелыми аллергическими реакциями в анамнезе могут быть вакцинированы адекватными лекарствами и врачами, имеющими опыт лечения анафилактических реакций, если текущее расследование в Великобритании позволяет эту рекомендацию. В настоящее время считается, что ПЭГ, скорее всего, вызвал тяжелые аллергические реакции у 2 пострадавших пациентов в Великобритании, но ожидаются дальнейшие исследования.
В случае подтверждения необходимо будет исключить из вакцинации BNT162b2 только пациентов с известными аллергическими реакциями на ПЭГ, аналоги ПЭГ и другие добавки, но не всех пациентов с тяжелыми аллергическими реакциями в анамнезе, что значительно расширит пул потенциально вакцинируемых лиц.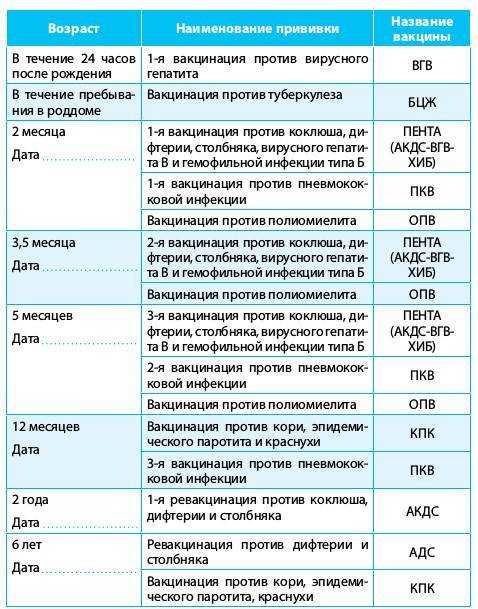
Для BNT162b2 мониторинг безопасности будет продолжаться в течение 2 лет после введения второй дозы вакцины в рамках исследования [8].
| EUA | Emergency Use Authorization |
| FDA | Food and Drug Administration |
| LNP | Lipid-based nano particles |
| MHRA | Medicines and Healthcare products Regulatory Agency |
| NHS | Национальная служба здравоохранения |
| ПЭГ | Полиэтиленгликоль |
| SmPC | Обзор характеристик продукта |
| S-белок | Спайк-белок |
Финансирование в открытом доступе организовано и разрешено Projekt DEAL
L. сборы от HAL Allergie, персональные сборы от ALK Abelló, гранты и персональные сборы от LETI Pharma, гранты и персональные сборы от Stallergenes, гранты от Quintiles, гранты и персональные сборы от Sanofi, гранты от ASIT biotech, гранты от Lofarma, персональные сборы от Allergy Therapeut. , гранты от AstraZeneca, гранты и персональные гонорары от GSK, гранты от Inmunotek, персональные гонорары от Cassella med, персональные гонорары от Novartis, помимо представленной работы; и членство: AeDA, DGHNO, Немецкая академия аллергологии и клинической иммунологии, HNO-BV, GPA, EAACI. К. Хартманн получил финансирование исследований от Euroimmun и Thermofisher, а также оплату консультаций или лекций от Allergopharma, ALK-Abelló, Blueprint, Deciphera, Menarini, Novartis и Takeda. Дж. Ринг сообщает о личных гонорарах от Mylan, личных гонорарах от Allergika, помимо представленной работы. A. Chaker сообщает о грантах и прочем от Allergopharma, грантах и прочем от ALK Abello, грантах и прочем от Bencard/Allergen Therapeutics, грантах и прочем от ASIT Biotech, прочем от Lofarma, грантах и прочем от GSK, грантах и прочем от Novartis, грантах и другие от ЛЭТИ, гранты и другие от Roche, гранты и другие от Zeller, другие от Sanofi Genzyme, гранты от Европейского технологического института, гранты и другие от AstraZeneca, гранты и другие от Immunotek, вне представленной работы; кроме того, у доктора Чейкера есть патент А на соотношение иммунных клеток в качестве прогностического показателя терапевтического успеха в аллерген-специфической иммунотерапии: 17 177 681,8 без лицензии.
, гранты от AstraZeneca, гранты и персональные гонорары от GSK, гранты от Inmunotek, персональные гонорары от Cassella med, персональные гонорары от Novartis, помимо представленной работы; и членство: AeDA, DGHNO, Немецкая академия аллергологии и клинической иммунологии, HNO-BV, GPA, EAACI. К. Хартманн получил финансирование исследований от Euroimmun и Thermofisher, а также оплату консультаций или лекций от Allergopharma, ALK-Abelló, Blueprint, Deciphera, Menarini, Novartis и Takeda. Дж. Ринг сообщает о личных гонорарах от Mylan, личных гонорарах от Allergika, помимо представленной работы. A. Chaker сообщает о грантах и прочем от Allergopharma, грантах и прочем от ALK Abello, грантах и прочем от Bencard/Allergen Therapeutics, грантах и прочем от ASIT Biotech, прочем от Lofarma, грантах и прочем от GSK, грантах и прочем от Novartis, грантах и другие от ЛЭТИ, гранты и другие от Roche, гранты и другие от Zeller, другие от Sanofi Genzyme, гранты от Европейского технологического института, гранты и другие от AstraZeneca, гранты и другие от Immunotek, вне представленной работы; кроме того, у доктора Чейкера есть патент А на соотношение иммунных клеток в качестве прогностического показателя терапевтического успеха в аллерген-специфической иммунотерапии: 17 177 681,8 без лицензии. М. Вагенманн получал гонорары за консультации, лекции или исследовательскую поддержку от следующих компаний за последние 3 года: ALK-Abelló, Allergopharma, AstraZeneca, Bencard Allergie, Genzyme, GSK, HAL Allergie, Infectopharm, LETI Pharma, MEDA Pharma, Novartis. , Regeneron, Sanofi Aventis, Stallergenes, Teva — все за пределами настоящей работы. Т. Анкерманн получил гонорары, проживание и транспортные расходы для лекций и публикаций от следующих компаний и учреждений: Abbvie, Aimmune, Allergopharma, Chiesi, Infectopharm, Novartis, UKSH Academy, RG, издательство Springer, Научное издательство, GPP e. В, ГПД е. В., наппа э. В., ОГКЮ е. В. Д-р Анкерманн получил гонорары за консультативные советы от Boehringer Ingelheim, Aimmune и гонорары за совет по безопасности от Allergopharma, все это не связано с настоящей работой. К. Фогельберг получил гонорары за лекции или гонорары консультантов или расходы на проезд и проживание от: ALK, Allergopharma, Aimmune, DBV, LETI, Novartis, Stallergenes, HAL, Bencard, Sanofi, Aimmune, GPA e.
М. Вагенманн получал гонорары за консультации, лекции или исследовательскую поддержку от следующих компаний за последние 3 года: ALK-Abelló, Allergopharma, AstraZeneca, Bencard Allergie, Genzyme, GSK, HAL Allergie, Infectopharm, LETI Pharma, MEDA Pharma, Novartis. , Regeneron, Sanofi Aventis, Stallergenes, Teva — все за пределами настоящей работы. Т. Анкерманн получил гонорары, проживание и транспортные расходы для лекций и публикаций от следующих компаний и учреждений: Abbvie, Aimmune, Allergopharma, Chiesi, Infectopharm, Novartis, UKSH Academy, RG, издательство Springer, Научное издательство, GPP e. В, ГПД е. В., наппа э. В., ОГКЮ е. В. Д-р Анкерманн получил гонорары за консультативные советы от Boehringer Ingelheim, Aimmune и гонорары за совет по безопасности от Allergopharma, все это не связано с настоящей работой. К. Фогельберг получил гонорары за лекции или гонорары консультантов или расходы на проезд и проживание от: ALK, Allergopharma, Aimmune, DBV, LETI, Novartis, Stallergenes, HAL, Bencard, Sanofi, Aimmune, GPA e.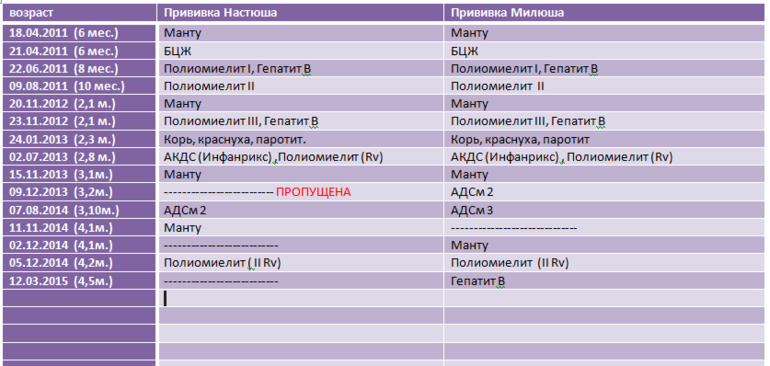 В., АППА е. В. все, что не относится к настоящей работе. Т. Верфель сообщает о грантах и/или гонорарах от AbbVie, ALK Abello, Almirall, Astellas, Bencard, Galderma, Janssen/JNJ, Leo Pharma, Leti, Lilly, Novartis, Pfizer, Regeneron/Sanofi, Stallergen, все за пределами настоящей работы. . А. Бауэр сообщает о грантах и личных гонорарах от Novartis, Leo Pharma, Sanofi/Regeneron, Shire/Takeda, Genentech, помимо представленной работы. Т. Зубербир сообщает о личных сборах и/или плате за разговоры с компаниями Bayer Health Care, FAES, Novartis, Henkel, AstraZeneca, AbbVie, ALK, Almirall, Astellas, Bencard, Berlin Chemie, HAL, Leti, Meda, Menarini, Merck, MSD, Pfizer, Sanofi, Stallergenes, Takeda, Teva, UCB, Kryolan, L’Oréal вне представленной работы. Т. Якоб сообщает о грантах, личных вознаграждениях и нефинансовой поддержке от Novartis, грантах, личных вознаграждениях и нефинансовой поддержке от ALK-Abello, личных вознаграждениях и нефинансовой поддержке от Allergy Therapeutics/Bencard, личных вознаграждениях от Allergopharma, личных вознаграждениях от Thermo Fisher, вне представленной работы.
В., АППА е. В. все, что не относится к настоящей работе. Т. Верфель сообщает о грантах и/или гонорарах от AbbVie, ALK Abello, Almirall, Astellas, Bencard, Galderma, Janssen/JNJ, Leo Pharma, Leti, Lilly, Novartis, Pfizer, Regeneron/Sanofi, Stallergen, все за пределами настоящей работы. . А. Бауэр сообщает о грантах и личных гонорарах от Novartis, Leo Pharma, Sanofi/Regeneron, Shire/Takeda, Genentech, помимо представленной работы. Т. Зубербир сообщает о личных сборах и/или плате за разговоры с компаниями Bayer Health Care, FAES, Novartis, Henkel, AstraZeneca, AbbVie, ALK, Almirall, Astellas, Bencard, Berlin Chemie, HAL, Leti, Meda, Menarini, Merck, MSD, Pfizer, Sanofi, Stallergenes, Takeda, Teva, UCB, Kryolan, L’Oréal вне представленной работы. Т. Якоб сообщает о грантах, личных вознаграждениях и нефинансовой поддержке от Novartis, грантах, личных вознаграждениях и нефинансовой поддержке от ALK-Abello, личных вознаграждениях и нефинансовой поддержке от Allergy Therapeutics/Bencard, личных вознаграждениях от Allergopharma, личных вознаграждениях от Thermo Fisher, вне представленной работы. М. Ворм сообщает о гонорарах за консультативные советы и лекционную деятельность от Regeneron Pharmaceuticals, DBV Technologies S.A, Stallergenes GmbH, HAL Allergie GmbH, Bencard Allergie GmbH, Allergopharma GmbH & Co. KG, ALK-Abelló Arzneimittel GmbH, Mylan Germany GmbH, Leo Pharma GmbH , Sanofi-Aventis Deutschland GmbH, Aimmune Therapeutics UK Limited, Actelion Pharmaceuticals Deutschland GmbH, Novartis AG, Biotest AG, AbbVie Deutschland GmbH & Co. KG, Lilly Deutschland GmbH, за пределами представленной работы. Н. Новак, Э. Хамельманн, К. Таубе, Х. Мерк, У. Рабе, К. Юнг, В. Шлентер, В. Верманн, С. Беккер, Н. Мюлленайзен, К. Немат, В. Чех, Х. Вреде, Р. Брелер, Т. Фукс, С. М. Шмидт и М. Герстлауэр заявляют, что у них нет конкурирующих интересов.
М. Ворм сообщает о гонорарах за консультативные советы и лекционную деятельность от Regeneron Pharmaceuticals, DBV Technologies S.A, Stallergenes GmbH, HAL Allergie GmbH, Bencard Allergie GmbH, Allergopharma GmbH & Co. KG, ALK-Abelló Arzneimittel GmbH, Mylan Germany GmbH, Leo Pharma GmbH , Sanofi-Aventis Deutschland GmbH, Aimmune Therapeutics UK Limited, Actelion Pharmaceuticals Deutschland GmbH, Novartis AG, Biotest AG, AbbVie Deutschland GmbH & Co. KG, Lilly Deutschland GmbH, за пределами представленной работы. Н. Новак, Э. Хамельманн, К. Таубе, Х. Мерк, У. Рабе, К. Юнг, В. Шлентер, В. Верманн, С. Беккер, Н. Мюлленайзен, К. Немат, В. Чех, Х. Вреде, Р. Брелер, Т. Фукс, С. М. Шмидт и М. Герстлауэр заявляют, что у них нет конкурирующих интересов.
1. ГСЗ Англии. Руководство группы пациентов в отношении мРНК-вакцины COVID-19 BNT162b2 (Pfizer/BioNTech) — Национальная программа вакцинации против COVID-19. Национальная служба здравоохранения Англии. 2020 г. 2020.pdf. По состоянию на 15 декабря 2020 г.
2. Caubet JC, Ponvert C. Аллергия на вакцину. Иммунол Аллергия Клин Норт Ам. 2014; 34: 597–613. doi: 10.1016/j.iac.2014.04.004. [PubMed] [CrossRef] [Академия Google]
3. Дрескин С.К., Хэлси Н.А., Келсо Дж.М., Вуд Р.А., Хаммелл Д.С., Эдвардс К.М., и соавт. Международный консенсус (ICON): аллергические реакции на вакцины. World Allergy Organ J. 2016; 9:32. doi: 10.1186/s40413-016-0120-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. McNeil MM, DeStefano F. Гиперчувствительность, связанная с вакциной. J Аллергия Клин Иммунол. 2018; 141:463–472. doi: 10.1016/j.jaci.2017.12.971. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Nilsson L, Brockow K, Alm J, Cardona V, Caubet JC, Gomes E, et al. Вакцинация и аллергия: позиционный документ EAACI, практические аспекты. Детская Аллергия Иммунол. 2017;28:628–640. doi: 10.1111/pai.12762. [PubMed] [CrossRef] [Академия Google]
6. Вуд Р.А. Аллергические реакции на вакцины. Детская Аллергия Иммунол.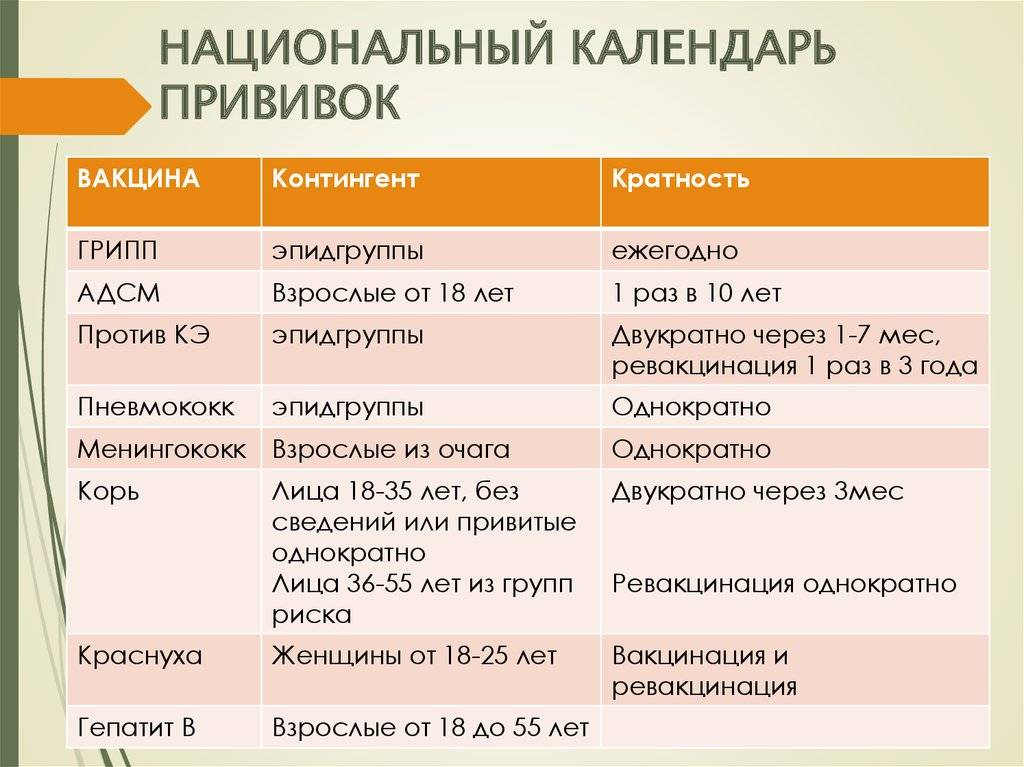 2013; 24: 521–526. doi: 10.1111/pai.12102. [PubMed] [CrossRef] [Google Scholar]
2013; 24: 521–526. doi: 10.1111/pai.12102. [PubMed] [CrossRef] [Google Scholar]
7. Англия, NHS. Англия, NHS.. www.england.nhs.uk. По состоянию на 15 декабря 2020 г.
8. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Безопасность и эффективность мРНК-вакцины BNT162b2 Covid-19. N Engl J Med. 2020 г.: 10.1056/NEJMoa2034577. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Pizzimenti S, Heffler E, Gentilcore E, Raie A, Bussolino C, Nebiolo F, et al. Реакции гиперчувствительности к макроголу во время очистительной подготовки к эндоскопии толстой кишки. J Allergy Clin Immunol Pract. 2014;2:353–354. doi: 10.1016/j.jaip.2014.01.017. [PubMed] [CrossRef] [Google Scholar]
10. Wenande E, Garvey LH. Гиперчувствительность немедленного типа к полиэтиленгликолям: обзор. Клин Эксперт Аллергия. 2016; 46: 907–922. doi: 10.1111/cea.12760. [PubMed] [CrossRef] [Google Scholar]
11. Wylon K, Dölle S, Worm M. Полиэтиленгликоль как причина анафилаксии. Аллергия Астма Клин Иммунол. 2016;12:67. doi: 10.1186/s13223-016-0172-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Аллергия Астма Клин Иммунол. 2016;12:67. doi: 10.1186/s13223-016-0172-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Stone CA, Liu Y, Relling MV, Krantz MS, Pratt AL, Abreo A, et al. Немедленная гиперчувствительность к полиэтиленгликолям и полисорбатам: встречается чаще, чем мы предполагали. J Allergy Clin Immunol Pract. 2018;7:1533–1540.e8. doi: 10.1016/j.jaip.2018.12.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Zhou Z-H, Stone CA, Jakubovic B, Phillips EJ, Sussman G, Park J, et al. Анти-ПЭГ IgE при анафилаксии, связанной с полиэтиленгликолем. J Allergy Clin Immunol Pract. 2020 г.: 10.1016/j.jaip.2020.11.011. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Scarbrough Lefebvre CD, Terlinden A, Standaert B. Анализ косвенных эффектов, вызванных вакцинами, на основные элементы. Hum Вакцина Иммунотер. 2015;11:2142–2157. doi: 10.1080/21645515.2015.1052196. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15.
