«Маловесная» проблема с «увесистыми» последствиями
Фото носит иллюстративный характер. Из открытых источников.
Задержка роста плода — осложнение беременности, при котором плод по характеристикам массы и длины отстает от усредненных норм. Маловесным принято считать новорожденного весом 2 500 г, ростом 47 см. Однако это справедливо только при появлении на свет в 37 недель. С увеличением гестационного срока должна расти и масса тела ребенка, достигая к 40 неделям 2 600–2 650 г.
Не факт! Но фактор риска
В период внутриутробного развития плод реализует генетически запрограммированный потенциал роста, который является величиной изменчивой и подверженной влиянию ряда факторов. Наиболее значимые три группы причин задержки роста плода (ЗРП) — материнские, плацентарные и плодовые. При этом плацентарные (инфаркты плаценты, плацентарный мозаицизм, низкая плацентация) и значительная доля материнских (возраст, раса, антропометрические данные и др.
До настоящего времени остается не до конца проясненным вклад каждого фактора риска в формирование гипотрофии плода.
Различают два варианта ЗРП: гипопластический (симметричный) и гипотрофический (ассиметричный). Первый тип дебютирует очень рано — во втором триместре беременности — и проявляется одновременным снижением как длины, так и массы тела плода. При втором, более позднем, варианте, отставание преимущественно массы тела обнаруживается в третьем триместре, ближе к доношенному сроку.
Частота патологии различается в зависимости от региона. В Беларуси, как и в других европейских странах, ЗРП осложняет до 7–14 % беременностей (см. рис. внизу). Учитывая гипердиагностику, гипотрофия новорожденных в республике отмечается примерно в 3,5–4 % от общего числа рождений.
Кажущаяся редкость патологии — лишь вершина айсберга, впечатляют отдаленные последствия для здоровья детей, родившихся маловесными. Суть проблемы не столько в малых размерах новорожденного, сколько в сопутствующем нарушении тонких механизмов регуляции функций органов и систем такого ребенка. Наличие задержки роста плода определяет высокую неонатальную заболеваемость — в 8 раз выше, чем у новорожденных с нормальной массой тела. Часто встречаются осложнения со стороны ЦНС, а в недалеком будущем таких детей весьма вероятно поджидают артериальная гипертензия, метаболический синдром, заболевания эндокринной системы.
Суть проблемы не столько в малых размерах новорожденного, сколько в сопутствующем нарушении тонких механизмов регуляции функций органов и систем такого ребенка. Наличие задержки роста плода определяет высокую неонатальную заболеваемость — в 8 раз выше, чем у новорожденных с нормальной массой тела. Часто встречаются осложнения со стороны ЦНС, а в недалеком будущем таких детей весьма вероятно поджидают артериальная гипертензия, метаболический синдром, заболевания эндокринной системы.
Диагностическая дилемма
Оценивать параметры «внутриутробного пациента» удобнее с помощью УЗИ. В доультразвуковую эпоху акушерам приходилось проявлять недюжинную интуицию и клиническое мышление, чтобы, замеряя высоту дна матки и окружность живота сантиметровой лентой, заподозрить наличие этого грозного осложнения беременности. Однако и с повсеместным внедрением УЗД проблема своевременной диагностики ЗРП не была решена. Систематический обзор в отчете Cochrane 2000 года показал, что рутинное проведение фетометрии после 24 недель у беременных в группе низкого риска не улучшает перинатальные исходы.
Не оправдывает себя и применение различных биохимических и иммунологических маркеров — интерлейкинов, С-реактивного белка, мочевой кислоты и других. Изолированное их применение с прогностической целью выявило низкие показатели чувствительности и специфичности и в настоящее время остается прерогативой сугубо научных изысканий.
Одним из решений проблемы своевременной диагностики и наблюдения беременных с гипотрофией плода может стать применение разработанного нами дифференцированного подхода к тактике ведения беременности и родоразрешению (Инструкция по применению № 033-0515, утвержденная Минздравом 18.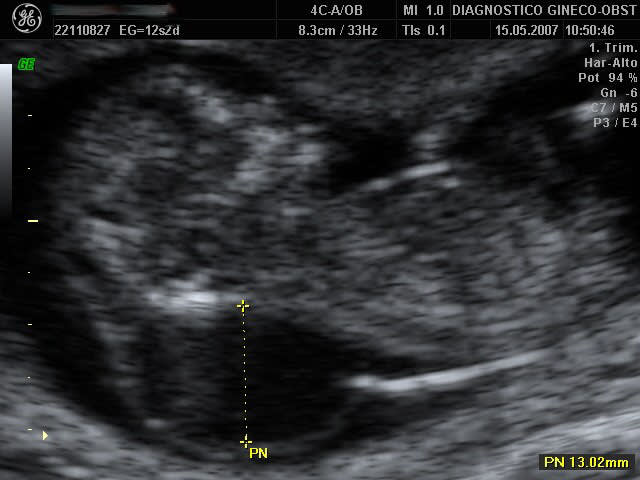
Данный подход подразумевает учет факторов риска формирования патологии и регламентирует кратность и объем диагностических мероприятий при подозрении на наличие гипотрофии плода.
Егор Ковалев, врач-акушер-гинеколог, ассистент кафедры акушерства и гинекологии ВГМУ, кандидат мед. наук.
Источник: medvestnik.by
Задержка роста и гипотрофия плода при многоплодной беременности
Несмотря на многочисленные исследования, направленные на совершенствование диагностики, тактики ведения беременности и родов, пациентки с многоплодной беременностью продолжают представлять группу высокого риска развития перинатальных осложнений, что вызывает постоянный научный и практический интерес [1]. Поскольку эволюционно организм женщины приспособлен для вынашивания одного плода, многоплодная беременность — это классическая модель фетоплацентарной недостаточности [2].
Цель исследования — выявление частоты случаев задержки роста и гипотрофии плода при многоплодной беременности с целью своевременной профилактики перинатальных потерь.
Материал и методы
В исследование были включены 202 беременные женщины, из которых были сформированы две клинические группы: 1-ю (основную) группу составила 51 беременная с многоплодием, наступившим после экстракорпорального оплодотворения (ЭКО) и переноса эмбриона; 2-ю группу (сравнения) — 151 женщина со спонтанно наступившей беременностью двойней.
Морфогистологическое исследование плаценты включало органо-, макро- и гистометрию. Первым этапом исследования плаценты явилось определение органометрических показателей.
При органометрии плаценты производили определение ее массы путем взвешивания без оболочек, с культей пуповины не более 1 см. Объем измеряли по вытесненной воде в мерном цилиндре. Площадь ее определяли по контуру отпечатка материнской поверхности с помощью миллиметровой бумаги. Высчитывали плацентарно-плодовый коэффициент (ППК) — отношение массы плаценты к массе плода.
При макрометрии плаценты визуально оценивали ткань свежей плаценты, определяли процентное соотношение видимых нерабочих зон, т. е. инфарктов, кровоизлияний или кист, известковых отложений по отношению к нормальной ткани плаценты.
е. инфарктов, кровоизлияний или кист, известковых отложений по отношению к нормальной ткани плаценты.
С целью гистометрии взятие кусочков плаценты производили по следующей схеме: в случайном порядке через всю ее толщину брали по два образца ткани размером 1,5×0,8 см из центральной, парацентральной и краевой зон таким образом, чтобы в одном из них обязательно были хориальная пластинка, слой ворсинчатого хориона и материнская поверхность. Фиксацию проводили в 10% водном растворе формалина. Потом образцы проводили по общепринятым методикам с последующей заливкой в парафин. Гистологические срезы окрашивали гематоксилином и эозином.
Статистическую обработку данных осуществляли с помощью программы Statistiсa 6.0 с применением основных методов описательной статистики. Статистические гипотезы проверяли путем выявления различий между сравниваемыми группами с применением критерия Стьюдента, точного критерия Фишера, критерия χ
Результаты и обсуждение
В группе женщин с индуцированным многоплодием в 32—34 нед беременности при ультразвуковом исследовании (УЗИ) выявлена задержка роста плодов (ЗРП) в 29,4% (15) случаев, а гипотрофия новорожденных отмечена в 19,6% (22) наблюдений, из них I степени — в 72,7% (16) и II степени — в 13,6% (3), III степени — в 13,6% (3) случаев. При трихориальной триамниотической тройне среди 30 новорожденных ЗРП выявлена в 26,7% (8) случаев, среди 64 детей при дихориальной двойне — в 17,2% (11), а среди 18 новорожденных при монохориальной двойне — в 16,7% (3) случаев. У этих женщин течение беременности осложнялось угрозой прерывания беременности в 27,5% (15), анемией — в 13,7% (7), преэклампсией — в 17,6% (9) случаев.
При УЗИ была диагностирована ЗРП плодов у беременных группы сравнения (спонтанное многоплодие) в 28,5% (43) случаев. Гипотрофия новорожденных в этой группе наблюдалась в 25,2% (76) случаев, причем I степени — в 68,4% (52), II степени — в 22,4% (17) и III — в 9,2% (7) случаев.
При дихориальном типе плацентации среди 162 новорожденных группы сравнения ЗРП различной степени тяжести выявлена в 25,9% (42) случаев. При монохориальном типе из 140 новорожденных данное осложнение имелось в 24,3% (34) случаев (р>0,05).
В обеих группах с многоплодием гипотрофия плода, как правило, носила асимметричный характер и была диагностирована по данным УЗИ. Лишь в нескольких случаях была диагностирована симметричная (гипопластическая) ЗРП. У этих пациенток беременность также протекала на фоне угрозы прерывания в 23,2% (35), преэклампсии — в 13,9% (21), анемии — в 12,6% (19), в 10,6% (16) случаев во время беременности было диагностировано диссоциированное развитие плодов.
В основной группе при индуцированном многоплодии в 32—33 нед беременности было выявлено диссоциированное развитие плодов в 29,4% (15) случаев и встречалось при трихориальной триамниотической тройне у 4 обследуемых из 10, при монохориальном типе плацентации у 3 из 9, при дихориальном типе плацентации из 32 случаев в 8 (25%).![]() Разница в массе тела новорожденных составляла при монохориальной двойне от 580 до 1200 г, а при трихориальной триамниотической тройне — от 550 до 1300 г. При осложненном течении беременности с ростом гестационного срока степень диссоциации плодов увеличивалась.
Разница в массе тела новорожденных составляла при монохориальной двойне от 580 до 1200 г, а при трихориальной триамниотической тройне — от 550 до 1300 г. При осложненном течении беременности с ростом гестационного срока степень диссоциации плодов увеличивалась.
В группе сравнения диссоциированное развитие плодов выявлено также в 32—33 нед в 18,5% (28) случаев, из них при дихориальном типе плацентации в 15 (18,5%) из 81 наблюдения, при монохориальном из 70 наблюдений — у 13 (18,6%) обследуемых.
Оценить степень и характер плацентарных нарушений невозможно без анализа гистоморфологических данных. Исследованы плаценты, полученные в результате преждевременных родов в сроки 33,7±2,6 нед в основной группе при индуцированном многоплодии и в группе сравнения при преждевременных родах в сроки 35,1±1,1 нед.
Органометрические показатели плацент (масса плаценты, ее объем и площадь, плацентарно-плодовый коэффициент) у пациенток обследуемых групп находились в пределах нормы. Масса плаценты при дихориальном типе плацентации в основной группе составила 417,6±192,1 г, в группе сравнения — 356,6±99,2 г, площадь материнской поверхности — 472,0±93,5 и 390,3±21,9 см2 соответственно. При монохориальном типе плацентации масса плаценты была одинаковой в обеих группах — 703,1±145,6 г.
Масса плаценты при дихориальном типе плацентации в основной группе составила 417,6±192,1 г, в группе сравнения — 356,6±99,2 г, площадь материнской поверхности — 472,0±93,5 и 390,3±21,9 см2 соответственно. При монохориальном типе плацентации масса плаценты была одинаковой в обеих группах — 703,1±145,6 г.
Масса, площадь материнской поверхности плацент в основной группе и группе сравнения не имели статистически достоверных различий. Плаценты с такими параметрами способны полностью обеспечить внутриутробное развитие плода.
Главной особенностью гистологического строения плацент было наличие неравномерного созревания отдельных котиледонов. Наряду с нормальными, хорошо васкуляризированными ворсинами, встречались хаотичные зоны склерозированных ворсин с малым количеством капилляров. Относительная незрелость ворсинчатого дерева выражалась в двух формах: преждевременном созревании ворсин и диссоциированном их развитии.
Нарушение созревания ворсин отмечено в 13,7% (7) случаев в основной и 5,96% (9) в группе сравнения. Нарушение созревания ворсин диагностировано у пациенток с экстрагенитальной патологией, с осложненным течением беременности (угроза прерывания беременности, преэклампсия, анемия).
Нарушение созревания ворсин диагностировано у пациенток с экстрагенитальной патологией, с осложненным течением беременности (угроза прерывания беременности, преэклампсия, анемия).
Преждевременное созревание ворсин диагностировали при невынашивании беременности, когда в плаценте в гестационные сроки 32—33 нед доминировали терминальные ворсины с узкими капиллярами, не формирующими синцитиокапиллярные мембраны. Диссоциированное развитие ворсин имелось только при многоплодной беременности: в основной группе — у 5 (13,9%) пациенток, в группе сравнения — у 9 (9,4%) и проявлялось в распространенном сочетании котиледонов с персистенцией тех или иных типов незрелых ворсин с участками зрелого строения.
Анализ течения беременности у этих пациенток выявил наличие большого числа осложнений во всех триместрах: угроза прерывания, преэклампсия, анемии, соматические заболевания. Возраст этих женщин колебался от 31 года до 38 лет. У каждой был отягощен акушерско-гинекологический анамнез наличием медицинских и самопроизвольных абортов, хронических воспалительных заболеваний органов малого таза, миомы матки.
В исследуемых плацентах в 27,8% (10) наблюдений в основной группе и в 14,6% (14) наблюдений в группе сравнения отмечались признаки воспаления (децидуит, виллузит, хориоамнионит). У этих пациенток в анамнезе и во время беременности диагностировались инфекции, передаваемые половым путем, сифилис, заболевания мочеполовой системы: гестационные и хронические пиелонефриты, мочекаменная болезнь. В родах отмечались дородовое излитие околоплодных вод, слабость родовой деятельности, фетоплацентарная недостаточность, внутриутробное инфицирование плодов.
Таким образом, результаты проведенного исследования показывают, что при многоплодной беременности как индуцированной, так и спонтанно наступившей, определяется высокая частота задержки роста диссоциированного развития плодов, гипотрофии новорожденных, что обусловлено в большой степени неравномерным созреванием и диссоциированным развитием ворсин. Все перечисленное свидетельствует о необходимости проведения мероприятий по профилактике перинатальных потерь при многоплодной беременности. Проведение прегравидарной подготовки, предупреждение многоплодной беременности в программе ЭКО, ранняя диагностика многоплодной беременности и предупреждение ее осложнений, выбор рационального метода родоразрешения с учетом гестационного срока являются важным резервом в снижении перинатальной и материнской заболеваемости и смертности.
Проведение прегравидарной подготовки, предупреждение многоплодной беременности в программе ЭКО, ранняя диагностика многоплодной беременности и предупреждение ее осложнений, выбор рационального метода родоразрешения с учетом гестационного срока являются важным резервом в снижении перинатальной и материнской заболеваемости и смертности.
1. В результате проведенного исследования установлено, что при многоплодной беременности как индуцированной, так и спонтанно наступившей определяется высокая частота задержки роста плодов, диссоциированного развития плодов и гипотрофии новорожденных.
2. Особенностью гистологического строения плаценты (плацент) при многоплодной беременности является неравномерное созревание отдельных котиледонов, обусловленное как преждевременным созреванием ворсин, так и диссоциированным их развитием, что лежит в основе фетоплацентарной недостаточности.
3. Мероприятиями по профилактике перинатальных потерь при многоплодной беременности могут служить следующие: проведение прегравидарной подготовки, предупреждение многоплодия при использовании программ экстракорпорального оплодотворения, ранняя диагностика многоплодной беременности и предупреждение ее осложнений, выбор рационального метода родоразрешения с учетом срока беременности.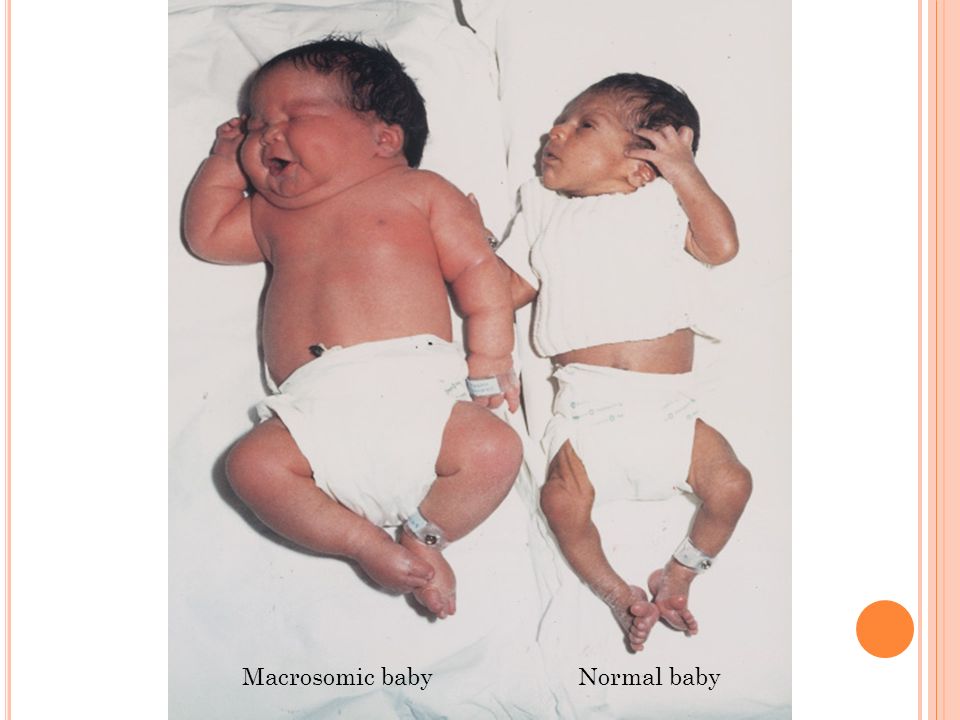
Гипотрофия плода
Гипотрофия плода – это несоответствие физических параметров плода сроку беременности. Другими словами, плод по каким-либо характеристикам отстает в развитии. Существует также другое название – синдром задержки внутриутробного развития, в любом случае данное состояние требует тщательной диагностики и лечения.
Виды гипотрофии плода
Медики выделяют два вида гипотрофии плода – симметричную и ассиметричную. В первом случае патология наблюдается на ранних сроках беременности. Симметричная гипотрофия выражается в том, что все органы плода равномерно меньше размеров, положенных для данного срока.
Ассиметричная гипотрофия плода это состояние, при котором в развитии отстают только некоторые органы. Как правило, данная форма патологии наблюдается в третьем триместре. Так, например, голова, тело и конечности ребенка развиты нормально, тогда как внутренние органы (почки, печень) меньше нормального размера.
Помимо двух видов различают гипотрофию первой степени, второй и третьей. В первом случает отставание в развитии не превышает двух недель. Стоит отметить, что диагноз задержки внутриутробного развития первой степени, как правило, после родов не подтверждается, что связано с генетическими особенностями родителей или неточно установленном сроке беременности.
В первом случает отставание в развитии не превышает двух недель. Стоит отметить, что диагноз задержки внутриутробного развития первой степени, как правило, после родов не подтверждается, что связано с генетическими особенностями родителей или неточно установленном сроке беременности.
Гипотрофия плода 2 степени – это задержка развития в 2 — 4 недели. Данное состояние уже никак не может быть ошибкой, а тем более нормой, поэтому требует постоянного наблюдения и стационарного лечения. Гипотрофия третьей степени – это запущенное и опасное состояние, при котором плод практически полностью истощен.
Причины гипотрофии плода
Внутриутробная гипотрофия плода может быть вызвана несколькими причинами, при этом природа факторов также бывает разнообразна. Патология часто появляется по вине матери, которая ведет неправильный образ жизни: употребляет алкоголь, курит, мало питается. Также причинами могут быть инфекционные заболевания, болезни сердца, почек, эндокринной системы.
Среди других факторов, вызывающих гипотрофию, можно отметить патологии плаценты: отслойку, травмы, воспаления, неправильное расположение. Кроме того, задержку внутриутробного развития вызывает многоплодная беременность и инфекционные заболевания плода.
Кроме того, задержку внутриутробного развития вызывает многоплодная беременность и инфекционные заболевания плода.
Признаки гипотрофии плода
Симметричная гипотрофия возникает на ранних сроках беременности, тогда как ассиметричная задержка развития появляется только после 27 — 28 недели. Обнаружить гипотрофию сможет врач-гинеколог при внешнем осмотре, для чего измеряется окружность живота, а также высота дна матки.
Для подтверждения диагноза беременная должна пройти УЗИ, на котором более точно можно установить вид и стадию гипотрофии. Стоит отметить, что регулярные осмотры и своевременное обращение в женскую консультацию помогут выявить или даже предотвратить развитие задержки внутриутробного развития плода.
Лечение и последствия гипотрофии плода
Стоит отметить, что гипотрофия первой стадии практически не опасна для малыша. В то время как задержка развития второй и третьей стадии являются тяжелыми заболеваниями, плохо поддающимися лечению. Как правило, женщину помещают в стационар, где проводят лечение, направленное на устранение причины заболевания.
Гипотрофию в любом ее виде легче предупредить, чем лечить. Во время планирования беременности необходимо обследоваться на предмет возможных инфекций, а также пройти профилактическое лечение хронических заболеваний. Кроме того, женщина должна отказаться от вредных привычек и внимательно следить за рационом своего питания.
Гипотрофия плода: при беременности, что это такое, внутриутробная 1 и 2 степени, лечение асимметричной
Беременность – это счастливые девять месяцев ожидания ребенка. В это время родители ожидают появления маленького чуда. Однако вместе с радостью будущего материнства, приходит и большая ответственность. Ведь не всегда беременность протекает беспроблемно. Нередко возникают какие-нибудь осложнения. Это могут быть как неприятности со здоровьем женщины, так и проблема развития малыша. Сегодня мы расскажем вам о такой патологии, как гипотрофия плода, и научим, как предотвратить ее возникновение.
- Описание: что такое гипотрофия плода и какие виды этого состояния существуют
- Причины гипотрофии плода при беременности
- Последствия и лечение гипотрофии
- Профилактика внутриутробной гипотрофии плода
- Ассиметричная гипотрофия плода (видео)
Описание: что такое гипотрофия плода и какие виды этого состояния существуют
Гипотрофия плода – это внутриутробная задержка роста ребенка. То есть, при таком состоянии, малыш отстает в своем росте на несколько недель. Такое состояние говорит о некоторых проблемах и подлежит правильному лечению.
То есть, при таком состоянии, малыш отстает в своем росте на несколько недель. Такое состояние говорит о некоторых проблемах и подлежит правильному лечению.
Также известно такое состояние как гипертрофия. В этом случае плод опережает норму роста на несколько недель. Это состояние опасно тем, что может стать причиной преждевременных родов.
Выявить гипотрофию плода по каких-либо сопутствующим симптомам нельзя. Это состояние выявляется обычно при плановом обследовании у гинеколога, который при измерении живота, замечает что за несколько недель он не подрос, и отправляет будущую мамочку на УЗИ. Также часто выявляют эту проблему при плановом обследовании УЗИ.
В зависимости от степени запущенности этого состояния, выделяют три степени гипотрофии. Давайте с ними ознакомимся.
Степени гипотрофии:
- Первая степень гипотрофии редко связанна с какими-либо нарушениями. В этом случае малыш отстает в развитии не более, чем на две недели.
 При рождении обычно этот диагноз не подтверждается.
При рождении обычно этот диагноз не подтверждается. - Вторую стадию гипотрофии ставят, когда задержка роста более двух недель, но менее четырех. Это состояние более опасно, и требует немедленного лечения.
- Третья стадия подразумевает задержку более месяца. В этом случае самостоятельные роды не возможны, и требуется кесарево сечение.
Гипотрофия плода опасна, если выявлена вторая или третья степень. В этом случае возможны некоторые проблемы у родившегося малыша.
Также стоит отметить, что существует два вида гипотрофии плода. Давайте подробнее рассмотрим каждую из них.
Типы внутриутробной гипотрофии:
- Симметричная гипотрофия ставится тогда, когда все части тела плода равномерно имеют меньшие размеры, чем положено на данном сроке. Такая проблема начинает развиваться на ранних сроках. Однако заметить ее удается не сразу.
- Асимметричная форма гипотрофии ставится, когда часть органов и частей тела соответствует размером норме для своего срока, а часть отстает.
 Обычно отстают в развитии органы брюшной полости. Развивается проблема примерно с 28 неделе.
Обычно отстают в развитии органы брюшной полости. Развивается проблема примерно с 28 неделе.
Данные проблемы обычно удается заметить лишь в третьем триместре. Поэтому очень важно регулярно посещать, ведущего вашу беременность врача.
Причины гипотрофии плода при беременности
Гипотрофичный синдром – это не самое приятное, что может случиться с плодом. Дело в том, что такое состояние, если его вовремя не устранить, может привести к дальнейшим проблемам внутренних органов и даже задержке умственного и психо-эмоционального развития. Однако это случается далеко не всегда.
Иногда, диагноз гипотрофия является ошибочным. Обычно это происходит, если женщина на протяжении беременности посещает разных гинекологов, у каждого из которых свой подход к ведению беременности. Поэтому очень важно выбрать для себя одного специалиста.
К сожалению, гипотрофия плода ставится немалому количеству беременных женщин. Все дело в причинах ее возникновению. Ведь с ними сталкивается большинство женщин.
Ведь с ними сталкивается большинство женщин.
Причины развития гипотрофии плода:
- Негативные факторы, в виде вредных привычек матери. К ним относятся: курение, употребление алкоголя и наркотических веществ.
- Взаимодействие женщины в период беременности с различными химическими веществами. Сюда относится, например, вдыхание паров жидкости для снятия лака или краски.
- Различные патологии плаценты. Например, недостаточное снабжение ее кислородом или раннее старение.
- Различные патологии в развитии плода. Например, изменение количества хромосом в ту или иную сторону, или развитие наследственных патологий.
- Попадание инфекции в половые пути. Самым ярким примером является токсоплазмоз и молочница.
- Различные сбои в продуцировании организмом гормонов.
- Другие осложнения во время течения беременности. Например, различные образования матки.
Данные факторы вызывающие гипотрофию плода, в большинстве своем можно устранить. В этом случае беременность протечет гладко.
В этом случае беременность протечет гладко.
Последствия и лечение гипотрофии
Многих мам, столкнувшихся с такой проблемой, интересуют ее последствия для малыша. При правильном и своевременном лечении у новорожденных не будет существенных отклонений, однако это при условии, что данная проблема не была вызвана серьезными изменениями при развитии плода.
В большинстве случаев, рожденные с гипотрофией дети, уже к двум годам догоняют по росту своих ровесников. Однако отмечается, что они имеют ослабленный иммунитет, а потому часто болеют, а также страдают недостатком концентрации внимания и проблемами с усидчивостью. Однако при грамотном и постоянном воспитании, этот недостаток быстро купируется.
Однако если не предоставить матери своевременное лечение, то возможны более серьезные последствия. Они могут быть выражены в виде врожденных пороков внутренних органах, а также проявляться задержкой в психическом и умственном развитии. Поэтому так важно не пропускать плановые осмотры у гинеколога.
Лечение гипотрофии основано на выяснение причины этой проблемы. В зависимости от этого могут применяться разные методы.
Методы лечения гипотрофии плода:
- Наиболее часто корректируется рацион женщины. Иногда требуется увеличение количества потребляемых калорий, а иногда введение в рацион большего количества белков и витаминов.
- Для улучшения кровообращения в плаценте, назначаются сосудосуживающие препараты.
- Могут понадобится токолитики. Они расслабляют матку.
- Также подобное состояние нередко становится последствием гипоксии. В этом случае нужны препараты, нормализующие поступление кислорода к плоду.
Лечение гипотрофии – это достаточно длительный процесс. Однако в большинстве случаев он дает хорошие результаты.
Профилактика внутриутробной гипотрофии плода
Гипотрофия плода даже при своевременном лечение может оказать негативное влияние на дальнейшее развитие новорожденного. Поэтому такое состояние лучше не допускать. Для этого нужно знать правила профилактики.
Для этого нужно знать правила профилактики.
Профилактика гипотрофии плода:
- Лучше перед зачатием ребенка, или на ранних сроках беременности пройдите полноценное обследование. Вылечите зубы, а также мочеполовую систему и другие инфекционные заболевания.
- Откажитесь от курения и употребления алкоголя. Побольше времени проводите на свежем воздухе.
- Спите не менее восьми часов в с сутки. При этом лучше, если вы еще два часа будете досыпать днем.
- Следите за своим рационом. В нем должно быть достаточно витаминов, минералов и белков.
Такие правила помогут вам избежать возникновения многих проблем в период беременности. Поэтому обязательно следуйте им.
Ассиметричная гипотрофия плода (видео)
Внутриутробная гипотрофия – это серьезная проблема в развитии ребенка. Чтобы не возникло серьезных последствий, ее нужно обязательно устранить. Поэтому не пренебрегайте плановыми осмотрами и пусть ваши детки будут здоровы!
Поэтому не пренебрегайте плановыми осмотрами и пусть ваши детки будут здоровы!
диагностика и оптимальный метод родоразрешения » Акушерство и Гинекология
Цель исследования. Оценка эффективности современных диагностических методов исследования и выбора метода родоразрешения в зависимости от степени выраженности задержки внутриутробного развития плода (ЗВРП). Материал и методы. Проведен ретроспективный анализ 410 случаев доношенной беременности по данным медицинской документации, включающей анамнез, результаты динамического наблюдения, УЗИ, допплерометрию, сведения о состоянии новорожденных. Выделены 3 основные группы в зависимости от степени ЗВРП (310 женщин). Группа сравнения — 50 женщин с конституциональной гипотрофией и массой плода менее 2800 г. Контрольная группа ‒ 50 женщин с массой плода более 2800 г. Каждая из групп была разделена на подгруппы в зависимости от способа родоразрешения: через естественные родовые пути и методом кесарева сечения.Кишиневский государственный университет медицины и фармации им. Н. Тестемицану, Республика Молдова
 Результаты исследования. Диагноз гипотрофии плода был установлен с помощью УЗИ в 74,44% случаев. При ЗВРП предполагаемая масса плода находилась ниже 10-й перцентили в 187 (60,32%) случаях, окружность живота ‒ в 51,61%, длина бедра ‒ в 50,32%, бипариетальный диаметр ‒ в 48,06%, а окружность головки ‒ в 41,61% случаев. Параллельно прогрессированию патологического процесса было выявлено повышение индексов резистентности и пульсатильности, что имело место в 83,8% случаев при III степени ЗВРП. В 168 (54,2%) случаях ЗВРП патологические значения индексов при допплерометрии позволили определить внутриутробное страдание плода, что диктовало необходимость срочного родоразрешения путем кесарева сечения. Уровень перинатальной смертности при родах через естественные родовые пути составил 48,8‰ (8 случаев). После кесарева сечения не зарегистрировано ни одного случая смерти новорожденного. Были отмечены различия в уровне заболеваемости детей, рожденных через естественные родовые пути (86,7%) и с помощью кесарева сечения (44,7%) (рКлючевые слова
Результаты исследования. Диагноз гипотрофии плода был установлен с помощью УЗИ в 74,44% случаев. При ЗВРП предполагаемая масса плода находилась ниже 10-й перцентили в 187 (60,32%) случаях, окружность живота ‒ в 51,61%, длина бедра ‒ в 50,32%, бипариетальный диаметр ‒ в 48,06%, а окружность головки ‒ в 41,61% случаев. Параллельно прогрессированию патологического процесса было выявлено повышение индексов резистентности и пульсатильности, что имело место в 83,8% случаев при III степени ЗВРП. В 168 (54,2%) случаях ЗВРП патологические значения индексов при допплерометрии позволили определить внутриутробное страдание плода, что диктовало необходимость срочного родоразрешения путем кесарева сечения. Уровень перинатальной смертности при родах через естественные родовые пути составил 48,8‰ (8 случаев). После кесарева сечения не зарегистрировано ни одного случая смерти новорожденного. Были отмечены различия в уровне заболеваемости детей, рожденных через естественные родовые пути (86,7%) и с помощью кесарева сечения (44,7%) (рКлючевые словазадержка внутриутробного развития плода
ультразвуковое исследование
биометрические параметры плода
допплерометрия
1. Демидов В.Н., Розенфельд Б.Е., Сигизбаева И.К. Значение одновременного использования автоматизированной кардиотокографии и ультразвуковой допплерометрии для оценки состояния плода во время беременности//SonoAce-Ultrasound. – 2001. ‒ № 9. ‒ С. 73‒80.
Демидов В.Н., Розенфельд Б.Е., Сигизбаева И.К. Значение одновременного использования автоматизированной кардиотокографии и ультразвуковой допплерометрии для оценки состояния плода во время беременности//SonoAce-Ultrasound. – 2001. ‒ № 9. ‒ С. 73‒80.
2. Миколайович Я. Затримка розвитку плода (Патогенез, прогнозування, профшактика i лжування): Автореф. дис. …д-ра. мед. наук. ‒ Киiв, 2002.
3. Пчелинцев В.В., Сидоров А.В. Особенности состояния здоровья женщин, родоразрешившихся плодом с внутриутробной задержкой развития // Материалы V Рос. форума «Мать и дитя»: Тезисы докл. ‒ М., 2003. ‒ С. 179‒180.
4. Стрижаков А.Н. Внутриутробная задержка развития плода (СЗРП) //Материалы V Рос. форума «Мать и дитя»: Тезисы докл. — М., 2003. – С. 44‒45
5. Brodsky H. Current concepts in intrauterine growth restriction //Obstet. and Gynec. ACOG. – 2000. – Vol. 19, № 6. ‒P. 307.
6. Carbillon L. Diagnostic du retard de croissance intra-uterine//J.Réalit. Gynécol. Obstét. ‒ 2006. – Vol. 92. ‒ P. 32‒38.
‒ P. 32‒38.
7. Carbonne ., Cynober E. Indications et résultats du Doppler cérébral foetal // J. Réalit. Gynéc.-Obstét. ‒ 2006. – Vol. 107. ‒ P. 11‒14.
8. Cuttini M., Cortinovis I., Bossi A. et al. Proportionality of small for gestational age babies as a predictor of neonatal mortality and morbidity// Paediatr. Perinat. Epidemiol. – 2001. ‒ Vol. 5. — P. 56‒63.
9. Daikoku N.H., Johnson J.W., Graf G. et al. patterns of intrauterine growth retardation// Obstet. and Gynecol. ACOG. ‒ 2005. ‒ Vol. 54, № 2. ‒ P. 211.
10. Divon M.Y., Hsu H.W. Maternal and fetal blood flow velocity waveforms in intrauterine growth retardation// Clin. Obstet. Gynecol. – 2002. ‒ Vol. 35. ‒ P. 156‒171.
11. Fraser A.M., Broken J.E., Ward R.H. Association of young maternal age with adverse reproductive outcomes //N. Engl. J. Med. – 1995. ‒ Vol. 332. ‒ P. 1113‒1117.
12. Lin C.C., Santolaya-Forgas J. Current concepts of fetal growth restriction: Causes, classification, and pathophysiology//Obstet.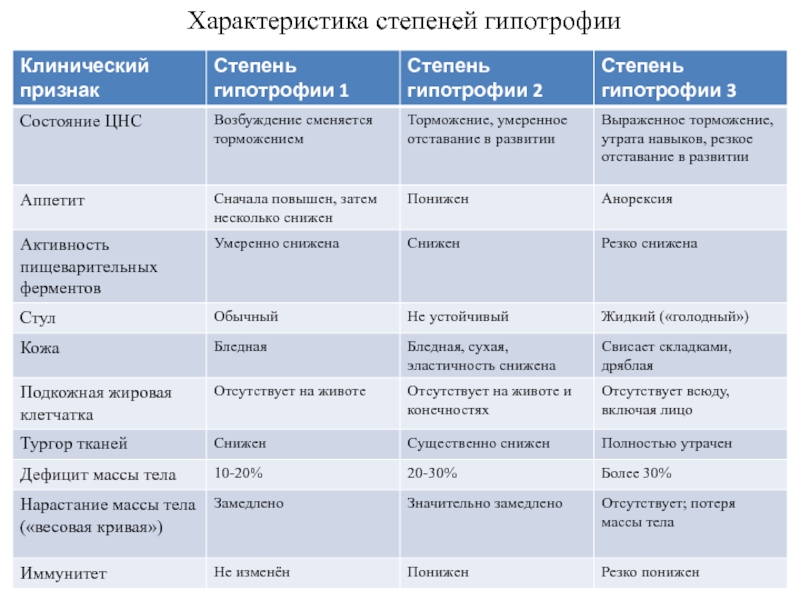 and Gynecol. ACOG. – 2000. – Vol. 19, № 6. ‒ P. 310.
and Gynecol. ACOG. – 2000. – Vol. 19, № 6. ‒ P. 310.
13. Ott W.J., Doyle S. Ultrasonic diagnosis of altered fetal growth by use of a normal ultrasonic fetal weight curve// Obstet. and Gynecol. – 2002. ‒ Vol. 78. ‒ P. 582.
14. Seeds J.W. Impaired fetal growth: ultrasonic evaluation and clinical management// Obstet. and Gynecol. ACOG. – 2005. ‒ Vol. 64, № 4. ‒ P. 577.
15. Uzan M. Examen Doppler en cas du retard de croissance intrauterine// J.Réalit. en Gynécol.-Obstét. – 2006. ‒ Vol. 9. ‒ P. 83‒96.
Адрес: Республика Молдова, г. Кишинев, ул. Буребиста, д. 20
E-mail: [email protected]
Чем опасна гипотрофия плода и как… — Hochu-detey.ru — для тех, кто хочет забеременеть
Чем опасна гипотрофия плода и как избежать ее появления
http://hochu-detey.ru/conception/main/chem-opasna-gipotrofiya-ploda.html
Гипотрофия плода при беременности или СЗРП является распространенной патологией. Такой диагноз чаще проявляется в третьем триместре. В этой статье мы рассмотрим основные причины патологии, ее диагностику и методы лечения. Вконтакте Facebook Twitter Google+ Мой мир Оглавление: Гипотрофия плода — что это такое Классификация Причины гипотрофии и ее последствия Диагностика патологии Профилактика Лечение гипотрофии плода Гипотрофия плода — что это такое Чем опасна гипотрофия плода? Тем, что это замедление внутриутробного роста малыша. Его размер меньше, чем должен быть на определенной стадии беременности, развитие отстает более чем на четырнадцать дней. Плод чувствует беспрерывное кислородное голодание, из-за чего приостанавливается метаболический процесс, именно он обеспечивает нормальный рост ребенка. Классификация Исходя из критериев, различают две формы гипотрофии: Симметричная форма — органы пропорционально задерживают свой рост. Асимметричная форма — мозг и скелет растут нормально, а внутренние органы замедлили свой рост. Любую из этих форм гипотрофии плода можно наблюдать на 33 неделе беременности.
Такой диагноз чаще проявляется в третьем триместре. В этой статье мы рассмотрим основные причины патологии, ее диагностику и методы лечения. Вконтакте Facebook Twitter Google+ Мой мир Оглавление: Гипотрофия плода — что это такое Классификация Причины гипотрофии и ее последствия Диагностика патологии Профилактика Лечение гипотрофии плода Гипотрофия плода — что это такое Чем опасна гипотрофия плода? Тем, что это замедление внутриутробного роста малыша. Его размер меньше, чем должен быть на определенной стадии беременности, развитие отстает более чем на четырнадцать дней. Плод чувствует беспрерывное кислородное голодание, из-за чего приостанавливается метаболический процесс, именно он обеспечивает нормальный рост ребенка. Классификация Исходя из критериев, различают две формы гипотрофии: Симметричная форма — органы пропорционально задерживают свой рост. Асимметричная форма — мозг и скелет растут нормально, а внутренние органы замедлили свой рост. Любую из этих форм гипотрофии плода можно наблюдать на 33 неделе беременности. В свою очередь, существуют три стадии: Гипотрофия плода 1 степени — рост малыша отстает сроком до 2-х недель. Она является самой легкой и, как правило, после родов не подтверждается. Основной причиной ошибочного подтверждения может стать неправильно определенная длительность беременности. Гипотрофия плода 2 степени — замедление роста составляет от 2-х до 4-х недель. Данная стадия может спровоцировать гипоксию, при этом нарушается питание плода и обеспечение его кислородом. Гипотрофия плода 3 степени — замедление в росте составляет больше 1-ого месяца. Самая опасная стадия. Учитывая, что плод сильно изнеможен, это может являться источником его гибели. Она встречается довольно редко, основной причиной является позднее определение патологии. После родов первая стадия обычно не оставляет никаких последствий, в отличие от второй и третьей стадии, именно они могут сказаться на физическом и психологическом развитии малыша. Причины гипотрофии и ее последствия Существует множество провоцирующих факторов для прогрессирования данного диагноза.
В свою очередь, существуют три стадии: Гипотрофия плода 1 степени — рост малыша отстает сроком до 2-х недель. Она является самой легкой и, как правило, после родов не подтверждается. Основной причиной ошибочного подтверждения может стать неправильно определенная длительность беременности. Гипотрофия плода 2 степени — замедление роста составляет от 2-х до 4-х недель. Данная стадия может спровоцировать гипоксию, при этом нарушается питание плода и обеспечение его кислородом. Гипотрофия плода 3 степени — замедление в росте составляет больше 1-ого месяца. Самая опасная стадия. Учитывая, что плод сильно изнеможен, это может являться источником его гибели. Она встречается довольно редко, основной причиной является позднее определение патологии. После родов первая стадия обычно не оставляет никаких последствий, в отличие от второй и третьей стадии, именно они могут сказаться на физическом и психологическом развитии малыша. Причины гипотрофии и ее последствия Существует множество провоцирующих факторов для прогрессирования данного диагноза. Основными причинами гипотрофии плода являются: плохое и нестабильное питание; курение, распитие алкоголя, наркотики; постоянные стрессы; поздний токсикоз; сахарный диабет; прием лекарственных препаратов; многоплодие; старение плаценты; хромосомное отклонение; очень поздняя или ранняя беременность; обвитие пуповиной; режим работы будущей матери; инфекционные болезни мочеполовой системы цистит, токсоплазмоз, хламидиоз и прочее; сердечно-сосудистые заболевания у матери, к ним относятся гипертония, гипотония, ухудшение тонуса мышц, сосудов и прочее. На тяжелых стадиях проводят кесарево сечение, потому как ребенок бессилен и не может самостоятельно появиться на свет. Детки, которые перенесли внутриутробную задержку развития, после родов требуют особого ухода, они очень слабы и велик риск летального исхода. Также есть риск плохого физического или психологического развития ребенка, а именно развитие таких заболеваний: рахит; инфекционные заболевания; обострение невротических реакций; дисгармония пропорций тела поражение центральной нервной системы: паралич, водянка головного мозга, умственная отсталость и прочее.
Основными причинами гипотрофии плода являются: плохое и нестабильное питание; курение, распитие алкоголя, наркотики; постоянные стрессы; поздний токсикоз; сахарный диабет; прием лекарственных препаратов; многоплодие; старение плаценты; хромосомное отклонение; очень поздняя или ранняя беременность; обвитие пуповиной; режим работы будущей матери; инфекционные болезни мочеполовой системы цистит, токсоплазмоз, хламидиоз и прочее; сердечно-сосудистые заболевания у матери, к ним относятся гипертония, гипотония, ухудшение тонуса мышц, сосудов и прочее. На тяжелых стадиях проводят кесарево сечение, потому как ребенок бессилен и не может самостоятельно появиться на свет. Детки, которые перенесли внутриутробную задержку развития, после родов требуют особого ухода, они очень слабы и велик риск летального исхода. Также есть риск плохого физического или психологического развития ребенка, а именно развитие таких заболеваний: рахит; инфекционные заболевания; обострение невротических реакций; дисгармония пропорций тела поражение центральной нервной системы: паралич, водянка головного мозга, умственная отсталость и прочее. Диагностика патологии Самостоятельно определить внутриутробное замедление роста плода сложно, так как у данной патологии нет ярко выраженных симптомов. Лишь посещение гинеколога поможет вовремя определить данный диагноз. Диагностику проводят в два этапа: измерение окружности живота и дна матки; одно из аппаратных исследований: ультразвуковая диагностика исследование плаценты и оценка фетометрических показателей; допплерометрия проводиться для определения состояния пуповины, артерий головного мозга плода, оценка кровотока в маточных сосудах; кардиотокография ультразвуком — анализ частоты сердцебиения плода. Профилактика Перед тем как планировать беременность, надо полностью обследовать организм будущей матери. Если присутствуют хронические болезни, то их следует подлечить, а также исключить вредные привычки, если такие имеются. Ведь здоровый образ жизни и планирование беременности это залог здоровья будущего малыша. Но если так случилось, что беременность пришла внезапно, нужно придерживаться профилактических действий.
Диагностика патологии Самостоятельно определить внутриутробное замедление роста плода сложно, так как у данной патологии нет ярко выраженных симптомов. Лишь посещение гинеколога поможет вовремя определить данный диагноз. Диагностику проводят в два этапа: измерение окружности живота и дна матки; одно из аппаратных исследований: ультразвуковая диагностика исследование плаценты и оценка фетометрических показателей; допплерометрия проводиться для определения состояния пуповины, артерий головного мозга плода, оценка кровотока в маточных сосудах; кардиотокография ультразвуком — анализ частоты сердцебиения плода. Профилактика Перед тем как планировать беременность, надо полностью обследовать организм будущей матери. Если присутствуют хронические болезни, то их следует подлечить, а также исключить вредные привычки, если такие имеются. Ведь здоровый образ жизни и планирование беременности это залог здоровья будущего малыша. Но если так случилось, что беременность пришла внезапно, нужно придерживаться профилактических действий. Правильно и своевременно питаться: Нужно сочетать продукцию из разных пищевых групп: белки, углеводы, жиры, витамины и минералы. Источником белка является: мясо птицы, рыба, кисломолочная продукция. Суточная норма белка при беременности 120–150 г. Количество углеводов должно быть не менее 300 г в день. Потреблять нужно богатые на пищевые волокна углеводы, которые содержатся в хлебобулочных изделиях из цельнозерновой муки, крупах, овощах, ягодах. Средняя суточная норма жиров 80 г, они содержатся в столовых растительных маслах, орехах и жирных сортах рыбы. В течение беременности главным витамином выступает витамин Е, именно он помогает развитию плода. Дневная норма 20–25 мг, он содержится в таких продуктах: печень, нерафинированное масло, гречка, грецкие орехи. Микроэлементы и минеральные компоненты помогают правильному росту плода. К ним принадлежат кальций, фосфор, магний, калий, натрий, железо. Первая тройка содержится в молоке, рыбе, мясе, яйцах, орехах, овощах. Калий и натрий в листьях салата, сушеном винограде, бобах, грибах.
Правильно и своевременно питаться: Нужно сочетать продукцию из разных пищевых групп: белки, углеводы, жиры, витамины и минералы. Источником белка является: мясо птицы, рыба, кисломолочная продукция. Суточная норма белка при беременности 120–150 г. Количество углеводов должно быть не менее 300 г в день. Потреблять нужно богатые на пищевые волокна углеводы, которые содержатся в хлебобулочных изделиях из цельнозерновой муки, крупах, овощах, ягодах. Средняя суточная норма жиров 80 г, они содержатся в столовых растительных маслах, орехах и жирных сортах рыбы. В течение беременности главным витамином выступает витамин Е, именно он помогает развитию плода. Дневная норма 20–25 мг, он содержится в таких продуктах: печень, нерафинированное масло, гречка, грецкие орехи. Микроэлементы и минеральные компоненты помогают правильному росту плода. К ним принадлежат кальций, фосфор, магний, калий, натрий, железо. Первая тройка содержится в молоке, рыбе, мясе, яйцах, орехах, овощах. Калий и натрий в листьях салата, сушеном винограде, бобах, грибах. Железо — в печени, желтке, яблоках. Избегать стрессовых ситуаций. Чаще думайте о хорошем, умейте расслабляться, не сдерживайте эмоций, полноценно отдыхайте и не перенапрягайтесь физически. Хорошим помощником в данном деле будет медитация. Это не только расслабляющие душу и тело занятия, но еще и общение со своим будущим ребенком. Также медитация способствует снижению высокого кровяного давления, улучшает кровообращение, спасает от головной боли, улучшает сон. Рекомендуется проживание в экологически чистой среде, с чистым воздухом и водой, низким уровнем радиации. В данном случае нужно, как минимум избегать токсической среды. Убедитесь в качестве питьевой воды, продуктов, косметических препаратов, чистящих средств. Старайтесь регулярно проводить уборку жилья. Как можно реже пользуйтесь техникой с электромагнитным излучением: телефоном, компьютером, телевизором и прочим. Лечение гипотрофии плода Гипотрофию не лечат, а избавляются от ее первопричины, которой она была спровоцирована. При различных основаниях лечение происходит по-разному.
Железо — в печени, желтке, яблоках. Избегать стрессовых ситуаций. Чаще думайте о хорошем, умейте расслабляться, не сдерживайте эмоций, полноценно отдыхайте и не перенапрягайтесь физически. Хорошим помощником в данном деле будет медитация. Это не только расслабляющие душу и тело занятия, но еще и общение со своим будущим ребенком. Также медитация способствует снижению высокого кровяного давления, улучшает кровообращение, спасает от головной боли, улучшает сон. Рекомендуется проживание в экологически чистой среде, с чистым воздухом и водой, низким уровнем радиации. В данном случае нужно, как минимум избегать токсической среды. Убедитесь в качестве питьевой воды, продуктов, косметических препаратов, чистящих средств. Старайтесь регулярно проводить уборку жилья. Как можно реже пользуйтесь техникой с электромагнитным излучением: телефоном, компьютером, телевизором и прочим. Лечение гипотрофии плода Гипотрофию не лечат, а избавляются от ее первопричины, которой она была спровоцирована. При различных основаниях лечение происходит по-разному. Поэтому устранение патологии для каждой мамочки происходит персонально: Терапия хронических болезней. Необходимо подлечить имеющиеся недуги и сделать это так, чтобы не навредить малышу. Заболевания печени, почек, язвы желудка лечат с помощью применения безопасных препаратов. Лечение печени осуществляется гепатопротекторами: Эссенциале, Карсил, Хофитол. При язве желудка помогут такие препараты: Маалокс, Ренни, Альмагель. Коррекция питания беременной. Пища в данный период обязана быть разнообразной и сбалансированой. Необходимо совершать маленькие перекусы между приемами пищи. Также стоит не забывать об употребление жидкости, не менее двух литров чистой воды в день. Употребление препаратов, которые расслабляют матку. Они уменьшают сократительную активность органа и помогают избежать преждевременных родов. К таким препаратам относятся: Гинипрал, Сальбупрал, Партусистен, Ритодрин. Применение средств, которые расширяют сосуды и улучшают маточно-плацентарный кровоток, к ним относят: Эуфиллин, Аспирин, Курантил.
Поэтому устранение патологии для каждой мамочки происходит персонально: Терапия хронических болезней. Необходимо подлечить имеющиеся недуги и сделать это так, чтобы не навредить малышу. Заболевания печени, почек, язвы желудка лечат с помощью применения безопасных препаратов. Лечение печени осуществляется гепатопротекторами: Эссенциале, Карсил, Хофитол. При язве желудка помогут такие препараты: Маалокс, Ренни, Альмагель. Коррекция питания беременной. Пища в данный период обязана быть разнообразной и сбалансированой. Необходимо совершать маленькие перекусы между приемами пищи. Также стоит не забывать об употребление жидкости, не менее двух литров чистой воды в день. Употребление препаратов, которые расслабляют матку. Они уменьшают сократительную активность органа и помогают избежать преждевременных родов. К таким препаратам относятся: Гинипрал, Сальбупрал, Партусистен, Ритодрин. Применение средств, которые расширяют сосуды и улучшают маточно-плацентарный кровоток, к ним относят: Эуфиллин, Аспирин, Курантил. Они способствуют предотвращению образованию тромбов, улучшают густоту крови и увеличивают скорость кровотока. Употребление ферментов поможет улучшить метаболизм, они способствуют нормальному пищеварению и устраняют признаки ферментной недостаточности. К ним относят: Фестал, Мезим, Пепсин, Панкреатин. Природные средства нередко оказываются эффективными помощниками и заменяют большинство медикаментозных препаратов: Пижма, солодка, василек синий повышают артериальное давление. Ягоды брусники лечат воспаленные почки, оказывают мочегонный и противоотечный эффект. Шиповник богат на витамин С, который поможет бороться с острыми респираторными инфекциями. Ромашка борется с газообразованием в кишечнике, а также обладает мягким слабительным действием. Полноценный отдых и правильное питание — лучшее предотвращение диагноза. Сон беременной женщины должен насчитывать не менее 8-ми часов. А также после двенадцатой недели следует увеличить калорийность питания — нужно потреблять не менее 2500 ккал в день.
 Проще предотвратить диагноз, нежели лечить. Профилактические меры помогут избавиться от причин возникновения гипотрофии. Рассказ специалиста о гипотрофии плода (СЗРП) смотрите в видео:
Проще предотвратить диагноз, нежели лечить. Профилактические меры помогут избавиться от причин возникновения гипотрофии. Рассказ специалиста о гипотрофии плода (СЗРП) смотрите в видео:
БЕРЕМЕННОСТЬ. ПОДГОТОВКА К БЕРЕМЕННОСТИ. ПЛАНИРОВАНИЕ БЕРЕМЕННОСТИ.
Гипотрофия плода
Гипотрофия плода – это отставание малыша в развитии. Начинаться она может как на ранних, так и на поздних сроках беременности. Выражается в уменьшении веса, роста, величины внутренних органов. Наиболее серьезной гипотрофией считается задержка в умственном развитии, которая также может начаться с любых сроков беременности.
Гипотрофия плода: виды
Врачи выделяют два вида задержки развития плода:
- симметричная гипотрофия плода
- ассиметричная гипотрофия плода
Симметричная форма
Симметричная форма гипотрофии плода наблюдается, как правило, на ранних сроках. Характеризуется равномерной задержкой развития всех органов. Такой малыш незначительно прибавляет в весе, все его внутренние органы и системы также растут и развиваются не с нужной силой и быстротой. Самым неприятным последствием данной гипотрофии считается задержка в развитии мозга, поскольку этот самый важный орган также не стремиться развиваться до нужных объемов, поэтому и функции свои он выполняет недостаточно хорошо. Впоследствии у ребенка будет наблюдаться задержка умственного развития.
Такой малыш незначительно прибавляет в весе, все его внутренние органы и системы также растут и развиваются не с нужной силой и быстротой. Самым неприятным последствием данной гипотрофии считается задержка в развитии мозга, поскольку этот самый важный орган также не стремиться развиваться до нужных объемов, поэтому и функции свои он выполняет недостаточно хорошо. Впоследствии у ребенка будет наблюдаться задержка умственного развития.
Ассиметричная форма
Ассиметричная форма гипотрофии плода наблюдается на более поздних сроках беременности. Выражается в незначительном отклонении от нормы некоторых органов. Как правило – почек и печени. Ассиметричная форма вызвана фетоплацентарной недостаточностью (некачественная работа плаценты, которая выполняет роль проводника в питании малыша). Поскольку плацента работает плохо, малыш недополучает нужные ему для развития витамины и питательные вещества, что негативно сказывается на развитии данных органов.
Ассиметричная форма гипотрофии плода также может сказываться на росте и весе малыша, при этом внутренние органы находятся в нормальном объеме и размере, в том числе и головной мозг – поэтому умственная отсталость при данной форме гипотрофии не наблюдается. После рождения у ребенка может быть нарушен кровообмен в головном мозге (вегето-сосудистая дистония), может повышаться черепное давление – однако все эти заболевания проходят либо самостоятельно в течение некоторого времени, либо корректируются сеансами массажа или приемом медикаментозных препаратов.
После рождения у ребенка может быть нарушен кровообмен в головном мозге (вегето-сосудистая дистония), может повышаться черепное давление – однако все эти заболевания проходят либо самостоятельно в течение некоторого времени, либо корректируются сеансами массажа или приемом медикаментозных препаратов.
Гипотрофия плода: причины
- вредные привычки (курение, алкоголь)
- различные токсические и химические вещества, которые приводят к ухудшению состояния матери, а значит и малыша
- фетоплацентарная недостаточность (нарушение работы плаценты – она недостаточно снабжает ребенка кислородом, питательными веществами, кровью)
- различные изменения со стороны самого плода (влияют наследственные факторы, например, изменение количества хромосом в ДНК плода)
- инфекционные заболевания
- гормональные нарушения
- осложнения во время беременности
Гипотрофия плода: диагностика и лечение
Для диагностики любых форм гипотрофии плода используется УЗИ, которое показывает соответствие роста и веса малыша определенному сроку беременности (начиная с самого раннего). При помощи ультразвука врач измеряет рост, вес, а также объемы основных частей тела, наблюдает за работой внутренних органов ребенка, поэтому УЗИ позволяет в быстрые сроки определить внутриутробную задержку в развитии плода.
При помощи ультразвука врач измеряет рост, вес, а также объемы основных частей тела, наблюдает за работой внутренних органов ребенка, поэтому УЗИ позволяет в быстрые сроки определить внутриутробную задержку в развитии плода.
Лечению данное заболевание не поддается. Единственное, что остается матери – это надеяться на чудо, если будет поставлен такой диагноз. При симметричной форме гипотрофии велик риск рождения ребенка с различными умственными отклонениями, при ассиметричной такая возможность исключается, при этом ребенок рождается практически здоровым (любые полученные в утробе заболевания достаточно легко корректируются). В любом случае, при постановке диагноза женщине необходимо четко соблюдать все рекомендации врача – вести здоровый образ жизни и снизить все нагрузки на организм, в том числе и стрессовые.
Наиболее значимую роль играет профилактика данных заболеваний. Женщине необходимо до момента беременности пройти обследования и исключить вероятность возникновения данного заболевания в момент зачатия и развития малыша. Нужно избавиться от вредных привычек, правильно питаться и много отдыхать, в общем – вести здоровый образ жизни.
Нужно избавиться от вредных привычек, правильно питаться и много отдыхать, в общем – вести здоровый образ жизни.
Полный комплекс обследований для подготовки
к беременности для обоих партнеров + консультации акушера-гинеколога
Стоимость —25000р.
Комплекс анализов на гормоны
Стоимость —3200р
Госпитальный комплекс анализов: общий анализ крови,
анализы на ВИЧ и гепатит
Стоимость —2325р
Задать вопрос врачу
%faq addQuestionForm(default_inner,/consult/vedenie_beremennosti/)%Острое проявление гипертрофической кардиомиопатии плода у беременных с диабетом 1 типа
Частота внутриутробной смерти плода у пациентов с диабетом 1 типа значительно выше, чем в общей популяции (1).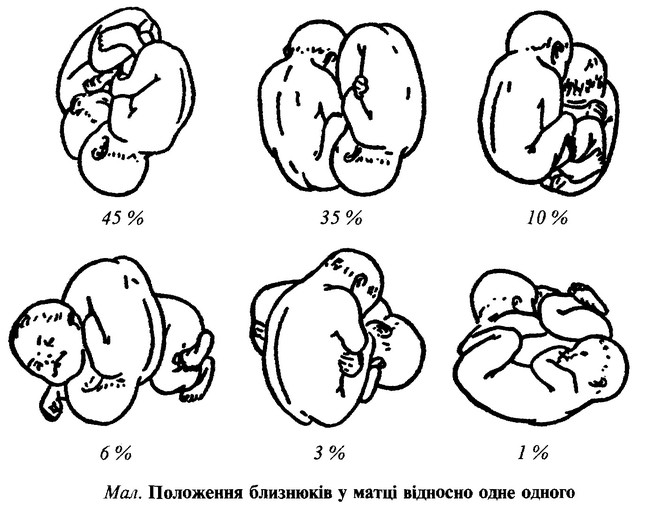 Хотя сосудистые заболевания, плохой гликемический контроль, многоводие, макросомия плода и преэклампсия связаны с более высокой частотой гибели плода, этиология увеличения частоты мертворождений остается неизвестной. Помимо других осложнений, младенцы от матерей-диабетиков давно признаны подверженными риску гипертрофической кардиомиопатии, состояния, которое характеризуется утолщением межжелудочковой перегородки и стенок желудочков, а также систолической и диастолической дисфункцией сердца новорожденных.Это состояние обычно протекает бессимптомно внутриутробно и может привести только к застойной сердечной недостаточности в ближайшем послеродовом периоде, хотя это бывает редко и преходяще (2).
Хотя сосудистые заболевания, плохой гликемический контроль, многоводие, макросомия плода и преэклампсия связаны с более высокой частотой гибели плода, этиология увеличения частоты мертворождений остается неизвестной. Помимо других осложнений, младенцы от матерей-диабетиков давно признаны подверженными риску гипертрофической кардиомиопатии, состояния, которое характеризуется утолщением межжелудочковой перегородки и стенок желудочков, а также систолической и диастолической дисфункцией сердца новорожденных.Это состояние обычно протекает бессимптомно внутриутробно и может привести только к застойной сердечной недостаточности в ближайшем послеродовом периоде, хотя это бывает редко и преходяще (2).
30-летняя женщина, беременность 3, параграф 0, аборт 2, была направлена в наше отделение для оценки подозреваемой макросомии плода на 35 неделе беременности. В возрасте 13 лет ей поставили диагноз диабет 1 типа. При текущей беременности ее гликемический контроль был неоптимальным, что подтверждается значением HbA 1c (A1C), равным 7.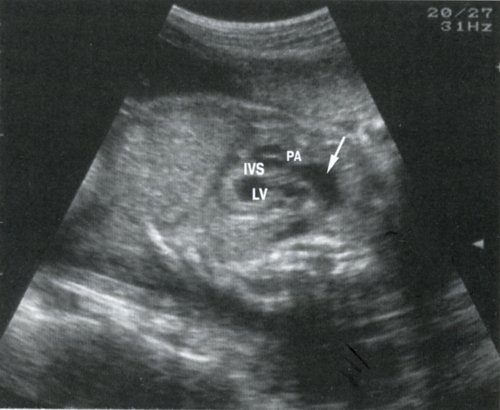 6% получены на 31 неделе. Ультразвуковое сканирование, проведенное в нашем отделении, показало рост брюшной полости плода выше 95-го процентиля. Было ассоциированное многоводие, а в сердце плода наблюдались признаки гипертрофической кардиомиопатии. Кровоток в пупочной артерии был ненормальным. Признаков отека плода не было, но у плода уменьшились движения. С учетом этих результатов было запланировано повторное обследование плода через 4–6 часов для принятия решения о дальнейшем лечении.
6% получены на 31 неделе. Ультразвуковое сканирование, проведенное в нашем отделении, показало рост брюшной полости плода выше 95-го процентиля. Было ассоциированное многоводие, а в сердце плода наблюдались признаки гипертрофической кардиомиопатии. Кровоток в пупочной артерии был ненормальным. Признаков отека плода не было, но у плода уменьшились движения. С учетом этих результатов было запланировано повторное обследование плода через 4–6 часов для принятия решения о дальнейшем лечении.
Через несколько часов пациентка начала жаловаться на сокращения матки.Применялся внешний монитор плода, показывающий исходную частоту сердечных сокращений плода 160 ударов в минуту, с пониженной вариабельностью и повторяющимися поздними замедлениями, что указывает на угрожающий исход при отсутствии лечения. Было выполнено экстренное кесарево сечение, в результате чего родился ребенок женского пола весом 3575 г (вес выше 95-го процентиля для гестации) с оценкой по шкале Апгар 4, 7 и 10 на 1, 5 и 10 минут соответственно. Признаков отслойки не отмечено ни клинически, ни при патологическом исследовании плаценты. Новорожденному потребовалось постоянное положительное давление воздуха в носу в течение первых 12 часов для стабилизации.Постнатальная эхокардиография подтвердила диагноз гипертрофической кардиомиопатии. Было начато лечение пропранололом, и новорожденный был выписан на 7-й день. Контрольное посещение через 3 месяца после родов показало разрешение гипертрофии сердца.
Признаков отслойки не отмечено ни клинически, ни при патологическом исследовании плаценты. Новорожденному потребовалось постоянное положительное давление воздуха в носу в течение первых 12 часов для стабилизации.Постнатальная эхокардиография подтвердила диагноз гипертрофической кардиомиопатии. Было начато лечение пропранололом, и новорожденный был выписан на 7-й день. Контрольное посещение через 3 месяца после родов показало разрешение гипертрофии сердца.
В одном из предыдущих сообщений был описан случай мертворождения на 37 неделе гестации, связанный с ранее не диагностированной водянкой плода и гипертрофической кардиомиопатией у плода диабетической матери (3). Те же авторы предположили, что необъяснимая гибель плода, описанная в более ранних отчетах (4–6), может быть связана с гипертрофической кардиомиопатией.В данном случае у плода не было признаков водянки или сердечной недостаточности, но аномальный кровоток в пуповине указывал на болезненное состояние, близкое к декомпенсации. Повышенная потребность в сердечной работе, вызванная началом сокращений матки, была достаточной для того, чтобы вызвать острый дистресс плода, о чем свидетельствует сильно аномальная картина сердечного ритма плода. Эти данные показывают, что диабетическая гипертрофическая кардиомиопатия может проявляться острым дистрессом плода даже при отсутствии водянки, и предполагают, что это состояние может быть одной из причин увеличения частоты мертворождений при беременности, осложненной диабетом 1 типа.
Повышенная потребность в сердечной работе, вызванная началом сокращений матки, была достаточной для того, чтобы вызвать острый дистресс плода, о чем свидетельствует сильно аномальная картина сердечного ритма плода. Эти данные показывают, что диабетическая гипертрофическая кардиомиопатия может проявляться острым дистрессом плода даже при отсутствии водянки, и предполагают, что это состояние может быть одной из причин увеличения частоты мертворождений при беременности, осложненной диабетом 1 типа.
ССЫЛКИ
- ↵
Jensen DM, Damm P, Moelsted-Pedersen L, Ovesen P, Westergaard JG, Moeller M, Beck-Nielsen H: исходы беременностей с диабетом 1 типа. Уход за диабетом 27: 2819–2823, 2004 г.
- ↵
Rizzo G, Capponi A, Romanini C: Эхокардиография плода в диагностике акушерской патологии. В учебнике кардиологии плода. Аллан Л.Д., Хорнбергер Л.К., Шарланд Г., ред. Лондон, Greenwich Medical Media, стр. 453–470, 2000
- ↵
Сардесай М.
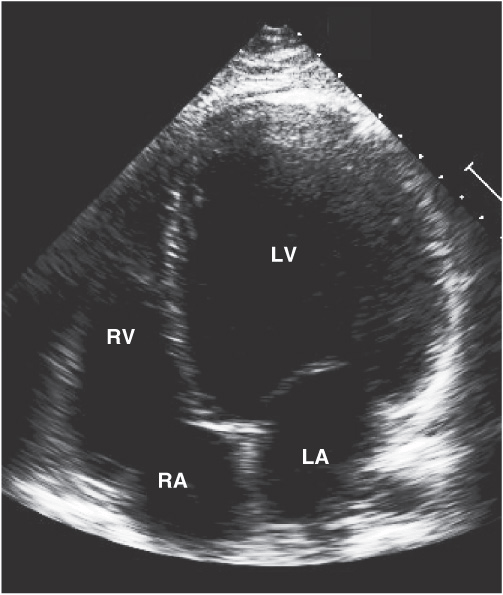 Г., Грей А.А., МакГрат М.М., Форд С.Е.: Смертельная гипертрофическая кардиомиопатия у плода женщины с диабетом.Акушер Гинеколь
98:
925–927, 2001
Г., Грей А.А., МакГрат М.М., Форд С.Е.: Смертельная гипертрофическая кардиомиопатия у плода женщины с диабетом.Акушер Гинеколь
98:
925–927, 2001 - ↵
Gutgesell HP, Speer ME, Rosenberg HS: Характеристика кардиомиопатии у младенцев от матерей с диабетом. Тираж 61: 441–450, 1980
Лесли Дж., Шен С.К., Штраус Л.: Гипертрофическая кардиомиопатия у плода в середине триместра, рожденного от матери с диабетом. J Педиатр 100: 631–632, 1982
- ↵
Гирц Б.А., Дивон М.Ю., Меркатц И.Р.: Внезапная гибель плода у женщин с хорошо контролируемым и интенсивно контролируемым гестационным диабетом.J Perinatol 12: 229–233, 1992
Гипертрофическая кардиомиопатия в детстве — Центр врожденных и детских сердечных заболеваний
Что это?
Гипертрофическая кардиомиопатия — это серьезное заболевание, при котором сердечная мышца утолщена, что может привести к нарушениям ритма и функции сердца.
Что вызывает это?
Гипертрофическая кардиомиопатия имеет множество причин, не все из которых известны.У некоторых младенцев и детей он присутствует с рождения и даже раньше, хотя и не обнаруживается. Причиной может быть дефект сердечной мышцы или проблема с тем, как сердце использует питательные вещества (метаболическая причина), или синдром. Это, в свою очередь, может быть связано с генетической проблемой и может передаваться в семье. Во многих случаях причину так и не обнаруживают.
Сколько людей это получают?
Распространенность всех типов кардиомиопатии оценивается примерно в один случай ежегодно на каждые 100 000 детей в возрасте до 10 лет.
Кому достанется?
Гипертрофическая кардиомиопатия может быть у любого. Это может произойти в любом возрасте — от зародыша до детства и до преклонного возраста. С заболеванием связаны такие состояния, как синдром Нунана. Обычно это происходит в семьях, но часто это может быть новое явление.
Обычно это происходит в семьях, но часто это может быть новое явление.
Каковы признаки и симптомы?
Часто симптомы отсутствуют, и заболевание привлекает внимание из-за присутствия шума (лишний звук в сердце) или в результате обследования на наличие болезни у близкого родственника.У младенцев может возникнуть одышка при плаче или кормлении. У детей и подростков может наблюдаться учащенное сердцебиение или внезапный упадок сил при физической активности.
С появлением эхокардиографии плода диагноз гипертрофической кардиомиопатии можно ставить еще в утробе матери.
Какие тесты я могу пройти?
Детей направят к детскому кардиологу, который проведет дополнительное обследование. После опроса родителей, чтобы узнать историю ребенка и осмотра ребенка, будет организовано несколько тестов.Обычно они включают электрокардиограмму (ЭКГ) для измерения электрической активности сердца и рентген грудной клетки для визуализации сердца и легких. Диагноз ставится с помощью эхокардиографии. Также могут потребоваться анализы крови и мочи, чтобы попытаться найти причину.
Диагноз ставится с помощью эхокардиографии. Также могут потребоваться анализы крови и мочи, чтобы попытаться найти причину.
В долгосрочной перспективе будут выполнены повторные эхокардиограммы для оценки возможного прогрессирования и функции сердца. Для выявления нарушений сердечного ритма потребуются круглосуточный мониторинг ЭКГ, мониторинг событий и тестирование с физической нагрузкой.МРТ может предоставить полезную информацию.
Что такое лечение?
От большинства заболеваний нет лекарства, и лечение предполагает минимизацию риска осложнений.
В легких случаях:
- Может потребоваться только наблюдение.
- Бета-адреноблокатор, снижающий сократимость сердца
В более тяжелых случаях:
- Могут потребоваться дополнительные лекарства, например, антиаритмические, для стабилизации нормального сердечного ритма
- Хирургическое удаление утолщенной мышцы под аортальным клапаном
- Имплантируемый дефибриллятор
- Трансплантация
Есть ли осложнения при заболевании?
Многие младенцы и дети с умеренной гипертрофической кардиомиопатией могут не страдать от осложнений на протяжении всей своей жизни. В других случаях болезнь может прогрессировать и приводить к таким осложнениям, как боль в груди (стенокардия), обморок (обморок), нарушение сердечного ритма и даже фатальная остановка сердца.
В других случаях болезнь может прогрессировать и приводить к таким осложнениям, как боль в груди (стенокардия), обморок (обморок), нарушение сердечного ритма и даже фатальная остановка сердца.
Каков прогноз?
Это сильно варьируется в зависимости от основной причины. Семейный анамнез часто является хорошим индикатором результата. Амбулаторные визиты могут быть пожизненными с повторными эхокардиограммами для оценки структуры и функции сердца. В некоторых случаях требуется трансплантация сердца, хотя это лишь небольшая часть.
Важно, чтобы о таких детях заботились врачи, имеющие опыт лечения таких состояний.
Скачать гипертрофическая кардиомиопатия в детстве PDF
Дополнительная информация:
Федерация детского сердца и Ассоциация кардиомиопатии
Гипертрофия сердца новорожденных: роль гиперинсулинизма — обзор литературы
Elliott P, Andersson B, Arbustini E et al (2008) Классификация кардиомиопатий: заявление о позиции Рабочей группы Европейского общества кардиологов по миокарду и заболевания перикарда.Eur Heart J 29: 270–276 https://doi.org/ehm342
PubMed Google ученый
Колан С.Д., Липшульц С.Е., Лоу А.М. и др. (2007) Эпидемиология и специфические исходы гипертрофической кардиомиопатии у детей: данные Регистра детской кардиомиопатии. Тираж 115: 773–781. https://doi.org/10.1161/CIRCULATIONAHA.106.621185
Артикул PubMed Google ученый
Moak JP, Kaski JP (2012) Гипертрофическая кардиомиопатия у детей. Сердце 98: 1044–1054. https://doi.org/10.1136/heartjnl-2011-300531
Артикул PubMed Google ученый
Каски Дж. П., Сиррис П., Эстебан М. Т. и др. (2009) Распространенность мутаций гена саркомерного белка у детей младшего возраста с гипертрофической кардиомиопатией. Circ Genet 2: 436–441. https://doi.org/10.1161/CIRCGENETICS.108.821314
CAS Статья Google ученый
Nugent AW, Daubeney PE, Chondros P et al (2005) Клинические особенности и исходы гипертрофической кардиомиопатии у детей: результаты национального популяционного исследования. Тираж 112: 1332–1338 https://doi.org/CIRCULATIONAHA.104.530303
PubMed Google ученый
Kaski JP, Elliot P (2010) Глава 49 Кардиомиопатии. В: Anderson RH, Baker EJ, Penny DJ (ред.) Черчилль Ливингстон, Филадельфия, США, 3-е изд.
Google ученый
Lipshultz SE, Orav EJ, Wilkinson JD et al (2013) Стратификация риска при диагностике детей с гипертрофической кардиомиопатией: анализ данных из Регистра детской кардиомиопатии. Ланцет 382: 1889–1897. https://doi.org/10.1016/S0140-6736(13)61685-2
Артикул PubMed PubMed Central Google ученый
Breitweser JA, Meyer RA, Sperling MA et al (1980) Гипертрофия сердечной перегородки у детей с гиперинсулинемией.J Pediatr 96: 535–539
CAS PubMed Google ученый
Gutgesell HP, Speer ME, Rosenberg HS (1980) Характеристика кардиомиопатии у младенцев от матерей с диабетом. Тираж 61: 441–450
Тираж 61: 441–450
CAS PubMed Google ученый
Харрис Дж. П., Рикер А. Т., Грей Р. С. и др. (1992) Обратимая гипертрофическая кардиомиопатия, связанная с несидиобластозом.J Pediatr 120: 272–275
CAS PubMed Google ученый
Розенберг А.М., Хаворт Дж. С., Дегроот Г. В. и др. (1980) Случай лепрекона с тяжелой гиперинсулинемией. Am J Dis Child 134: 170–175
CAS PubMed Google ученый
Rheuban KS, Blizzard RM, Parker MA et al (1986) Гипертрофическая кардиомиопатия при тотальной липодистрофии. J Pediatr 109: 301–302
CAS PubMed Google ученый
Фонда кардиологов / Целевой группы Американской кардиологической ассоциации по практическим рекомендациям AC, торакальной хирургии AA, Echocardiography AS и др. (2011) Руководство ACCF / AHA по диагностике и лечению гипертрофической кардиомиопатии, 2011 г., краткое изложение: отчет американца Фонд кардиологического колледжа / Целевая группа Американской кардиологической ассоциации по практическим рекомендациям. J Thorac Cardiovasc Surg 142: 1303–1338. https://doi.org/10.1016/j.jtcvs.2011.10.019
Артикул Google ученый
Chubb H, Simpson JM (2012) Использование Z-показателей в детской кардиологии. Анн Педиатр Кардиол 5: 179–184. https://doi.org/10.4103/0974-2069.99622
Артикул PubMed PubMed Central Google ученый
Daubeney PE, Blackstone EH, Weintraub RG et al (1999) Взаимосвязь размеров сердечных структур с размером тела: эхокардиографическое исследование у здоровых младенцев и детей. Кардиол Янг 9: 402–410
CAS PubMed Google ученый
Bhayana S, Siu VM, Joubert GI et al (2002) Кардиомиопатия при врожденной полной липодистрофии. Clin Genet 61: 283–287
CAS PubMed Google ученый
Friguls B, Coroleu W, del Alcazar R et al (2009) Тяжелый кардиальный фенотип врожденной липодистрофии Берардинелли-Зейпа у младенца с гомозиготной мутацией E189X BSCL2. Eur J Med Genet 52: 14–16. https://doi.org/10.1016/j.ejmg.2008.10.006
CAS Статья PubMed Google ученый
Абу-Сулейман Р.М., Субайх Б. (2004) Врожденные пороки сердца у младенцев от матерей с диабетом: эхокардиографическое исследование. Pediatr Cardiol 25: 137–140. https://doi.org/10.1007/s00246-003-0538-8
CAS Статья PubMed Google ученый
Брейтвезер Дж. А., Мейер Р. А., Сперлинг М. А., Цанг Р. К., Каплан С. (1980) Гипертрофия сердечной перегородки у младенцев при гиперинсулинемии. J Pediatr 96: 535–539
CAS PubMed Google ученый
Reller MD, Kaplan S (1988) Гипертрофическая кардиомиопатия у младенцев от матерей с диабетом: обновление. Am J Perinatol 5: 353–358. https://doi.org/10.1055/s-2007-999722
CAS Статья PubMed Google ученый
Sheehan PQ, Rowland TW, Shah BL et al (1986) Контроль за диабетом у матери и гипертрофическая кардиомиопатия у младенцев от матерей с диабетом. Clin Pediatr (Phila) 25: 266–271
CAS Google ученый
Деорари А.К., Саксена А., Сингх М., Шривастава С. (1989) Эхокардиографическая оценка младенцев, рожденных от матерей с диабетом. Arch Dis Child 64: 721–724
CAS PubMed PubMed Central Google ученый
Вурал М., Леке Л., Махомедали Х и др. (1995) Следует ли регулярно проводить эхокардиографическое сканирование младенцам от матерей с диабетом? Turk J Pediatr 37: 351–356
CAS PubMed Google ученый
Оберхоффер Р., Хогель Дж., Стоз Ф. и др. (1997) Сердечные и экстракардиальные осложнения у младенцев от матерей с диабетом и их связь с параметрами углеводного обмена. Eur J Pediatr 156: 262–265
CAS PubMed Google ученый
Tan AE, Norizah WM, Rahman HA et al (2005) Индекс сопротивления пупочной артерии при диабетической беременности: ассоциации с исходом для плода и неонатальной гипертрофической кардиомиопатией перегородки.J Obstet Gynaecol Res 31: 296–301 https://doi.org/JOG291
PubMed Google ученый
Ullmo S, Vial Y, Di Bernardo S. et al (2007) Патологическая гипертрофия желудочков у потомков матерей с диабетом: ретроспективное исследование. Eur Heart J 28: 1319–1325. https://doi.org/10.1093/eurheartj/ehl416
CAS Статья PubMed Google ученый
Эль-Ганзури М.М., Эль-Масри С.А., Эль-Фарраш Р.А. и др. (2012) Младенцы от матерей с диабетом: эхокардиографические измерения и IGF-I и IGFBP-1 пуповинной крови.Педиатр Диабет 13: 189–196. https://doi.org/10.1111/j.1399-5448.2011.00811.x
CAS Статья PubMed Google ученый
Коллинз Дж. Э., Леонард Дж. В. (1984) Гиперинсулинизм у детей с гипогликемией, страдающих асфиксией и недоношенных детей. Ланцет 2: 311–313. https://doi.org/S0140-6736(84)
Mehta A, Hussain K (2003) Преходящий гиперинсулинизм, связанный с макросомией, гипертрофической обструктивной кардиомиопатией, гепатомегалией и нефромегалией.Arch Dis Child 88: 822–824
CAS PubMed PubMed Central Google ученый
Massin MM, Van Elmbt G, Soyeur D (1999) Обратимая гипертрофическая кардиомиопатия при врожденном гиперинсулинизме. Acta Cardiol 54: 359–361
CAS PubMed Google ученый
Натараджан Г., Аггарвал С., Мерритт Т.А. (2007) Новая мутация, связанная с врожденным гиперинсулинизмом.Am J Perinatol 24: 401–404. https://doi.org/10.1055/s-2007-984408
Артикул PubMed Google ученый
Zerah MM, Anderson J, Davenport J, Thornton PS (2013) Смертельная обструктивная гипертрофическая кардиомиопатия в двух случаях неонатального врожденного гиперинсулинизма. 95-е ежегодное собрание и выставка эндокринного общества, Сан-Франциско Номер презентации: SUN-610
Хуанг Т., Келли А., Беккер С.А. и др. (2013) Гипертрофическая кардиомиопатия у новорожденных с врожденным гиперинсулинизмом.Arch Dis childrenFetal neonatal Ed. https://doi.org/10.1136/archdischild-2012-302546
PubMed PubMed Central Google ученый
Stanley CA (1997) Гиперинсулинизм у младенцев и детей. Pediatr Clin North Am 44: 363–374
CAS PubMed Google ученый
Stanley CA (2016) Перспективы генетики и диагностики врожденных нарушений гиперинсулинизма.J Clin Endocrinol Metab 101: 815–826. https://doi.org/10.1210/jc.2015-3651
CAS Статья PubMed PubMed Central Google ученый
Flanagan SE, Kapoor RR, Hussain K (2011) Генетика врожденной гиперинсулинемической гипогликемии. Семин Педиатр Хирургия 20: 13–17. https://doi.org/10.1053/j.sempedsurg.2010.10.004
Артикул PubMed Google ученый
Семпл Р.К., Сэвидж Д.Б., Кокран Е.К. и др. (2011) Генетические синдромы тяжелой инсулинорезистентности. Endocr Rev 32: 498–514. https://doi.org/10.1210/er.2010-0020. https://doi.org/10.1210/er.2010-0020
Elsas LJ, Endo F, Strumlauf E et al (1985) Leprechaunism: наследственный дефект высокоаффинного рецептора инсулина. Am J Hum Genet 37: 73–88
CAS PubMed PubMed Central Google ученый
Termote JU, Breur JM, de Vroede MA (2016) Гипертрофическая кардиомиопатия при синдроме Донохью.Кардиол Янг 26: 815–818. https://doi.org/10.1017/S1047
5002437
Артикул PubMed Google ученый
Лупса BC, Сачдев В., Лунгу А.О. и др. (2010) Кардиомиопатия при врожденной и приобретенной генерализованной липодистрофии: клиническая оценка. Медицина (Балтимор) 89: 245–250. https://doi.org/10.1097/MD.0b013e3181e9442f
Артикул Google ученый
Jeninga EH, de Vroede M, Hamers N. et al (2012) Пациент с врожденной генерализованной липодистрофией из-за новой мутации в BSCL2: показания для вторичной митохондриальной дисфункции. JIMD Rep 4: 47–54. https://doi.org/10.1007/8904_2011_86
Артикул PubMed Google ученый
Zaccai TCF, Kalfon L, Klar A et al (2014) Две новые мутации, выявленные в семейных случаях с синдромом Донохью. Mol Genet Genomic Med 2: 64–72.https://doi.org/10.1002/mgg3.43
CAS Статья Google ученый
Лонго Н., Лэнгли С.Д., Стилл М.Дж., Эльсас Л.Дж. (1995) Пренатальный анализ гена рецептора инсулина в семье с лепреконами. Prenat Diagn 15: 1070–1074
CAS PubMed Google ученый
Musso C, Cochran E, Moran SA et al (2004) Клиническое течение генетических заболеваний рецептора инсулина (тип A и синдромы Рабсона-Менденхолла): 30-летняя перспектива.Медицина (Балтимор) 83: 209–222 https://doi.org/00005792-200407000-00001
CAS Google ученый
Гарг А (2000) Липодистрофии. Am J Med 108: 143–152
CAS PubMed Google ученый
Агарвал А.К., Гарг А. (2006) Генетические основы липодистрофий и лечение метаболических осложнений. Анну Рев Мед 57: 297–311. https://doi.org/10.1146/annurev.мед.57.022605.114424
CAS Статья PubMed Google ученый
Jeninga EH, Kalkhoven E (2010) Центральные игроки в наследственных липодистрофиях. Тенденции метаболизма эндокринола 21: 581–588. https://doi.org/10.1016/j.tem.2010.06.006
CAS Статья PubMed Google ученый
Agarwal AK, Simha V, Oral EA et al (2003) Фенотипическая и генетическая гетерогенность врожденной генерализованной липодистрофии.J Clin Endocrinol Metab 88: 4840–4847
CAS PubMed Google ученый
Bjornstad PG, Semb BK, Trygstad O, Seip M (1985) Эхокардиографическая оценка сердечной функции и морфологии у пациентов с генерализованной липодистрофией. Eur J Pediatr 144: 355–359
CAS PubMed Google ученый
Клар А., Бренд А., Гурвиц Х. и др. (1993) Кардиомиопатия при липодистрофии и гипотеза перетекания специфичности.Isr J Med Sci 29: 50–52
CAS PubMed Google ученый
Ли М., Сквайр Дж. А., Вексберг Р. (1998) Молекулярная генетика синдрома Видеманна-Беквита. Am J Med Genet 79: 253–259
CAS PubMed Google ученый
Энгстрем В., Линдхэм С., Скофилд П. (1988) Синдром Видеманна-Беквита. Eur J Pediatr 147: 450–457
CAS PubMed Google ученый
Эллиотт М., Бейли Р., Коул Т. и др. (1994) Клинические особенности и естественное течение синдрома Беквита-Видеманна: представление 74 новых случаев. Clin Genet 46: 168–174
CAS PubMed Google ученый
Маннс CF, Batch JA (2001) Гиперинсулинизм и синдром Беквита-Видемана. Arch Dis childrenFetal неонатальный Ed 84: F67 – F69
CAS Google ученый
DeBaun MR, King AA, White N (2000) Гипогликемия при синдроме Беквита-Видеманна. Семин Перинатол 24: 164–171
CAS PubMed Google ученый
Kalish JM, Boodhansingh KE, Bhatti TR et al (2016) Врожденный гиперинсулинизм у детей с отцовской однопородной изодисомией 11p и синдромом Беквита-Видемана. J Med Genet 53: 53–61. https://doi.org/10.1136/jmedgenet-2015-103394
CAS Статья PubMed Google ученый
Greenwood RD, Somer A, Rosenthal A et al (1977) Сердечно-сосудистые нарушения при синдроме Беквита-Видеманна. Am J Dis Child 131: 293–294
CAS PubMed Google ученый
Райан К.А., Бойл М.Х., Бургграф Г.В. (1989) Обратимая обструктивная гипертрофическая кардиомиопатия при синдроме Беквита-Видемана. Педиатр Кардиол 10: 225–228
CAS PubMed Google ученый
Siwik ES, Zahka KG, Wiesner GL, Limwongse C (1998) Сердечная болезнь при синдроме Костелло. Педиатрия 101: 706–709
CAS PubMed Google ученый
Лин А.Е., Гроссфельд П.Д., Гамильтон Р.М. и др. (2002) Дальнейшее определение сердечных аномалий при синдроме Костелло. Am J Med Genet 111: 115–129. https://doi.org/10.1002/ajmg.10558
Артикул PubMed Google ученый
Dickson PI, Briones NY, Baylen BG et al (2004) Синдром Костелло с гиперплазией островковых клеток поджелудочной железы. Am J Med Genet A 130A: 402–405. https://doi.org/10.1002/ajmg.a.30288
Артикул PubMed Google ученый
Sheffield BS, Yip S, Ruchelli ED et al (2015) Смертельная врожденная гипертрофическая кардиомиопатия и узелок поджелудочной железы, морфологически идентичный очаговому поражению врожденного гиперинсулинизма у младенца с синдромом Костелло: отчет о клиническом случае и обзор литературы.Педиатр Дев Патол 18: 237–244. https://doi.org/10.2350/14-07-1525-CR.1
Артикул PubMed Google ученый
Sun L, Eklund EA, Chung WK et al (2005) Врожденное нарушение гликозилирования, проявляющееся гиперинсулинемической гипогликемией и гиперплазией островковых клеток. J Clin Endocrinol Metab 90: 4371–4375 https://doi.org/jc.2005-0250
CAS PubMed Google ученый
Drut R, Mortera M, Drut RM (1998) Опухоль желточного мешка плаценты при синдроме Видеманна-Беквита. Педиатр Dev Pathol 1: 534–537
CAS PubMed Google ученый
Aoki Y, Niihori T, Kawame H et al (2005) Мутации зародышевой линии в протоонкогене HRAS вызывают синдром Костелло. Нат Генет 37: 1038–1040. https://doi.org/10.1038/ng1641
CAS Статья PubMed Google ученый
Hennekam RC (2003) Синдром Костелло: обзор. Am J Med Genet C, Semin Med Genet 117C: 42–48. https://doi.org/10.1002/ajmg.c.10019
Артикул Google ученый
Александр С., Рамадан Д., Алхайят Х. и др. (2005) Синдром Костелло и гиперинсулинемическая гипогликемия. Am J Med Genet A 139: 227–230. https://doi.org/10.1002/ajmg.a.31011
Артикул PubMed Google ученый
Marquardt T, Denecke J (2003) Врожденные нарушения гликозилирования: обзор их молекулярных основ, клинических проявлений и специфических методов лечения. Eur J Pediatr 162: 359–379. https://doi.org/10.1007/s00431-002-1136-0
CAS Статья PubMed Google ученый
Бабович-Вуксанович Д., Паттерсон М.К., Швенк В.Ф. и др. (1999) Тяжелая гипогликемия как характерный симптом синдрома дефицита углеводов в гликопротеинах.J Pediatr 135: 775–781 https://doi.org/S0022-3476(99)70103-4
CAS PubMed Google ученый
Болес Х., Сьюэлл А.А., Гебхардт Б. и др. (2001) Гиперинсулинемическая гипогликемия — ведущий симптом у пациента с врожденным нарушением гликозилирования Ia (дефицит фосфоманномутазы). J Inherit Metab Dis 24: 858–862
CAS PubMed Google ученый
Korner C, Knauer R, Stephani U et al (1999) Синдром дефицитного углеводов гликопротеина типа IV: дефицит долихил-P-Man: Man (5) GlcNAc (2) -PP-долихилманнозилтрансфераза. EMBO J 18: 6816–6822. https://doi.org/10.1093/emboj/18.23.6816
CAS Статья PubMed PubMed Central Google ученый
Clayton PT, Winchester BG, Keir G (1992) Гипертрофическая обструктивная кардиомиопатия у новорожденного с синдромом дефицита углеводов гликопротеинов.J Inherit Metab Dis 15: 857–861
CAS PubMed Google ученый
Вебер Р., Кантор П., Читаят Д. и др. (2014) Спектр и исход первичных кардиомиопатий, диагностированных во время жизни плода. JACCHeart Fail 2: 403–411. https://doi.org/10.1016/j.jchf.2014.02.010
Артикул Google ученый
Педра С.Р., Смоллхорн Дж. Ф., Райан Г. и др. (2002) Кардиомиопатии плода: патогенетические механизмы, гемодинамические данные и клинические исходы.Тираж 106: 585–591
PubMed Google ученый
Hagemann LL, Zielinsky P (1996) Пренатальное исследование гипертрофической кардиомиопатии и ее связи с уровнями инсулина у плодов матерей с диабетом. Arq Bras Cardiol 66: 193–198
CAS PubMed Google ученый
Zielinsky P, da Costa MH, Oliveira LT et al (1997) Естественная история гипертрофии миокарда и ее связи с гиперинсулинизмом у младенцев от матерей с диабетом.Arq Bras Cardiol 69: 389–394
CAS PubMed Google ученый
Lusson JR, Gaulme J, Raynaud EJ, Cheynel J (1982) Асимметричная гипертрофическая кардиомиопатия у новорожденных от диабетических матерей. Arch Fr Pediatr 39: 433–436
CAS PubMed Google ученый
Марон Б.Дж., Робертс В.К. (1979) Количественный анализ дезорганизации клеток сердечной мышцы в межжелудочковой перегородке пациентов с гипертрофической кардиомиопатией.Тираж 59: 689–706
CAS PubMed Google ученый
Sutton MGSJ, Lie JT, Anderson KR et al (1980) Гистопатологическая специфичность гипертрофической обструктивной кардиомиопатии. Расстройство миокардиальных волокон и фиброз миокарда. Br Heart J 44: 433–443
Google ученый
Ширани Дж., Пик Р., Робертс В. К., Марон Б. Дж. (2000) Морфология и значение коллагеновой сети левого желудочка у молодых пациентов с гипертрофической кардиомиопатией и внезапной сердечной смертью.J Am Coll Cardiol 35: 36–44
CAS PubMed Google ученый
Ховник Т., Братаник Н., Подкрайсек К.Т. и др. (2012) Тяжелая прогрессирующая обструктивная кардиомиопатия и дисфункция почечных канальцев при синдроме Донохью со сниженным аутофосфорилированием рецепторов инсулина из-за новой мутации INSR. Eur J Pediatr. https://doi.org/10.1007/s00431-012-1901-7
PubMed Google ученый
Huang T, Kelly A, Becker SA et al (2013) Гипертрофическая кардиомиопатия у новорожденных с врожденным гиперинсулинизмом. Arch Dis childrenFetal неонатальный Ed 98: F351 – F354. https://doi.org/10.1136/archdischild-2012-302546
Артикул Google ученый
Maillet M, van Berlo JH, Molkentin JD (2013) Молекулярные основы физиологического роста сердца: фундаментальные концепции и новые игроки. Биол клетки Nat Rev 14: 38–48. https: // doi.org / 10.1038 / nrm3495
CAS Статья Google ученый
Zapf J, Schoenle E, Froesch ER (1978) Инсулиноподобные факторы роста I и II: некоторые биологические действия и характеристики связывания рецепторов двух очищенных компонентов неподавляемой инсулиноподобной активности человеческой сыворотки. Eur J Biochem 87: 285–296
CAS PubMed Google ученый
Бедингер Д.Х., Адамс С.Х. (2015) Метаболические, анаболические и митогенные реакции инсулина: тканеспецифическая перспектива активаторов рецепторов инсулина.Эндокринол клеток Mol 415: 143–156. https://doi.org/10.1016/j.mce.2015.08.013
CAS Статья PubMed Google ученый
Bar RS, Boes M, Dake BL et al (1988) Инсулин, инсулиноподобные факторы роста и эндотелий сосудов. Am J Med 85: 59–70
CAS PubMed Google ученый
Brownsey RW, Boone AN, Allard MF (1997) Действие инсулина на сердце млекопитающих: метаболизм, патология и биохимические механизмы.Cardiovasc Res 34: 3–24
CAS PubMed Google ученый
Ren J, Samson WK, Sowers JR (1999) Инсулиноподобный фактор роста I в качестве сердечного гормона: физиологические и патофизиологические последствия при сердечных заболеваниях. J Mol Cell Cardiol 31: 2049–2061
CAS PubMed Google ученый
Nakae J, Kido Y, Accili D (2001) Отдельные и перекрывающиеся функции рецепторов инсулина и IGF-I.Endocr Rev 22: 818–835. https://doi.org/10.1210/edrv.22.6.0452
CAS Статья PubMed Google ученый
Rodriguez M, Alonso L, Alvarez E, Blazquez E (1987) Прямые доказательства того, что инсулин не подавляет свои собственные рецепторы в циркулирующих моноцитах новорожденных людей. Диабетология 30: 820–822
CAS PubMed Google ученый
Торссон А.В., Хинц Р.Л. (1977) Рецепторы инсулина у новорожденных.Увеличение сродства и количества рецепторов. N Engl J Med 297: 908–912. https://doi.org/10.1056/NEJM197710272971704
CAS Статья PubMed Google ученый
Fazio S, Palmieri EA, Biondi B et al (2000) Роль оси GH-IGF-I в регуляции роста миокарда: от экспериментальных моделей до человеческих доказательств. Eur J Endocrinol 142: 211–216 https://doi.org/1420211
CAS PubMed Google ученый
Netchine I, Azzi S, Le Bouc Y, Savage MO (2011) Молекулярные аномалии IGF1 демонстрируют его критическую роль в эмбриональном, постнатальном росте и развитии мозга. Лучшая практика Res Endocrinol Metab 25: 181–190. https://doi.org/10.1016/j.beem.2010.08.005
CAS Статья Google ученый
Laustsen PG, Russell SJ, Cui L et al (2007) Существенная роль передачи сигналов рецептора инсулина и инсулиноподобного фактора роста 1 в развитии и функционировании сердца.Mol Cell Biol 27: 1649–1664 https://doi.org/MCB.01110-06
CAS PubMed Google ученый
Cheitlin MD, Armstrong WF, Aurigemma GP et al (2003) ACC / AHA / ASE 2003 г. Обновление рекомендаций по клиническому применению эхокардиографии: сводная статья. Отчет Американской коллегии кардиологов / Американской кардиологической ассоциации по практическим рекомендациям Комитета ACC / AHA / ASE по обновлению Руководства 1997 года. J Am Soc Echocardiogr 16: 1091–1110.https://doi.org/10.1016/S0894-7317(03)00685-0
Артикул PubMed Google ученый
Эйнсли-Грин А., Хуссейн К., Холл Дж. И др. (2000) Практическое лечение гиперинсулинизма в младенчестве. Arch Dis childrenFetal неонатальный Ed 82: F98 – F107
CAS Google ученый
Палладино А.А., Стэнли Калифорния (2010) Синдром гиперинсулинизма / гипераммонемии. Rev Endocr Metab Disord 11: 171–178.https://doi.org/10.1007/s11154-010-9146-0
CAS Статья PubMed Google ученый
Wertheimer E, Lu SP, Backeljauw PF et al (1993) Гомозиготная делеция гена рецептора человеческого инсулина приводит к лепрекону. Нат Генет 5: 71–73. https://doi.org/10.1038/ng0993-71
CAS Статья PubMed Google ученый
Flier JS, Usher P, Moses AC (1986) Моноклональное антитело к рецептору инсулиноподобного фактора роста I типа (IGF-I) блокирует синтез ДНК, опосредованный рецептором IGF-I: выяснение митогенных механизмов IGF-I и инсулин в фибробластах кожи человека.Proc Natl Acad Sci U S A 83: 664–668
CAS PubMed PubMed Central Google ученый
Геффнер М.Э., Каплан С.А., Берш Н. и др. (1987) Лепрехаунизм: действие инсулина in vitro, несмотря на генетическую резистентность к инсулину. Pediatr Res 22: 286–291
CAS PubMed Google ученый
Hone J, Accili D, Psiachou H et al (1995) Гомозиготность по нулевому аллелю гена рецептора инсулина у пациента с лепреконизмом.Хум Мутат 6: 17–22. https://doi.org/10.1002/humu.1380060105
CAS Статья PubMed Google ученый
Spudich JA (2014) Гипертрофическая и дилатационная кардиомиопатия: четыре десятилетия фундаментальных исследований мышц привели к потенциальным терапевтическим подходам к этим разрушительным генетическим заболеваниям. Biophys J 106: 1236–1249. https://doi.org/10.1016/j.bpj.2014.02.011
CAS Статья PubMed PubMed Central Google ученый
Jr WWH, Раджу Т.Н., Хиггинс Р.Д. и др. (2009) Пробелы в знаниях и потребности в исследованиях для понимания и лечения неонатальной гипогликемии: отчет о семинаре Национального института здоровья ребенка и развития человека Юнис Кеннеди Шрайвер. J Pediatr 155: 612–617. https://doi.org/10.1016/j.jpeds.2009.06.044
Артикул Google ученый
Абу-Осба Ю.К., Манасра К.Б., Мэтью П.М. (1989) Осложнения лечения диазоксидом при стойком неонатальном гиперинсулинизме.Arch Dis Child 64: 1496–1500
CAS PubMed PubMed Central Google ученый
Timlin MR, Black AB, Delaney HM et al (2017) Развитие легочной гипертензии во время лечения диазоксидом: серия случаев и обзор литературы. Педиатр Кардиол 38: 1247–1250. https://doi.org/10.1007/s00246-017-1652-3
Артикул PubMed Google ученый
Senniappan S, Alexandrescu S, Tatevian N et al (2014) Терапия сиролимусом у младенцев с тяжелой гиперинсулинемической гипогликемией. N Engl J Med 370: 1131–1137. https://doi.org/10.1056/NEJMoa1310967
CAS Статья PubMed Google ученый
Madiraju AK, Erion DM, Rahimi Y et al (2014) Метформин подавляет глюконеогенез, ингибируя митохондриальную глицерофосфатдегидрогеназу. Nature 510: 542–546. https: // doi.org / 10.1038 / nature13270
CAS Статья PubMed PubMed Central Google ученый
Backeljauw PF, Alves C, Eidson M, et al (1994) Эффект внутривенного инсулиноподобного фактора роста I у двух пациентов с лепреконизмом. Pediatr Res 36: 749–754. https://doi.org/10.1203/00006450-19
00-00012
CAS PubMed Google ученый
Planchenault D, Martin-Coignard D, Rugemintwaza D et al (2014) Синдром Донохью или лепреконизм.Arch Pediatr 21: 206–210. https://doi.org/10.1016/j.arcped.2013.11.016
CAS Статья PubMed Google ученый
Ховник Т., Братаник Н., Подкрайсек К.Т. и др. (2013) Тяжелая прогрессирующая обструктивная кардиомиопатия и дисфункция почечных канальцев при синдроме Донохью со сниженным аутофосфорилированием рецептора инсулина из-за новой мутации INSR. Eur J Pediatr 172: 1125–1129. https://doi.org/10.1007/s00431-012-1901-7
Артикул PubMed Google ученый
Satoh M, Yoshizawa A, Takesue M et al (2006) Долгосрочные эффекты лечения рекомбинантным человеческим инсулиноподобным фактором роста I на метаболизм глюкозы и липидов и рост пациента с врожденной генерализованной липодистрофией. Endocr J 53: 639–645
CAS PubMed Google ученый
Chan JL, Lutz K, Cochran E et al (2011) Клинические эффекты длительного лечения метрелептином у пациентов с липодистрофией. Endocr Pract 17: 922–932.https://doi.org/10.4158/EP11229.OR
Артикул PubMed PubMed Central Google ученый
Альварес Р.Ф., Гудвин Дж.Ф. (1982) Неинвазивная оценка диастолической функции при гипертрофической кардиомиопатии с включением и отключением бета-адреноблокаторов. Br Heart J 48: 204–212
CAS PubMed PubMed Central Google ученый
Bourmayan C, Razavi A, Fournier C et al (1985) Влияние пропранолола на расслабление левого желудочка при гипертрофической кардиомиопатии: эхографическое исследование.Am Heart J 109: 1311–1316
CAS PubMed Google ученый
de Graaf M, Breur JM, Raphael MF et al (2011) Побочные эффекты пропранолола при лечении гемангиом: серия случаев с участием 28 младенцев. J Am Acad Dermatol 65: 320–327. https://doi.org/10.1016/j.jaad.2010.06.048
CAS Статья PubMed Google ученый
Незагруженное сердце in vivo воспроизводит экспрессию гена гипертрофии у плода
Komuro, I.& Язаки, Ю. Контроль экспрессии сердечных генов механическим стрессом. Annu. Rev. Physiol. 55 , 55–75 (1993).
CAS Статья Google ученый
Садошима С. и Изумо С. Клеточный и молекулярный ответ сердечных миоцитов на механический стресс. Annu. Rev. Physiol. 59 , 551–571 (1997).
CAS Статья Google ученый
Паркер Т.G. & Schneider, M.D. Факторы роста, протоонкогены и пластичность сердечного фенотипа. Annu. Rev. Physiol. 53 , 179–200 (1991).
CAS Статья Google ученый
Надаль-Жинард Б. и Махдави В. Молекулярная основа сердечной деятельности: пластичность миокарда, генерируемая переключателями изоформ белка. J. Clin. Вкладывать деньги. 84 , 1693–1700 (1989).
CAS Статья Google ученый
Mercadier, J.J. и др. . Изоферментные изменения миозина на нескольких моделях гипертрофии сердца крыс. Circ. Res. 49 , 525–532 (1981).
CAS Статья Google ученый
Идзумо, С., Надаль-Жинард, Б. и Махдави, В. Индукция протоонкогенов и перепрограммирование экспрессии сердечных генов, вызванных перегрузкой давлением. Proc. Natl. Акад. Sci. США 85 , 339–343 (1988).
CAS Статья Google ученый
Идзумо, С. и др. . Мессенджер РНК тяжелой цепи миозина и переходы изоформ белка во время гипертрофии сердца. J. Clin. Вкладывать деньги. 79 , 970–977 (1987).
CAS Статья Google ученый
Schwartz, K. et al. мРНК актина α-скелетных мышц накапливаются в гипертрофированных сердцах взрослых крыс. Circ. Res. 59 , 551–555 (1986).
CAS Статья Google ученый
Шварц, К., Boheler, K.R., de la Bastie, D., Lompre, A.M. И Меркадье, Дж. Дж. Включает экспрессию генов сердечной мышцы в результате перегрузки давлением и объемом. Am. J. Physiol. 262 , R364 – R369 (1992).
CAS Статья Google ученый
Гинен, Д.Л., Малхотра, А., Баттрик, П.М. & Scheuer, J. Повышенная частота сердечных сокращений предотвращает сдвиг изомиозина после трансплантации сердца крысе. Circ.Res. 70 , 554–558 (1992).
CAS Статья Google ученый
Гинен, Д., Малхотра, А., Баттрик, П.М. & Scheuer, J. Желудочковая стимуляция ослабляет, но не устраняет сердечную атрофию и изомиозиновый сдвиг в сердце крысы. Am. J. Physiol. 267 , h3149 – h3154 (1994).
CAS PubMed Google ученый
Клейн, И., Ojamaa, K., Samarel, A.M., Welikson, R. & Hong, C. Гемодинамическая регуляция экспрессии тяжелой цепи миозина. J. Clin. Вкладывать деньги. 89 , 68–73 (1992).
CAS Статья Google ученый
Мюллер, Дж. и др. . Отлучение от механической поддержки сердца у пациентов с идиопатической дилатационной кардиомиопатией. Тираж 96 , 542–549 (1997).
CAS Статья Google ученый
Дипла, К., Маттиелло, Дж. А., Дживанандам, В., Хаузер, С. И Маргулис, К. Восстановление миоцитов после механической поддержки кровообращения у людей с терминальной сердечной недостаточностью. Тираж 97 , 2316–2322 (1998).
CAS Статья Google ученый
Зафейридис, А., Дживанандам, В., Хаузер, С. И Маргулис, К. Регресс клеточной гипертрофии после поддержки вспомогательного устройства левого желудочка. Тираж 98 , 656–662 (1998).
CAS Статья Google ученый
Kleinman, L.H., Wechsler, A.S., Rembert, J.C., Fedor, J.M. & Greenfield, J.C. Воспроизводимая модель умеренной и тяжелой концентрической гипертрофии левого желудочка. Am. J. Physiol. 234 , H515 – H519 (1978).
CAS PubMed Google ученый
Оно К. и Линдси Э. С. Усовершенствованная техника трансплантации сердца у крыс. J. Thorac. Кардиоваск. Surg. 57 , 225– 229 (1969).
CAS PubMed Google ученый
Parker, T.G., Packer, S.E. & Schneider, M.D. Пептидные факторы роста могут провоцировать экспрессию гена сократительного белка «плода» в сердечных миоцитах крыс. J. Clin. Вкладывать деньги. 85 , 507–514 (1990).
CAS Статья Google ученый
Черный, F.Б. и др. . Ген альфа-актина гладких мышц сосудов реактивируется при гипертрофии сердца, спровоцированной нагрузкой. J. Clin. Вкладывать деньги. 88 , 1581–1588 (1991).
CAS Статья Google ученый
Rockman, H.A. и др. . Разделение предсердно-специфической и индуцибельной экспрессии трансгена предсердного натрийуретического фактора на мышиной модели гипертрофии сердца in vivo. Proc.Natl. Акад. Sci. США 88 , 8277–8281 (1991).
CAS Статья Google ученый
Schneider, M.D., Roberts, R. & Parker, TG. Модуляция сердечных генов механическим стрессом. Гипотеза передачи сигналов онкогенов. Мол. Биол. Med. 8 , 167–183 (1991).
CAS PubMed Google ученый
Паради, П., McLellan, W.R., Belaguli, N.S., Schwartz, R.J. & Schneider, M.D. Фактор ответа сыворотки опосредует AP-1-зависимую индукцию скелетного промотора α-актина в желудочковых миоцитах. J. Biol. Chem. 271 , 10827–10833 (1996).
CAS Статья Google ученый
Sadoshima, J.I. И Изумо С. Механическое растяжение быстро активирует множественные пути передачи сигналов в сердечных миоцитах: потенциальное участие аутокринного / паракринного механизма. EMBO J. 12 , 1681–1692 (1993).
CAS Статья Google ученый
Gould, G.W. in Facilitative Glucose Transporters, 67–104 (Chapman & Hall, Джорджтаун, Техас, 1997).
Google ученый
Taegtmeyer, H., Hems, R. & Krebs, H.A. Использование субстратов, обеспечивающих энергию, в изолированном рабочем сердце крысы. Biochem. J. 186 , 701–711 (1980).
CAS Статья Google ученый
Лю, М.Л., Олсон, А.Л., Эджингтон, Н.П., Мойл-Роули, У.С. & Pessin, J.E. Сайт связывания фактора 2 энхансера миоцитов (MEF2) является важным для C2C12-специфической экспрессии в мышечных трубках крысиного переносчика глюкозы GLUT4 / мышечно-жировая клетчатка. J. Biol. Chem. 269 , 28514–28521 (1994).
CAS PubMed Google ученый
Ли Ю., Nadal-Ginard, B., Mahdavi, V. & Izumo, S. Миоцит-специфический фактор-усилитель 2 и рецептор тироидного гормона ассоциируют и синергически активируют ген тяжелой цепи α-сердечного миозина. Мол. Cell. Биол. 17 , 2745–2755 (1997).
CAS Статья Google ученый
Роббинс, Дж. Регулирование экспрессии сердечных генов во время развития. Cardiovasc. Res. 31 , E2 – E16 (1996).
CAS Статья Google ученый
Депре, К., Вановершельде, Дж. Л. Дж. И Тэгтмайер, Х. Глюкоза для сердца. Тираж (в печати).
Santalucia, T. et al. . Регулирование развития экспрессии транспортеров глюкозы GLUT-1 (Erythroid / HepG2) и GLUT-4 (мышцы / жир) в сердце, скелетных мышцах и коричневой жировой ткани крыс. Эндокринология 130 , 837–846 (1992).
CAS PubMed Google ученый
Brown, N.F., Weis, B.C., Husti, J.E., Foster, D.W. & McGarry, J.D. Переключение изоформ митохондриальной карнитин-пальмитоилтрансферазы в развивающемся сердце крысы. J. Biol. Chem. 270 , 8952–8957 (1995).
CAS Статья Google ученый
Gould, G.W. И Холман, Г.Д. Семейство переносчиков глюкозы: структура, функция и тканеспецифическая экспрессия. Biochem. J. 295 , 329–341 (1993).
CAS Статья Google ученый
Корецкий Б., Зак Р., Шварц К. и Ашенбреннер В. Роль тироидных гормонов в регуляции состава изомиозина, сократимости и размера гетеротопически изотрансплантированного сердца крысы. Circ. Res. 60 , 824–830 (1987).
CAS Статья Google ученый
Дорн, Г.У., Роббинс, Дж., Болл, Н. и Уолш, Р.А. Регуляция тяжелой цепи миозина и сократительная депрессия миоцитов после гипертрофии ЛЖ у мышей с перевязкой аорты. Am. J. Physiol. 267 , h500– h505 (1994).
CAS PubMed Google ученый
Hasegawa, K., Lee, S.J., Jobe, S.M., Markham, B.E. И Китсис, Р. цис--действующие последовательности, которые опосредуют индукцию экспрессии гена тяжелой цепи β-миозина во время гипертрофии левого желудочка из-за сужения аорты. Тираж 96 , 3943–3953 (1997).
CAS Статья Google ученый
Довенданс, П.А. И Ван Билсен, М. Факторы транскрипции и программа сердечных генов. Внутр. J. Biochem. Cell. Биол. 28 , 387–403 (1996).
CAS Статья Google ученый
Хан, Дж., Цзян, Ю., Ли, З., Кравченко, В.В. и Улевич, Р.Дж. Активация фактора транскрипции MEF2C MAP-киназой p38 при воспалении. Nature 386 , 296–299 (1997).
CAS Статья Google ученый
Молкентин, Дж. Д. и др. . Кальциневрин-зависимый путь транскрипции для сердечной гипертрофии. Cell 93 , 215–228 (1998).
CAS Статья Google ученый
Такахаши, Н. и др. . Гипертрофические стимулы вызывают экспрессию трансформирующего фактора роста-β1 в миоцитах желудочков крыс. J. Clin. Вкладывать деньги. 94 , 1470–1476 (1994).
CAS Статья Google ученый
Брэнд, Т. и Шнайдер, М.Д. Суперсемейство TGFβ в миокарде: лиганды, рецепторы, трансдукция и функция. J. Mol. Cell. Кардиол. 27 , 5–18 (1995).
CAS Статья Google ученый
Комуро, И. и др. . Растяжение сердечных миоцитов стимулирует экспрессию протоонкогенов. J. Biol. Chem. 265 , 5391–5398 (1990).
Google ученый
Wang, N., Butler, J.P. & Ingber, D.E. Механотрансдукция по поверхности клетки и через цитоскелет. Наука 260 , 1124–1127 (1993).
CAS Статья Google ученый
Лоус, Б.D и др. . Изменения экспрессии генов в интактном сердце человека. J. Clin. Вкладывать деньги. 100 , 2315–2324 (1997).
CAS Статья Google ученый
Накао, К., Минобе, В., Роден, Р., Бристоу, М.Р. и Лейнванд, Л.А. Экспрессия гена тяжелой цепи миозина при сердечной недостаточности человека. J. Clin. Вкладывать деньги. 100 , 2362–2370 (1997).
CAS Статья Google ученый
Депре, К., Шипли, Г.Л., Дэвис, П.Дж., Фрейзер, О. & Taegtmeyer, H. Экспрессия изоформы переносчика глюкозы в сердечной недостаточности человека. Тираж (в печати).
Кац, А.М. Кардиомиопатия перегрузки. Главный фактор, определяющий прогноз при застойной сердечной недостаточности. N. Engl. J. Med. 322 , 100–110 (1990).
CAS Статья Google ученый
Olivieri, N.F. и др. . Лечение большой талассемии фенилбутиратом и гидроксимочевиной. Ланцет 350 , 491–492 (1997).
CAS Статья Google ученый
Деконинк, Н. и др. . Экспрессия усеченного атрофина приводит к значительным функциональным улучшениям в мышцах мышей с дефицитом дистрофина. Nature Med. 3 , 1216–1221 (1997).
CAS Статья Google ученый
Хейд, К.А., Стивенс, Дж., Ливак, К.Дж. И Уильямс, П. Количественная ПЦР в реальном времени. Genome Res. 6 , 986–994 (1996).
CAS Статья Google ученый
Gibson, U.E.M., Heid, C.A. И Уильямс, П. Новый метод количественной ОТ-ПЦР в реальном времени. Genome Res. 6 , 995–1001 (1996).
CAS Статья Google ученый
Хомчинский, П.& Сакки, Н. Одностадийный метод выделения РНК кислотной экстракцией тиоцианата гуанидия, фенола и хлороформа. Анал. Biochem. 162 , 159–169 (1987).
Артикул Google ученый
Laborda, J. кДНК 36B4, используемая в качестве эстрадиол-независимого контроля мРНК, представляет собой кДНК для кислотного рибосомного фосфопротеина человека PO. Nucleic Acid Res. 19 , 3998 (1991).
CAS Статья Google ученый
Патологическая гипертрофия желудочков у потомков диабетических матерей: ретроспективное исследование | Европейский журнал сердца
Цели Сахарный диабет у беременных увеличивается, а вместе с ним и осложнения у их потомства.Мы изучили нашу популяцию диабетических матерей (2003–2005 гг.) На предмет патологической гипертрофии желудочков (ПВГ).
Методы и результаты В нашем ретроспективном исследовании всех 87 диабетических беременностей (92 новорожденных) 16 были 1-го типа, 17 — 2-го типа и 54 — гестационного диабета (GD). Медиана гликированного гемоглобина (HbA1c) составила 5,8% (5,3-6,5): 17 с HbA1c выше нормы, 2 с врожденным пороком сердца (ВПС) и шесть с PVH. В общей сложности 75 новорожденных были нормальными, у 5 была ИБС, а у 12 — ПВГ (1/12 умерло послеродовым, 1/12 мертворожденным, 2/12 потребовались преждевременные роды, 8/12 — нормальные).16 беременностей типа 1 привели к трем новорожденным с ИБС и 50% ПВГ, в том числе одна смерть, одно преждевременное кесарево сечение из-за ПВГ. У 17 новорожденных от беременностей 2 типа выявлена одна ВПС и 25% ПВГ. Из 54 беременностей с БГ у одной была ИБС, а у одной — ПВГ.
Заключение Беременности с диабетом 1 и 2 типа несут повышенный риск развития ПВГ у плода по сравнению с беременностями с БГ. Недостаточный эффект профилактических мер контроля гликемии позволяет сделать вывод о том, что, хотя не могут быть представлены определенные прогностические параметры для злокачественного исхода, тщательный мониторинг этих беременностей может предотвратить перинатальные катастрофы.
Введение
Сахарный диабет представляет значительный риск для плода, если присутствует у беременных женщин. До сих пор отчеты были сосредоточены преимущественно на популяции матерей с диабетом 1 типа. 1–9 Появляется все больше доказательств того, что плоды матерей с диабетом 2 типа могут быть предрасположены к аналогичной патологии, вызывающей осложнения во множестве систем органов плода и плаценты. 10–19 Если это подтвердится, это станет серьезной проблемой и может изменить нынешний подход к пренатальной диагностике.Наше исследование будет сосредоточено на последствиях всех типов материнского диабета на развитие сердца плода.
Сердце плода находится под двойной угрозой. Во-первых, в начале беременности заболевание оказывает тератогенное действие, нарушается кардиогенез при правильной экспрессии генов, кодирующих развитие сердца. 20,21 Для выявления этих патологий обычно рекомендуется ранний пренатальный кардиологический скрининг на сроке от 12 до 16 недель беременности. Частота пороков сердца составляет 3–6% от потомства, 22 в пять раз выше, чем при нормальной беременности, и часто включает сложные поражения. 1,4–5 Во-вторых, начиная с конца второго или начала третьего триместра, у плода может возникнуть патологическая гипертрофия желудочков (ПВГ), обычно называемая гипертрофической кардиомиопатией. 3,4 Требуется дополнительное эхографическое исследование в третьем триместре беременности. ПВГ характеризуется увеличением сердца; точнее, непропорциональная гипертрофия перегородки и / или свободных стенок желудочков. При микроскопическом исследовании выявляются гипертрофические волокна и участки клеточного беспорядка.Этиология этой сердечной аномалии не совсем ясна, но предполагается, что гиперинсулинизм плода может вызвать гиперплазию и гипертрофию миокардиальных клеток за счет увеличения синтеза жира и белка. 23,24 Это состояние может быть симптоматическим, а может и не быть. В большинстве случаев гипертрофическое сердце постепенно возвращается к нормальному размеру в первые месяцы после рождения. Однако у некоторых пациентов развивается тяжелая перинатальная сердечная дисфункция, и они могут умереть. 25–27
В нескольких исследованиях предполагалось снижение частоты осложнений за счет строгого контроля гликемии у будущих матерей.Это привело к улучшению показателей гликемии и положительному влиянию на частоту врожденных пороков сердца, 28,29 , но не обязательно при позднем развитии гипертрофической кардиомиопатии. Это приводит нас к гипотезе о том, что, хотя не могут быть представлены определенные прогностические параметры 25–27,30–37 для гибели плода или злокачественного исхода, тщательный мониторинг сердца плода во время этих беременностей может быть полезным для предотвращения перинатальных катастроф. Чтобы оценить риск врожденного порока сердца (ВПС) и / или ЛВГ у плода, мы изучили популяцию матерей со всеми типами диабета, хорошо контролируемых в отношении их гликемии, проходящей через наше перинатальное отделение в период с 2003 по 2005 год.
Методы
Субъекты и протокол
Это ретроспективное исследование включает всех потомков матерей с диабетом, проходящих через перинатальное отделение Centre Hospitalier Universitaire Vaudois в Лозанне, Швейцария. Критерием включения был известный диагноз материнского диабета 1 или 2 типа или гестационного диабета (GD), получавший только диету или связанный с временной инсулиновой терапией. Также были включены все младенцы, матери которых соответствовали этим критериям, поступившие в наше неонатальное отделение в период с 1 января 2003 г. по 31 декабря 2005 г.
Население насчитывало 87 беременностей, из них 5 беременностей имели двойню. Данные, включенные в исследование, включали пренатальную эхокардиографию, типы инсулиновой терапии, контроль гликемии [гликированный гемоглобин (HbA1c)], детали родов, послеродовые состояния и последующее эхокардиографическое наблюдение до выписки. Критерии эхографической диагностики ПВГ основаны на толщине стенки, нормированной на размер тела.
Статистический анализ
Описательную статистику проводили с помощью компьютерной программы StatView 5.0.1 (Институт SAS, США). Непрерывные переменные были выражены в медианах и межквартильных диапазонах и сравнивались с использованием непарного сравнения t -теста (для нормально распределенных переменных), теста Манна-Уитни U (для ненормально распределенных переменных) и точного критерия Фишера ( категориальные ценности). Категориальные переменные выражались в процентах. Статистически значимым считалось значение P <0,05.
Результаты
Исходные данные по всем беременностям, включенным в исследование, представлены в таблице .Из 87 беременностей средний возраст составлял 34 года, 29–38 средний индекс массы тела (ИМТ) 28 кг / м 2 , 23–34 62 (71%) матери были европеоидной расы, 10 (11%) ) Африканцы, шесть (7%) азиатов, шесть (7%) выходцев из Латинской Америки, 37 (43%) первородящих, 19 (22%) первородящих и 26 (30%) многоплодных. Диабет 1 типа был диагностирован у 16, диабет 2 типа — у 17, а БГ — у 54 будущих матерей, из которых 38 лечились инсулином. Лечение инсулином проводилось 11 женщинам с помощью инсулиновой помпы и 60 — путем подкожной инъекции инсулина.В 16 случаях лечение заключалось только в соблюдении диеты. Медиана HbA1c составила 5,8% (5,3–6,5). Из 17 пациентов с HbA1c выше нормы (диапазон 6,5–10,5%) у двоих была ИБС: один дефект межпредсердной перегородки II (ASD II), один синдром гипоплазии левого сердца (HLHS) и шесть PVH.
Таблица 1Исходные данные для матерей с диабетом и перинатальный исход
| . | Сахарный диабет 1 типа . | Сахарный диабет 2 типа . | ГД . | P -значение . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| N | 16 | 17 | 54 | |||||||
| Возраст | 32 (26–36) | 34 (33–39) | 301453) 33,50,173 * | |||||||
| 0,432 ** | ||||||||||
| BMI | 24 (22–32) | 33.4 (29–35) | 27,1 (23–31) | 0,449 * | ||||||
| 0,007 ** | ||||||||||
| Происхождение | 56 56 Кавказский | 16 (100) | 10 (59) | 36 (67) a | > 0,05 | |||||
| Африканский | 0 | 4 (24) | 6 (11) a | > 0.05 | ||||||
| Азиатский | 0 | 2 (12) | 4 (7) a | > 0,05 | ||||||
| Испаноязычный | 0 | 1 (6) | 75 a> 0,05 | |||||||
| Четность | ||||||||||
| Нуллипара | 8 (50) | 4 (24) | 9145 | 5 (31) | 5 (29) | 14 (26) | > 0.05 | |||
| Мультипара | 3 (19) | 8 (47) | 15 (28) | > 0,05 | ||||||
| HbA1c | 6,6 (6,1–7,9) | ,3) 6,28 (5,814–5,86) | 5,4 (5,0–5,8) | <0,001 * | ||||||
| 0,02 ** | ||||||||||
| Тип лечения | 14 | 14 | 9 (56) | 1 (6) | 1 (2) | 0.022 | ||||
| Инсулин подкожный | 7 (44) | 16 (94) | 37 (69) | 0,035 | ||||||
| Диета | 0 | 0 | 14 | 14 9145 9145 9145 914 914 914 914 | ||||||
| Осложнения во время беременности: | ||||||||||
| Преэклампсия | 2 (13) | 0 | 3 (5) | 0,303 | 7 (47) | 33 (59) | 0.121 | |||
| Перинатальный исход b | ||||||||||
| Недоношенность | 8 (47) | 7 (39) | 1914 914 914 914 9145 914 914 914 914 9145 914 914 914 914 914 914 914 914 914 в | 6 (35) | 5 (28) | 13 (23) | 0,37 | |||
| CHD | 3 (18) | 1 (6) | 1 (2) | 0,04 | ||||||
| Смертность от ИБС 1 | 2 (13) | 0 | 0 | > 0.05 | ||||||
| PVH | 7 (41) | 4 (22) | 1 (2) | <0,001 | ||||||
| PVH Смертность 2 | 1 (6) | 1 (6) | 0,189 | |||||||
| Гипогликемия | 10 (59) | 9 (50) | 29 (51) | 0,83 | ||||||
| Респираторный дистресс | 7 (41) | (37) | 0,241 |
| . | Сахарный диабет 1 типа . | Сахарный диабет 2 типа . | ГД . | P -значение . | |||||
|---|---|---|---|---|---|---|---|---|---|
| N | 16 | 17 | 54 | ||||||
| Возраст | 32 (26–36) | 34 (33–39) | 301453) 33,50,173 * | ||||||
| 0.432 ** | |||||||||
| ИМТ | 24 (22–32) | 33,4 (29–35) | 27,1 (23–31) | 0,449 * | |||||
| 914 * | |||||||||
| Происхождение | |||||||||
| Кавказский | 16 (100) | 10 (59) | 36 (67) a | 0 | 4 (24) | 6 (11) a | > 0.05 | ||
| Азиатский | 0 | 2 (12) | 4 (7) a | > 0,05 | |||||
| Испаноязычный | 0 | 1 (6) | 75 a> 0,05 | ||||||
| Четность | |||||||||
| Нуллипара | 8 (50) | 4 (24) | 9145 | 5 (31) | 5 (29) | 14 (26) | > 0.05 | ||
| Мультипара | 3 (19) | 8 (47) | 15 (28) | > 0,05 | |||||
| HbA1c | 6,6 (6,1–7,9) | ,3) 6,28 (5,814–5,86) | 5,4 (5,0–5,8) | <0,001 * | |||||
| 0,02 ** | |||||||||
| Тип лечения | 14 | 14 | 9 (56) | 1 (6) | 1 (2) | 0.022 | |||
| Инсулин подкожный | 7 (44) | 16 (94) | 37 (69) | 0,035 | |||||
| Диета | 0 | 0 | 14 | 14 9145 9145 9145 914 914 914 914 | |||||
| Осложнения во время беременности: | |||||||||
| Преэклампсия | 2 (13) | 0 | 3 (5) | 0,303 | 7 (47) | 33 (59) | 0.121 | ||
| Перинатальный исход b | |||||||||
| Недоношенность | 8 (47) | 7 (39) | 1914 914 914 914 9145 914 914 914 914 9145 914 914 914 914 914 914 914 914 914 в | 6 (35) | 5 (28) | 13 (23) | 0,37 | ||
| CHD | 3 (18) | 1 (6) | 1 (2) | 0,04 | |||||
| Смертность от ИБС 1 | 2 (13) | 0 | 0 | > 0.05 | |||||
| PVH | 7 (41) | 4 (22) | 1 (2) | <0,001 | |||||
| PVH Смертность 2 | 1 (6) | 1 (6) | 0,189 | ||||||
| Гипогликемия | 10 (59) | 9 (50) | 29 (51) | 0,83 | |||||
| Респираторный дистресс | 7 (41) | (37) | 0,241 |
Исходные данные для диабетических матерей и перинатальный исход
| . | Сахарный диабет 1 типа . | Сахарный диабет 2 типа . | ГД . | P -значение . | |||||
|---|---|---|---|---|---|---|---|---|---|
| N | 16 | 17 | 54 | ||||||
| Возраст | 32 (26–36) | 34 (33–39) | 301453) 33,50,173 * | ||||||
| 0.432 ** | |||||||||
| ИМТ | 24 (22–32) | 33,4 (29–35) | 27,1 (23–31) | 0,449 * | |||||
| 914 * | |||||||||
| Происхождение | |||||||||
| Кавказский | 16 (100) | 10 (59) | 36 (67) a | 0 | 4 (24) | 6 (11) a | > 0.05 | ||
| Азиатский | 0 | 2 (12) | 4 (7) a | > 0,05 | |||||
| Испаноязычный | 0 | 1 (6) | 75 a> 0,05 | ||||||
| Четность | |||||||||
| Нуллипара | 8 (50) | 4 (24) | 9145 | 5 (31) | 5 (29) | 14 (26) | > 0.05 | ||
| Мультипара | 3 (19) | 8 (47) | 15 (28) | > 0,05 | |||||
| HbA1c | 6,6 (6,1–7,9) | ,3) 6,28 (5,814–5,86) | 5,4 (5,0–5,8) | <0,001 * | |||||
| 0,02 ** | |||||||||
| Тип лечения | 14 | 14 | 9 (56) | 1 (6) | 1 (2) | 0.022 | |||
| Инсулин подкожный | 7 (44) | 16 (94) | 37 (69) | 0,035 | |||||
| Диета | 0 | 0 | 14 | 14 9145 9145 9145 914 914 914 914 | |||||
| Осложнения во время беременности: | |||||||||
| Преэклампсия | 2 (13) | 0 | 3 (5) | 0,303 | 7 (47) | 33 (59) | 0.121 | ||
| Перинатальный исход b | |||||||||
| Недоношенность | 8 (47) | 7 (39) | 1914 914 914 914 9145 914 914 914 914 9145 914 914 914 914 914 914 914 914 914 в | 6 (35) | 5 (28) | 13 (23) | 0,37 | ||
| CHD | 3 (18) | 1 (6) | 1 (2) | 0,04 | |||||
| Смертность от ИБС 1 | 2 (13) | 0 | 0 | > 0.05 | |||||
| PVH | 7 (41) | 4 (22) | 1 (2) | <0,001 | |||||
| PVH Смертность 2 | 1 (6) | 1 (6) | 0,189 | ||||||
| Гипогликемия | 10 (59) | 9 (50) | 29 (51) | 0,83 | |||||
| Респираторный дистресс | 7 (41) | (37) | 0,241 |
| . | Сахарный диабет 1 типа . | Сахарный диабет 2 типа . | ГД . | P -значение . | |||||
|---|---|---|---|---|---|---|---|---|---|
| N | 16 | 17 | 54 | ||||||
| Возраст | 32 (26–36) | 34 (33–39) | 301453) 33,50,173 * | ||||||
| 0.432 ** | |||||||||
| ИМТ | 24 (22–32) | 33,4 (29–35) | 27,1 (23–31) | 0,449 * | |||||
| 914 * | |||||||||
| Происхождение | |||||||||
| Кавказский | 16 (100) | 10 (59) | 36 (67) a | 0 | 4 (24) | 6 (11) a | > 0.05 | ||
| Азиатский | 0 | 2 (12) | 4 (7) a | > 0,05 | |||||
| Испаноязычный | 0 | 1 (6) | 75 a> 0,05 | ||||||
| Четность | |||||||||
| Нуллипара | 8 (50) | 4 (24) | 9145 | 5 (31) | 5 (29) | 14 (26) | > 0.05 | ||
| Мультипара | 3 (19) | 8 (47) | 15 (28) | > 0,05 | |||||
| HbA1c | 6,6 (6,1–7,9) | ,3) 6,28 (5,814–5,86) | 5,4 (5,0–5,8) | <0,001 * | |||||
| 0,02 ** | |||||||||
| Тип лечения | 14 | 14 | 9 (56) | 1 (6) | 1 (2) | 0.022 | |||
| Инсулин подкожный | 7 (44) | 16 (94) | 37 (69) | 0,035 | |||||
| Диета | 0 | 0 | 14 | 14 9145 9145 9145 914 914 914 914 | |||||
| Осложнения во время беременности: | |||||||||
| Преэклампсия | 2 (13) | 0 | 3 (5) | 0,303 | 7 (47) | 33 (59) | 0.121 | ||
| Перинатальный исход b | |||||||||
| Недоношенность | 8 (47) | 7 (39) | 1914 914 914 914 9145 914 914 914 914 9145 914 914 914 914 914 914 914 914 914 в | 6 (35) | 5 (28) | 13 (23) | 0,37 | ||
| CHD | 3 (18) | 1 (6) | 1 (2) | 0,04 | |||||
| Смертность от ИБС 1 | 2 (13) | 0 | 0 | > 0.05 | |||||
| PVH | 7 (41) | 4 (22) | 1 (2) | <0,001 | |||||
| PVH Смертность 2 | 1 (6) | 1 (6) | 0,189 | ||||||
| Гипогликемия | 10 (59) | 9 (50) | 29 (51) | 0,83 | |||||
| Респираторный дистресс | 7 (41) | (37) | 0,241 |
Преждевременные роды произошли в 34 из 87 беременностей, две из которых были вызваны тяжелым половым гепатитом.Кесарево сечение (кесарево сечение) было выполнено в 53 (61%) случаях, в девяти (10%) из-за диабетических осложнений (подозрение на макросомию, диабетическую декомпенсацию и преждевременные роды) и в пяти (6%) из-за преэклампсии. . Одна беременность была прервана из-за пороков развития сердца и почек (HLHS и почечная дисплазия), а одна макросомная мертворожденная с гипертрофией сердца, диагностированной при вскрытии. Макросомия, определяемая как масса тела при рождении выше 90 процентиля, возникла у 24 новорожденных. Лечение гипогликемии потребовалось 48 новорожденным, у 36 пациентов наблюдалась респираторная недостаточность.Постнатальная эхокардиография была нормальной у 75 (82%) новорожденных. У пяти (5%) новорожденных была ИБС, у одного был двойной выход правого желудочка (DORV), один дефект межжелудочковой перегородки (VSD), одна тетралогия Фалло (TOF), один HLHS, все четыре диагностированы пренатально, и один ASD вторичного типа (ASD II). TOF умер вскоре после рождения из-за тяжелой недоношенности, связанной с пороком сердца. Одно прерывание было выполнено из-за антенатального диагноза сочетания HLHS и почечной дисплазии.
Исход 12 новорожденных (13%), родившихся с ПВГ, приведен в таблице , таблица 2 .
Таблица 2Исход 12 новорожденных, родившихся с PVH
| Пациент . | Происхождение . | Рождение . | Тип диабета . | HcA1c среднее (диапазон) . | Вес (г) . | Апгар . | Эволюция . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Африканский | Недоношенный | Тип 1 | 6,9 | 3200 (P90) | Апгар 7/9/10 | Живой | |||||||
| Тип 1 | 4680 (> P90) | Апгар 0/0/1 | Мертвый | |||||||||||
| 3 | Кавказский | Преждевременный | Тип 1 | / 8/9 | Жив | |||||||||
| 4 | Кавказский | Недоношенный | Тип 1 | 9.5 | 2500 (> P90) | Апгар 5/9/10 | Жив | |||||||
| 5 | Кавказский | Недоношенный | Тип 1 | 7,8 | 3710 (> P90) | /514 / 8Живой | ||||||||
| 6 | Кавказский | При сроке | Тип 1 | 3480 (P50–90) | Апгар 5/7/8 | Живой | 71436 | КавказскийНедоношенный | Тип 1 | 7 (6–8) | 1990 (P50–90) | Апгар 2/7/8 | Жив | |
| 8 | Кавказский | Недоношенный | 7.8 | 3370 (> P90) | Апгар 7/8/9 | Живой | ||||||||
| 9 | Кавказский | При сроке | Тип 2 | 6 | 4400 (> P1490) | 9 9/9Живой | ||||||||
| 10 | Африканский | При сроке | Тип 2 | 8,56 (6,4–10,5) | 4750 (> P90) | Апгар 9/10/10 | 14 Жив | |||||||
| 11 | Кавказский | Мертворожденный в возрасте 35 недель | Тип 2 | 4.9 | 3810 (> P90) | Апгар 0/0/0 | Мертвый | |||||||
| 12 | Южноамериканский | При сроке | GD | 5,6 | 2510 ( | Жив |
| Пациент . | Происхождение . | Рождение . | Тип диабета . | HcA1c среднее (диапазон) . | Вес (г) . | Апгар . | Эволюция . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Африканский | Недоношенный | Тип 1 | 6,9 | 3200 (P90) | Апгар 7/9/10 | Живой | |||||||
| Тип 1 | 4680 (> P90) | Апгар 0/0/1 | Мертвый | |||||||||||
| 3 | Кавказский | Преждевременный | Тип 1 | / 8/9 | Жив | |||||||||
| 4 | Кавказский | Недоношенный | Тип 1 | 9.5 | 2500 (> P90) | Апгар 5/9/10 | Жив | |||||||
| 5 | Кавказский | Недоношенный | Тип 1 | 7,8 | 3710 (> P90) | /514 / 8Живой | ||||||||
| 6 | Кавказский | При сроке | Тип 1 | 3480 (P50–90) | Апгар 5/7/8 | Живой | 71436 | КавказскийНедоношенный | Тип 1 | 7 (6–8) | 1990 (P50–90) | Апгар 2/7/8 | Жив | |
| 8 | Кавказский | Недоношенный | 7.8 | 3370 (> P90) | Апгар 7/8/9 | Живой | ||||||||
| 9 | Кавказский | При сроке | Тип 2 | 6 | 4400 (> P1490) | 9 9/9Живой | ||||||||
| 10 | Африканский | При сроке | Тип 2 | 8,56 (6,4–10,5) | 4750 (> P90) | Апгар 9/10/10 | 14 Жив | |||||||
| 11 | Кавказский | Мертворожденный в возрасте 35 недель | Тип 2 | 4.9 | 3810 (> P90) | Апгар 0/0/0 | Мертвый | |||||||
| 12 | Южноамериканский | При сроке | GD | 5,6 | 2510 ( | Жив |
Исход 12 новорожденных, родившихся с PVH
| Пациент . | Происхождение . | Рождение . | Тип диабета . | HcA1c среднее (диапазон) . | Вес (г) . | Апгар . | Эволюция . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Африканский | Недоношенный | Тип 1 | 6,9 | 3200 (P90) | Апгар 7/9/10 | Живой | |||||||
| Тип 1 | 4680 (> P90) | Апгар 0/0/1 | Мертвый | |||||||||||
| 3 | Кавказский | Преждевременный | Тип 1 | / 8/9 | Жив | |||||||||
| 4 | Кавказский | Недоношенный | Тип 1 | 9.5 | 2500 (> P90) | Апгар 5/9/10 | Жив | |||||||
| 5 | Кавказский | Недоношенный | Тип 1 | 7,8 | 3710 (> P90) | /514 / 8Живой | ||||||||
| 6 | Кавказский | При сроке | Тип 1 | 3480 (P50–90) | Апгар 5/7/8 | Живой | 71436 | КавказскийНедоношенный | Тип 1 | 7 (6–8) | 1990 (P50–90) | Апгар 2/7/8 | Жив | |
| 8 | Кавказский | Недоношенный | 7.8 | 3370 (> P90) | Апгар 7/8/9 | Живой | ||||||||
| 9 | Кавказский | При сроке | Тип 2 | 6 | 4400 (> P1490) | 9 9/9Живой | ||||||||
| 10 | Африканский | При сроке | Тип 2 | 8,56 (6,4–10,5) | 4750 (> P90) | Апгар 9/10/10 | 14 Жив | |||||||
| 11 | Кавказский | Мертворожденный в возрасте 35 недель | Тип 2 | 4.9 | 3810 (> P90) | Апгар 0/0/0 | Мертвый | |||||||
| 12 | Южноамериканский | При сроке | GD | 5,6 | 2510 ( | Жив |
| Пациент . | Происхождение . | Рождение . | Тип диабета . | HcA1c среднее (диапазон) . | Вес (г) . | Апгар . | Эволюция . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Африканский | Недоношенный | Тип 1 | 6,9 | 3200 (P90) | Апгар 7/9/10 | Живой | |||||||
| Тип 1 | 4680 (> P90) | Апгар 0/0/1 | Мертвый | |||||||||||
| 3 | Кавказский | Преждевременный | Тип 1 | / 8/9 | Жив | |||||||||
| 4 | Кавказский | Недоношенный | Тип 1 | 9.5 | 2500 (> P90) | Апгар 5/9/10 | Жив | |||||||
| 5 | Кавказский | Недоношенный | Тип 1 | 7,8 | 3710 (> P90) | /514 / 8Живой | ||||||||
| 6 | Кавказский | При сроке | Тип 1 | 3480 (P50–90) | Апгар 5/7/8 | Живой | 71436 | КавказскийНедоношенный | Тип 1 | 7 (6–8) | 1990 (P50–90) | Апгар 2/7/8 | Жив | |
| 8 | Кавказский | Недоношенный | 7.8 | 3370 (> P90) | Апгар 7/8/9 | Живой | ||||||||
| 9 | Кавказский | При сроке | Тип 2 | 6 | 4400 (> P1490) | 9 9/9Живой | ||||||||
| 10 | Африканский | При сроке | Тип 2 | 8,56 (6,4–10,5) | 4750 (> P90) | Апгар 9/10/10 | 14 Жив | |||||||
| 11 | Кавказский | Мертворожденный в возрасте 35 недель | Тип 2 | 4.9 | 3810 (> P90) | Апгар 0/0/0 | Мертвый | |||||||
| 12 | Южноамериканский | При сроке | GD | 5,6 | 2510 ( | Жив |
Два показали катастрофическую эволюцию после тяжелого PVH:
У одного пациента с диабетом 1 типа под подкожной инсулиновой помпой была диабетическая декомпенсация на 35 неделе [гидрамнион (индекс амниотической жидкости 25), патологическая кардиотокограмма (КТГ) (гипореактивность) и высокий уровень глюкозы (8.52–10 ммоль / л)]. У матери появились отеки, она прибавила в весе на 36 неделе. Повторная КТГ ухудшилась (микроколебания) и усилилось слезотечение (AFI 30–32). После кесарева сечения на 37 неделе новорожденный был гипотоническим, ареактивным и синюшным (Апгар 0/0/1, 4,68 кг> 95-й процентиль), что потребовало реанимации и перевода в неонатальное отделение. Эхокардиография выявила PVH с тяжелой гипертрофией межжелудочковой перегородки и задней стенки левого желудочка (IVS: 11,9, LVPW: 12,1), трикуспидальную недостаточность, выявляющую надсистемную легочную гипертензию с шунтированием справа налево через открытый артериальный проток (PDA).Сердечная недостаточность приводит к смерти новорожденного через несколько часов после прибытия. Патологоанатомические исследования включают кардиомегалию (64,2 г, норма: 23 ± 8 г), гипертрофию бивентрикулов, дилатацию правого предсердия и фиброэластоз.
У одной пациентки с ИМТ 30 кг / м 2 , направленной по поводу гестационного зуда, во время госпитализации был диагностирован БГ (средний HbA1c: 4,9%), который позже оказался типом 2 сахарный диабет и подозрение на макросомный плод. Инсулинотерапия была предложена, но отменена из-за преждевременного разрыва мембраны и гибели плода на 35 неделе беременности.Вскрытие показало макросомный мертворожденный с увеличенным сердцем (31,7 г, нормальное: 13,4 ± 3,9 г), включая расширенный левый желудочек с фиброэластозом и гипертрофией двух желудочков.
Три следующих пациента показали благоприятное развитие, но требовали тщательного наблюдения:
Один пациент с диабетом 1 типа (ИМТ 25 кг / м 2 2 ), получавший инсулиновую помпу (среднее значение HbA1c: 6,9%), показал эхографию. макросомный плод, легкое гидрамнион (AFI 24), констриктивная гипертрофия перегородки 8 мм и небольшой выпот в перикард на 36-й неделе ( Рисунок 1 ).Следовательно, роды через естественные родовые пути были вызваны преждевременно. Новорожденный показал хорошую адаптацию (Апгар 7/9/10, 3,2 кг = 90 процентиль), но был переведен в реанимацию из-за ПВГ. Первое УЗИ подтвердило умеренную гипертрофию правого желудочка и перегородки (4,6 и 5 мм соответственно) и ОАП. Через 2 дня сердечная деятельность улучшилась. Последующее эхокардиографическое наблюдение показало нормализацию размера МЖП (5 мм, все еще незначительно увеличено) и уменьшение диаметра МЖП (3.3 мм) через месяц, что позволило выписаться из дальнейшего кардиологического наблюдения.
Один пациент с диабетом 2 типа с ожирением (ИМТ: 49 кг / м 2 2 ), получавший инсулин (средний HbA1c: 7,8%), прошел ультразвуковой контроль, который показал макросомный плод с прогрессирующей тяжелой гипертрофией сердца перегородки на 36-м году жизни. неделю, что потребовало преждевременных родов. При рождении новорожденный был гипореактивным, но улучшился кислородный режим (Апгар 7/8/9, 3,4 кг> 90-й процентиль). Необструктивная гипертрофия перегородки 11 мм подтверждена ультразвуком.У новорожденного сохранялось стабильное кровообращение, и контрольные наблюдения показали медленное уменьшение диаметра перегородки через 4 (8,6 мм) и 15 месяцев (6,7 мм).
Одна женщина, страдающая диабетом 2 типа с 3 лет, показала хороший гликемический контроль (средний HbA1c: 6) до того, как ей потребовалась подкожная инсулиновая терапия с 31-й недели. Эхокардиографический контроль выявил макросомный плод с гипертрофией перегородки 5 мм на 34 неделе. Кесарево сечение было выполнено на 39 неделе.Новорожденный (Апгар 9/9/9, 4,4 кг> 90-й процентиль) имел респираторный дистресс-синдром и сердечный шум 2/6. Умеренная гипертрофия ЛЖ без субаортальной обструкции была отмечена эхокардиографически и нормализовалась через 3 месяца (4,2 мм).
Рисунок 1
( A ) Пренатальное двумерное эхокардиографическое изображение, показывающее утолщение сердечной перегородки (8 мм) и небольшой выпот в перикард; ( B ) Постнатальное двухмерное эхокардиографическое изображение тяжелой межжелудочковой гипертрофии (RVAW, передняя стенка правого желудочка).
Рис. 1
( A ) Пренатальное двумерное эхокардиографическое изображение, показывающее утолщение сердечной перегородки (8 мм) и небольшой выпот в перикард; ( B ) Постнатальное двухмерное эхокардиографическое изображение тяжелой межжелудочковой гипертрофии (RVAW, передняя стенка правого желудочка).
Семь новорожденных с ПВГ прошли относительно ничем не примечательное течение:
Мать с синдромом HELLP на 34 неделе родила недоношенного, макросомного, полнокровного и эритродермического новорожденного (Апгар 5/8/9, 3.25 кг> 90-й процентиль) и страдала гипогликемией до стабилизации состояния. Эхокардиографический диагноз: гипертрофическая кардиомиопатия перегородки (4,4 мм).
У двух пациентов была диабетическая декомпенсация [среднее HbA1c: 9,5% (первый), 7% (второй)] и угроза преждевременных родов. Один был доставлен на 32 неделе (Апгар 5/9/10, 2,5 кг> 90-й процентиль), а другой — на 31 неделе (Апгар 2/7/8, 1,99 кг, 50–90-й процентиль). У обоих развился синдром влажного легкого и гипогликемия, а также эхокардиографическая гипертрофия перегородки сердца (4.2 и 2,3 мм соответственно).
У четырех новорожденных были только легкие кардиомиопатические признаки:
У одного ребенка при рождении был назначен Апгар 7/9/9, вес 2,53 кг (<10 процентилей). Однако насыщенность оставалась ниже 75%. На рентгенограмме грудной клетки отмечена кардиомегалия, гипертрофия перегородки сердца подтверждена с помощью эхокардиографии.
У второго была плохая неонатальная адаптация с респираторным дистресс-синдромом (Апгар 5/7/8, 3.48 кг 50–90-й процентиль). Эхокардиография показала необструктивную гипертрофию бивентрикулов (IVS: 7,5 мм, LVPW: 3,9 мм) с митральной (2/4), аортальной (1/4) и трикуспидальной недостаточностью (2/4). Присутствовали асцит и плевральный выпот. После начала терапии NO через 4 дня произошла благоприятная эволюция.
У третьего была асфиксия, сопровождавшаяся центральным цианозом (Апгар 4/5/8, 3,7 кг> 90 перцентиля). Эхокардиография показала значительную необструктивную гипертрофию бивентрикулов, преобладающую в межжелудочковой перегородке (IVS: 6.6 мм, LVPW: 3,9 мм) с сердечными гиперкинезами.
Последний пациент имел хорошее состояние при рождении (Апгар 9/10/10, 4,75 кг> 90-й процентиль), но с сердечным шумом. Эхокардиография подтвердила гипертрофию перегородки (10 мм).
Распределение всех пациентов с материнским диабетом
Исходные данные для матерей-диабетиков и перинатальные исходы приведены в таблице , .Среднее значение HbA1c в каждой группе матерей с разными типами диабета показано на , рис. 2 .
Рис. 2
Среднее значение HbA1c в каждой группе матерей с разными типами диабета, представленное с медианами и межквартильным размахом. Заштрихованный, больной без ПВХ. Серый, больной ПВГ.
Рис. 2
Среднее значение HbA1c в каждой группе матерей с разными типами диабета, представленное с медианами и межквартильным размахом.Заштрихованный, больной без ПВХ. Серый, больной ПВГ.
Диабетическая беременность 1 типа
Шестнадцать беременностей привели к трем новорожденным с ИБС (HLHS, VSD и TOF), одна летальность от PVH, одна беременность с преждевременным родом и шесть PVH со спонтанной регрессией. Остальные шесть пациентов были нормальными.
Диабетическая беременность 2 типа
В результате семнадцати беременностей у одного новорожденного была ИБС (РАС II), у четырех — ПВГ, один из которых родил преждевременно, один родился мертворожденным и 12 были нормальными.
GD беременностей
Пятьдесят четыре беременности с GD привели к одной ИБС (DORV) и одной — с PVH и спонтанной постнатальной регрессией. Пациенту с DORV и гипопластической дугой были запланированы роды, начато лечение простагландином, впоследствии была проведена успешная хирургическая коррекция.
Обсуждение
Инсулиновый диабет или диабет 1 типа обычно считался распространенным в 0,5% беременностей, 38 , но недавние публикации показывают, что этот процент увеличивается в течение последних двух десятилетий, главным образом из-за увеличения числа молодых пациентов, у которых развивается тип 2 сахарный диабет. 12,39–42 Это увеличение может даже оказаться более выраженным, если учесть, что, возможно, существует серая зона для пациентов с диагнозом GD, которые на самом деле могли раньше не замечать диабет 2 типа. 14,43,44 Сердечные осложнения, состоящие из повышенного риска неонатальной ИБС и ЛВГ, являются основной причиной диабетической заболеваемости и смертности плода и новорожденного. 4–5,10,45
PVH можно увидеть при гипертрофической кардиомиопатии (ГКМП), аутосомно-доминантном генетическом заболевании сердца, которое, вероятно, является наиболее часто встречающейся кардиомиопатией.Однако ни у одной из обследованных матерей-диабетиков не было ГКМП или семейной истории этого заболевания. Генетическая причина гипертрофии желудочков у наших внутриутробных пациентов кажется еще более маловероятной, учитывая регресс этой патологии во время последующего наблюдения. Следовательно, мы не использовали терминологию ГКМП плода диабетической матери, а использовали термин ПВГ, чтобы предотвратить вводящее в заблуждение использование и подчеркнуть отличие от классической ГКМП.
Наше ретроспективное исследование показывает большое количество случаев кардиомиопатий, у 5% новорожденных развилась ИБС, а у 13% — ПВГ.Число пациентов с ИБС совпадает с ранее опубликованными исследованиями, касающимися потенциального тератогенного эффекта диабета 20,21 и увеличения заболеваемости ИБС 22 среди потомков диабетических матерей. Менее детальная информация существует о заболеваемости ПВГ. Pildes 46 дает процент 30% HCM у потомков матерей с диабетом 1 типа, но распространенность при беременностях 2 типа и GD гораздо менее известна. Наше исследование отличается, и мы обнаружили относительно большое количество случаев ПВГ: у матерей с диабетом 1 типа почти половина новорожденных страдали от ПВГ и четверть беременностей — с диабетом 2 типа.В целом, мы обнаружили, что процент новорожденных, страдающих ПВГ при беременности у женщин с диабетом 1 и 2 типа, составляет 33%, что намного выше, чем частота ИБС среди той же группы женщин с диабетом (12%). . Более того, смертность от ПВГ в исследуемой популяции относительно высока (1/6 пациентов с ПВГ). Самый низкий риск развития PVH был у новорожденных от матерей с GD, это показывает, что потомки матерей с диабетом 1 и 2 типа имеют значительно повышенный риск развития PVH, хотя мы понимаем, что мы не смогли сравнить это к нормальному населению.
В нашем исследовании группа матерей с БГ показала, что у них не только самый низкий процент новорожденных с ПВГ, но и значительно более низкие значения HbA1c, чем у женщин с ранее существовавшим диабетом. Общепризнано, что в литературе делается упор на жесткий контроль уровня глюкозы. 28 При анализе группы пациентов с ЛВГ и без, мы отмечаем, что первая группа имеет значительно более высокий медианный уровень HbA1c [6,9% (межквартильный размах: 5,9–8,0)], чем вторая [5.7% (межквартильный размах: 5,2–6,3)]. Несмотря на серьезные усилия по созданию хорошо организованной и легкодоступной системы здравоохранения, у 21% наших пациентов уровень HbA1c был выше нормального предела (> 6,4%), что подчеркивает сложность достижения хорошего гликемического контроля — факт, который можно объяснить техническими причинами. трудности с контролем диабета, плохое наблюдение во время беременности, позднее обнаружение БГ, несоблюдение диеты и лечения инсулином, а также позднее направление гинекологом или эндокринологом на конкретную междисциплинарную консультацию высокого риска, а также различные социально-экономический статус и этническая принадлежность могут иметь значение.Однако тревожным фактором является то, что если мы посмотрим на 12 пациентов с PVH, половина из них имела HbA1c ниже, а другая половина выше 7%, что означает, что PVH может развиваться у хорошо и менее хорошо контролируемых пациентов. Мы должны осознавать, что строгий гликемический контроль во время этих беременностей недостаточен для предотвращения возникновения PVH.
Другая проблема касается сердечных последствий диагностики GD для плода или новорожденного. Несмотря на то, что мы обнаружили только одну пациентку в потомстве матерей с БГ, у которых был ГВ, и что этот пациент не имеет никакого значения, мы можем спросить себя, действительно ли у этих женщин БГ или у них еще не диагностировали диабет 2 типа, поскольку ретроспективно наблюдается в некоторых наших случаях.Однако вопрос о том, может ли GD вызывать сердечные осложнения, в настоящее время не решен, и дальнейший скрининг на GDM может помочь решить этот вопрос. 14
Однако серьезным моментом становится тот факт, что если PVH также хорошо развивается у потомков женщин с диабетом 2 типа, наблюдаемое в настоящее время увеличение этого заболевания может вызвать увеличение количества плодов, которым грозит развитие PVH. Более того, в наше исследование включено большое количество женщин с ИМТ намного выше нормы (44%).Это явление отражает всемирную проблему ожирения, которая также присутствует в нашей стране, и подчеркивает проблему увеличения числа новых женщин, у которых диагностирован диабет 2 типа. Это беспокойство подчеркивается эмбриологическими исследованиями на крысах с диабетом, которые показали аналогичный результат у их плодов. 20,21
Возникновение осложнений ПВГ у новорожденных было описано в нескольких клинических случаях, 25–27 , но в литературе мало информации о сериях.При сравнении первых пяти описанных ранее клинических случаев комбинация в конце беременности гидрамниона, тяжелой гипертрофии желудочков и выпота в перикард оказался зловещим признаком. Согласно нашим данным, мы думаем, что эти признаки являются показаниями либо для тщательного наблюдения с помощью более частого эхографического контроля, либо для немедленного вмешательства (индукция или кесарево сечение), предполагая, что своевременный диагноз очень важен, чтобы избежать осложнений и позволяет избежать преждевременного Доставка.
Неотъемлемые ограничения этого исследования включают его ретроспективный аспект и ограниченное количество включенных беременностей. В частности, количество и исход матерей с GD слишком малы, чтобы делать выводы. Это исследование предполагает необходимость проспективного исследования этих женщин из группы высокого риска и их потомков.
В заключение, наличие значительного числа случаев ПВГ у потомков матерей с диабетом 1 и 2 типа, несмотря на усилия по достижению хорошего гликемического контроля, позволяет предположить, что ПВГ остается непреодолимым осложнением у этих пациентов.Это подтверждает заявление Хоторнса 18 о том, что «диабетическая беременность остается состоянием высокого риска, при этом показатели перинатальной смертности и пороков развития плода намного выше, чем у населения спины» и что цель декларации Сент-Винсента 47 от 1989 г., в которой говорится, что результат беременностей, осложненных диабетом, должна быть такой же, как недиабетическая беременность через 5 лет, еще не достигнута. Мы признаем, что не можем предоставить окончательные прогностические параметры гибели плода или злокачественного исхода, но заключаем, что, согласно результатам нашего исследования, тщательный мониторинг этих беременностей может предотвратить перинатальные катастрофы.
Конфликт интересов : не заявлен.
Список литературы
1Schwartz
R
Teramo
KA
Влияние диабетической беременности на плод и новорожденного
Semin Perinatol
2000
24
120
000
000
Marty
F
De Grandi
P
Tissot
JD
Bossart
H
Le livre de l’interne obstétrique
1998
2nd ed.Flammarion
Médecine – Sciences
157
170
3Long
WA
Кардиология плода и новорожденного
1990
Ed.W.B. Saunders Company
137
138
502
503
4Аллан
L
Hornberger
L
Sharland
G
Медиа-карта
Медицинская карта
49
147
350
417
461
462
5Elkayam
U
Gleicher
N
Диагностика сердца и беременность
9 Проблемы с сердечно-сосудистыми заболеваниями при беременности 1998
3-е изд.Нью-Йорк
Wiley-Liss
543
545
713
716
6Suhonen
L
Hiilesmaa
V
9 Teracemo2 пороки развития у женщин с сахарным диабетом I типа
Diabetologia
2000
43
79
82
7Ренни
JM
Робертон
NRCв 4-м издании
, изд.Эдинбург
Черчилль Ливингстон
8Penney
GC
Mair
G
Pearson
DW
Шотландский диабет в группе беременных. исходы беременности у женщин с диабетом 1 типа в Шотландии: национальное популяционное исследование
BJOG
2003
110
315
318
9Evers
IM
de Valk
HW
HW Visser
GHA
Риск осложнений беременности у женщин с диабетом 1 типа: общенациональное проспективное исследование в Нидерландах
BMJ
2004
328
915
918
10 Acolet FlemingK
Bailey
J
Golightly
S
Macintosh
M
Перинатальные исходы и стандарты неонатального ухода за беременными женщинами с диабетом 1 и 2 типа в Ирландии, Северной Ирландии, 2002 г., в Северной Англии, в Англии, 2002 г. / 2003
Конфиденциальное расследование по вопросам здоровья матери и ребенка (CEMACH) Центральный офис
11Pontiroli
AE
Сахарный диабет 2 типа становится наиболее распространенным типом диабета у школьников
Acta Diabetol
2004
41
85
90
12Rosenbloom
J
Молодые
R
Зима
W
Возникающая эпидемия диабета 2 типа у молодежи
Уход за диабетом
1999
22
345
Hanson
U
Bjorklund
A
Hjertberg
R
Eva
N
Nordlander
E
Swahn
Swahn 9000
гестационные нарушения глюкозы не лечатДиабет
2003
7
2107
2111
14Kim
C
Newton
KM
Knopp
RH
Гестационный диабет и система лечения диабета
типа 2.
2002
10
1862
1868
15Decorari
AK
Saxena
A
Singh
M
Srivastava
9000 Оценка мать 9000 DiaArch Dis Child
1989
5
721
724
16Kitzmiller
J
Buchanan
T
Kjos
S
9000Combs
Combs
Combs
Ведение пациентов с диабетом, врожденными пороками развития и спонтанным заболеванием до зачатия США аборты
Уход за диабетом
1996
19
514
541
17Casson
IF
Clarke
CA
Howard
CV
CV
Howard
CV
Pharoah
PO
Platt
MJ
Stanisstreet
M
van Velszen
D
Waltinshaw
S
Результаты в популяции с диабетом в пять лет исследование
BMJ
1997
315
275
278
18Hawthorne
G
Robson
S
Ryall
EA
Ward Platt
MP
Предполагаемое население Исследование исходов беременности у женщин с диабетом: результаты Северного аудита диабетической беременности, 1994
BMJ
1997
315
279
281
19Clausen
TD
Mathiesen
Ekbom
P
Hellmuth
E
Mandrup-Poulsen
T
Damm
P
Плохой исход беременности у женщин с диабетом 2 типа
328
20Molin
DG
Roest
PA
Nordstrand
H
Wisse
LJ
Poelmann
GOTE
000
U0002Нарушенный морфогенез сердечного тракта оттока и повышенная частота аномалий дуги аорты у потомков диабетических крысВрожденные дефекты Res Part A Clin Mol Teratol
2004
Dec
70
927
9000 9000 9000
9000 9000
CM
Gittenberger-De Groot
AC
Wisse
B
Eriksson
UJ
Пороки развития у потомков диабетических крыс: морфометрический анализ воздействия витаминов 9000 на органы нервного гребня 9000 и влияние на нервный гребешок
Тератология2000
61
355
367
22Weatherall
DJ
Ledingham
JGG
Warrell
DA
DA
DA
DA
Oxford
Oxford University Press
23Mehta
A
Hussain
K
Преходящий гиперинсулинизм, связанный с макросомией, гипертрофической обструктивной кардиомиопатией,
0003000000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000822
824
24Veille
JC
Hanson
R
Sivakoff
M
Hoen
H
Внутриутробный размер
Бен 9-Ami
внутримышечный задержка роста и диабетическая беременность
Am J Perinatol
1993
10
275
279
25Sardesai
MG
Grey
AA
McG
McG
Фатальная гипертрофическая кардиомиопатия у плод женщины с сахарным диабетом
Obstet Gynecol
2001
98
925
927
26Franzese
A
Valerio
G
Cipparelli
Iannucci
MP
AlfonsiL
Buono
P
Farina
V
Тяжелая гипертрофическая кардиомиопатия у ребенка от диабетической матери
000 60003
27Leipold
H
Worda
C
Schwindt
J
Kautzky-Willer
A
Bancher-Todesca
D
метаболический контроль
Wien Klin Wochenschr
200 5
117
561
564
28Нельсон
RL
Диабет и беременность: контроль может иметь значение
Mayo Clin Proc
1986
61
80002
Jensen
DM
Damm
P
Moelsted-Pedersen
L
Ovesen
P
Westergaard
JG
000 Beergaard
0003Nieller
0002 NiellerNieller
беременность с диабетом 1 типа
Уход за диабетом
2004
27
2819
2823
30Gutgesell
HP
Speer
ME
HS
Инфографика
Карта HS
матери с диабетомОбращение
1980
61
9 0002 441450
31Prefumo
F
Celentano
C
Presti
F
De Biasio
P
Вентурини
P
Кардинальная гиперпатия
000 гипертрофия сердца
000 1 беременность с диабетом
Уход за диабетом
2005
28
2084
32McMahon
JN
Берри
PJ
Джоффе
HS
Джоффе
HS
Джоффе
HS
Pediatr Cardiol
1990
11
211
212
33Leslie
J
Shen
SC
Strauss
L
Атрофия плода с атеросклерозом у плода 2
J педиатр
1982
100 9000 3
631
632
34Weber
HS
Botti
JJ
Baylen
BG
Последовательная продольная оценка сердечного роста и желудочковой диастолии 2000 Контролируемое диастолическое наполнение желудочков у плода
1994
15
184
189
35Коза’к-Бараны
А
Йокинен
E
Керо
Поминен
ТуринПоминен
ТуринT
Välimäki
I
Нарушение диастолической функции левого желудочка у новорожденных от матерей с прегестационным или гестационным диабетом с хорошим гликемическим контролем
Early Hum Dev
2004
77
13 9000
Jaeggi
ET
Fouron
JC
900 02 ProulxF
Сердечная деятельность плода при неосложненном и хорошо контролируемом сахарном диабете I типа у матери
УЗИ Obstet Gynecol
2001
17
311
315
311
315
37WM
Rahman
HA
Aziz
BA
Cheah
FC
Индекс сопротивления пупочной артерии при диабетической беременности: связь с исходом плода и неонатальной гипертрофией перегородки
9000 Гипертрофия перегородки.
31
296
301
38Центры по контролю заболеваний
Перинатальная смертность и врожденные пороки развития у младенцев, рожденных женщинами с инсулинозависимым диабетом: США Канада Европа 1940–1988
JAMA 1990
JAMA 1990
437
440
39Feig
DS
Palda
VA
Сахарный диабет 2 типа при беременности: растущая проблема
Lancet
2002
359
1690
1692
409000i
S
Testuo
T
Nemoto
K
Shimizu
M
Sanaka
M
Текущее состояние беременности у диабетических женщин Диабет
9000 NID 9000 у матери с диабетом 2 Res Clin Pract1994
24
Доп.
S273
S278
41Dean
H
NIDDM-Y у детей первой национальности в Канаде
Clin Pediatr
1998
39
89
9000 9000000
9000 9000000
9000Owada
M
Urakami
T
Yamauchi
K
Повышение заболеваемости инсулинозависимым сахарным диабетом среди японских школьников коррелирует с повышенным потреблением животных белков и жиров
Clin
1998
37
111
115
43Нусситу
P
Монбарон
D
Флакон
Y
Руис
J
Риск диабета и метаболического синдрома исследование в Лозанне, ШвейцарияDiabetes Metab
2005
31
361
369
44Kieffer
E
Ожирение и гестационный диабет среди афроамериканских женщин и латиноамериканцев в Детройте: последствия для неравенства в здоровье женщин
J Am Med Womens Assoc
956
181
187
45Демирорем
K
Кулачок
L
Оран
B
Коч
H
0002
000
000
000000000измерения у младенцев от матерей с диабетом и макросомных младенцев от матерей без диабета
J Perinat Med
2005
33
232
235
46Pildes
RS
Eng3
Eng Средняя
1973
289
902
904
47Лечение диабета: исследования в Европе: Декларация Сент-Винсента
Diabet Med
1990
7
360
© Европейское общество кардиологов 2007.Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
.Эхокардиограмма плода полезна для скрининга плодов с семейным анамнезом кардиомиопатии
Кардиомиопатия передается по наследству, и на семейные формы приходится 30-40% случаев. Кардиомиопатия может присутствовать у плода и быть обнаружена с помощью эхокардиограммы плода. Данные о полезности эхокардиограммы плода у пациентов с семейным анамнезом кардиомиопатии ограничены и не являются текущим показанием для эхокардиограммы плода в соответствии с последними рекомендациями Американской кардиологической ассоциации.Мы исследовали, насколько полезна эхокардиография плода с семейным анамнезом кардиомиопатии. Мы проверили все эхокардиограммы плода, выполненные в нашем учреждении за последние 5 лет, для выявления семейной истории кардиомиопатии. Мы исключили пациентов с семейным анамнезом гипертрофической кардиомиопатии, поскольку несиндромальные формы обычно не имеют клинической значимости в период новорожденности. Было выявлено 26 пациентов, которым выполняли эхокардиограмму плода в связи с семейной историей кардиомиопатии.У трех из 26 пациентов (11,5%) были обнаружены снижение функции желудочков и дилатация в соответствии с кардиомиопатией. У всех, у кого была кардиомиопатия на эхокардиограмме плода, были родители с генетическими мутациями (2 материнские, 1 отцовская), включая одну мать, которой в возрасте 8 лет была сделана трансплантация сердца по поводу дилатационной кардиомиопатии. Обнаружены две мутации MYH7 и одна мутация TNNT2. Все 3 пострадавших новорожденных прошли дородовое планирование для оказания помощи на высоком уровне и были переведены в наше учреждение третичной медицинской помощи сразу после рождения для кардиологической оценки и лечения.Первому пациенту потребовались простагландины ввиду значительной коарктации в дополнение к кардиомиопатии без уплотнения левого желудочка (дилатационный фенотип). У пациента в период новорожденности была восстановлена коарктация, и впоследствии ему потребовалась инотропная поддержка (милринон) для прогрессирующего ухудшения систолической функции левого желудочка. Пересадку сделали в возрасте 2 месяцев. У второго пациента была дилатационная кардиомиопатия и резко снизилась систолическая функция левого желудочка. Его поддерживали милриноном, но у него прогрессировало клиническое снижение.Ему поддерживали ЭКМО в течение 1 недели, но он выздоровел с последующей поддержкой милриноном и, наконец, перешел на пероральные препараты от сердечной недостаточности. Сейчас ему 3 года, он проходит амбулаторное лечение сердечной недостаточности и чувствует себя хорошо. Третий ребенок нуждался в первичной госпитализации из-за затруднений с кормлением и начала приема пероральных лекарств от сердечной недостаточности, но избегал инотропных или расширенных потребностей в поддержке. Ей 3 года, она хорошо себя чувствует на лекарствах от сердечной недостаточности. Ни у одного из пациентов с нормальной функцией на эхокардиограмме плода не было признаков кардиомиопатии на эхокардиограмме новорожденного.В этом исследовании мы обнаружили, что 11,5% эхокардиограмм плода, выполненных для семейного анамнеза кардиомиопатии, имели результаты кардиомиопатии на эхокардиографии плода, достаточно значимые, чтобы потребовать пренатального планирования. Мы рекомендуем пациентам с сильным семейным анамнезом кардиомиопатии у матери или отца, особенно с известными генетическими мутациями, связанными с кардиомиопатией, выполнить скрининговую эхокардиограмму плода. Эхокардиограммы плода в этой группе пациентов полезны для наблюдения за состоянием плода и для немедленного послеродового планирования.
- Авторское право © 2018 Американская академия педиатрии
Гипертрофическая кардиомиопатия у детей | Детская больница CS Mott
Что такое гипертрофическая кардиомиопатия?
Гипертрофическая кардиомиопатия (ГКМП) — это наследственное заболевание, поражающее определенные белки в клетках сердечной мышцы. Он передается от родителя к ребенку через хромосомы. К настоящему времени обнаружено около 100 различных ошибок (мутаций) в 10 генах, вызывающих HCM. Это довольно часто встречающееся генетическое заболевание, которым страдает примерно 1 человек из 500.Другие термины, используемые для описания проблемы, — это гипертрофическая обструктивная кардиомиопатия (HOCM) и идиопатический гипертрофический субаортальный стеноз (IHSS).
Нормальное сердце — это четырехкамерный насос. Стенки сердца состоят из слоев мышечных клеток. Сердечный ритм находится под контролем электрической системы сердца. Клетки сердечной мышцы реагируют на электрический импульс резким сокращением (сокращением). Когда клетки сокращаются вместе, это «сжимает» камеру, и кровь перекачивается вперед.Между сокращениями клетки расслабляются (удлиняются), позволяя крови заполнять камеры сердца до следующего сердцебиения. При HCM белки в мышечных клетках, которые позволяют клетке сокращаться и расслабляться, являются ненормальными. Это приводит к жесткости стенок сердца, которые не расслабляются обычным образом между ударами сердца. Медицинский термин для этого — диастолическая дисфункция.
При HCM мышечные клетки также толстые (медицинский термин для этого — гипертрофия), из-за чего стенки сердца также становятся толстыми.Этот эффект наиболее заметен в межжелудочковой перегородке — стенке между двумя нижними камерами сердца — желудочками. В некоторых случаях стенка становится настолько толстой, что препятствует оттоку крови к телу. Это может вызвать симптомы боли в груди во время упражнений и сделать человека более склонным к опасным для жизни нарушениям сердечного ритма, таким как желудочковая тахикардия или фибрилляция желудочков. Даже при отсутствии блокировки кровотока толстые стенки сердца могут вызвать у человека легкую усталость.
Как эта проблема влияет на здоровье моего ребенка?
Хотя ГКМП представляет собой серьезную проблему, его последствия для здоровья широко варьируются как по возрасту начала, так и по степени тяжести. Часто симптомы слабо выражены или отсутствуют до позднего детства или подросткового возраста. Самый частый симптом — низкая выносливость с одышкой и болью в груди во время упражнений. У некоторых в более зрелом возрасте хроническое переутомление сердца вызывает увеличение сердца и симптомы застойной сердечной недостаточности.
У людей с ГКМП существует повышенный риск нарушений сердечного ритма, таких как синдром Вольфа-Паркинсона-Уайта, наджелудочковая тахикардия, трепетание предсердий и фибрилляция предсердий.Также существует повышенный риск внезапной сердечной смерти (вызванной желудочковой тахикардией или фибрилляцией желудочков), который может быть выше у пациентов с очень толстыми стенками сердца или серьезной блокировкой кровотока из левой части сердца. «Непредвиденная» внезапная сердечная смерть (опасный для жизни ненормальный ритм, который преобразуется в себя) может показаться «приступом обморока». В будущем достижения в области генетического тестирования могут позволить врачам предсказать, кто подвергается более высокому риску внезапной смерти, и принять профилактические меры (например, имплантировать кардиовертер-дефибриллятор или ИКД).
Как диагностируется эта проблема?
Симптомы: Возможные симптомы включают учащенное сердцебиение («учащенное сердцебиение» или «прерывистое сердцебиение»), боль в груди и одышку при физической нагрузке и обмороки.
Физические признаки: Обследование обычно нормальное, за исключением шума в сердце.
Медицинские тесты: Эхокардиограмма — это основной тест, используемый для диагностики гипертрофической кардиомиопатии. Также выполняется электрокардиограмма (ЭКГ), которая почти всегда отклоняется от нормы.Другие сердечные тесты включают холтеровский монитор и рентген грудной клетки. Иногда делают катетеризацию сердца. Если есть проблемы с сердечным ритмом, может потребоваться электрофизиологическое исследование.
Как лечится проблема?
Сердечные лекарства, такие как блокаторы кальциевых каналов (верапамил) и бета-блокаторы (пропанолол, атенолол), используются для стимуляции расслабления сердечной мышцы. Бета-адреноблокаторы также помогают предотвратить опасные для жизни нарушения сердечного ритма (желудочковая тахикардия). Если возникают опасные для жизни аритмии или считается, что человек подвержен высокому риску таких аритмий, может потребоваться ИКД.Операция на сердце, называемая миомэктомией, иногда выполняется, если имеется значительная блокировка кровотока. Во время этой операции удаляется часть лишней сердечной мышцы. Пересадка сердца может потребоваться, если есть серьезные симптомы, несмотря на лечение сердечными препаратами / миомэктомию. Трансплантация сердца также может потребоваться при нарушениях сердечного ритма, которые нельзя безопасно лечить с помощью кардиовертера-дефибриллятора.
Каковы проблемы со здоровьем этих детей в долгосрочной перспективе?
Хотя ГКМП может быть серьезной проблемой, у многих людей заболевание только легкое, которое вызывает легкие симптомы или вообще не проявляется.Течение, тяжесть и последствия для здоровья широко варьируются даже среди членов семьи. В целом, риск серьезных проблем довольно низок, если гипертрофия (утолщение стенки сердечной мышцы) остается легкой. В более тяжелых случаях лечение бета-блокаторами в высоких дозах и имплантация ИКД (при угрожающих жизни аритмиях) значительно улучшили результаты лечения.
Профилактика SBE: Дети с HCM имеют повышенный риск развития подострого бактериального эндокардита (SBE).Это инфекция сердца, вызванная бактериями в кровотоке. Дети с пороками сердца более подвержены этой проблеме из-за нарушения кровотока через сердце и / или аномальных сердечных клапанов. SBE может возникнуть после стоматологической работы или медицинских процедур на желудочно-кишечном тракте или дыхательных путях, потому что эти процедуры почти всегда приводят к попаданию некоторых бактерий в кровь. СБЭ обычно можно предотвратить, если перед этими процедурами принять антибиотик.
Рекомендации по упражнениям: Индивидуальную программу упражнений лучше всего спланировать с врачом, чтобы можно было учесть все факторы.Большинству детей с HCM не разрешается заниматься соревновательными видами спорта, но разрешается заниматься малотравматичным спортивным спортом. Для детей важно всегда иметь возможность самостоятельно ограничивать свою деятельность, то есть отдыхать всякий раз, когда они чувствуют в этом необходимость. Дети с HCM обычно не участвуют в интенсивных занятиях физкультурой, но если врач разрешает легкие упражнения, им следует разрешить самостоятельно ограничивать уровень нагрузки, и их не следует оценивать (что может вынудить их превысить свой естественный уровень).
