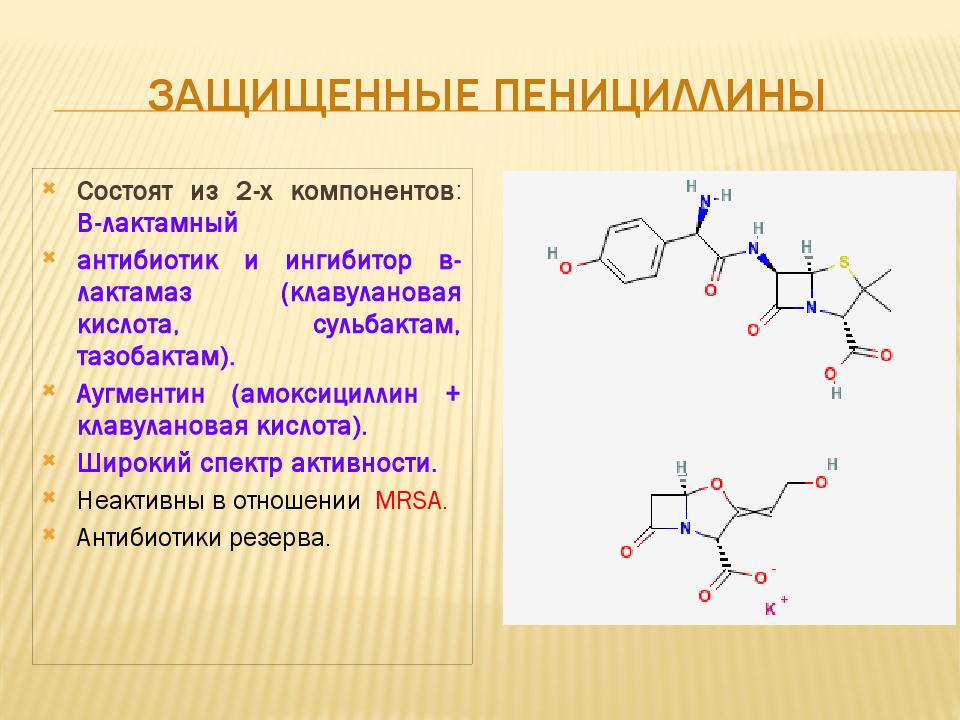
Антибиотики для детей широкого спектра
Антибиотик (антибактериальный препарат, противомикробное средство) – это препарат, который эффективен при лечении бактериальных инфекций. Его эффект заключается в непосредственном влиянии на бактерию, он ее убивает. Также его эффект может заключаться в замедлении размножения бактерии, что позволяет иммунитету справиться с ним. Высокая распространенность инфекций, большой выбор антибиотиков для детей, неоправданное назначение данных препаратов при заболеваниях у детей и взрослых привела к угрожающим последствиям для жизни людей – антибиотикоустойчивости. Согласно Евразийским рекомендациям, в ЕС 25000 смертей ежегодно связаны именно с антибиотикоустойчивостью. На данный момент противомикробные средства являются невосполнимым ресурсом человечества. Устойчивость к антибактериальным средствам можно рассматривать как угрозу национальной безопасности.
Прежде, чем перейти к выбору детского антибиотика, рассмотрению дозировки, длительности применения, необходимо разобрать и объяснить основные моменты в формировании устойчивости к антибактериальным средствам.
Антибиотикорезистентность
Антибиотикорезистентность – это термин, обозначающий устойчивость к антибиотикам. Кто виноват в этом? Основной причиной является избыточное и бесконтрольное применение противомикробных средств. Это касается не только медицины.
Назначение антибиотиков всегда должно быть оправданным.
Причины
- Применение в медицине. Неоправданное назначение на амбулаторном этапе, в стационаре, самолечение (безрецептурный отпуск). Основной акцент уделяется противодействию неоправданного назначения антибиотиков в первичном звене (на амбулаторном этапе). Для этого специально разрабатываются и внедряются в практическое здравоохранение клинические рекомендации и алгоритмы по назначению антибиотиков детям. Также через средства массовой информации проводятся разъяснения населению о необходимости разумного применения антимикробных средств и опасности их самостоятельного применения.

- Применение антибиотиков в ветеринарии.
- Применение в агроиндустрии.
Основные правила правильного применения антибактериальных препаратов
- Противомикробное средство принимается только при наличии бактериальной инфекции, которая предполагается или доказана документировано.
- Во время применения лекарственного средства необходимо придерживаться оптимального режима. Первое – это правильный выбор лекарства. В остальном необходимо соблюдать адекватную дозу и длительность применения.
- При выборе лекарственного средства необходимо учитывать региональную ситуацию по устойчивости к антибиотикам наиболее распространенных возбудителей и учитывать вероятность инфицирования больного данными бактериями.
- Не применять антибиотики низкого качества и с недоказанной эффективностью.
- Не использовать антибиотики с целью профилактики.
- Эффект от применения антибактериального средства оценивают через 48-72 часа после начала лечения.

- Объяснить вред несоблюдения режима применения лекарственного средства, а также пояснить опасность самолечения.
- Способствовать правильному применению лекарственного средства со стороны больного.
- В каждом случае необходимо использовать методы, позволяющие установить причину инфекции.
- При назначении антибактериального препарата врачам необходимо придерживаться рекомендациям, основанным на доказательной медицине.
Показания к назначению антибиотиков
Довольно распространенной ошибкой является использование антибиотиков при заболеваниях, которые развиваются вследствие не бактериальной инфекции.
Не следует использовать антибиотики при вирусных инфекциях.
Среди таких заболеваний:
- Острый фарингит.
- Острый ларинготрахеит.
- Ринит.
- ОРВИ, только.
- Острый бронхит. Допустимо использование антибиотиков при развитии сужения бронхов, а также при длительности лихорадки более 5 дней.

В данных случаях назначение антибиотиков не оправдано, так как причиной, приведшей к данным заболеваниям, зачастую являются вирусы.
Существуют и спорные моменты, когда к развитию заболевания могут приводить как вирусы, так и бактерии. К таким заболеваниям относятся:
- Острый риносинусит.
- Острый средний отит.
- Острый тонзиллит.
В таких случаях антибиотик назначается исключительно после обследования и наблюдения врачом за пациентом.
При вирусных инфекциях (фарингит, ринит, ларингит, трахеит) эффективность антибиотиков равна эффекту плацебо. Важно помнить, что назначение антибактериальных средств не предотвращает развитие бактериальной суперинфекции (то есть присоединения бактериальной инфекции к уже имеющейся вирусной). Эффективных средств против ОРВИ нет. Применение распространенных в аптечных сетях противовирусных иммуностимулирующих средств зачастую не несет в себе никакого эффекта. В данном случае противовирусное средство можно рассматривать как аскорбиновую кислоту или чеснок.
Данные утверждения несут за собой доказательный характер и более подробно описаны в учебном пособии «Рациональное применение антимикробных средств в амбулаторной практике врачей», написанное по основам и доказательной базе Евразийских рекомендаций 2016 года.
Основные виды антибиотиков и их распространенные представители на рынке
Ниже рассмотрим наиболее популярные и часто использующиеся группы антибактериальных средств:
- Бета-лактамы.
 Среди них выделяют пенициллины, цефалоспорины, карбапенемы. Среди пенициллинов стоит выделить: амоксициллин, ампициллин, тикарциллин, карбенициллин, мезлоциллин, мециллам. Наиболее популярными цефалоспоринами являются: цефазолин, цефалексин, цефуроксим, цефотаксим, цефтриаксон, цефепим, цефтобипрол. Карбапенемы используются гораздо реже. Можно выделить меропенем.
Среди них выделяют пенициллины, цефалоспорины, карбапенемы. Среди пенициллинов стоит выделить: амоксициллин, ампициллин, тикарциллин, карбенициллин, мезлоциллин, мециллам. Наиболее популярными цефалоспоринами являются: цефазолин, цефалексин, цефуроксим, цефотаксим, цефтриаксон, цефепим, цефтобипрол. Карбапенемы используются гораздо реже. Можно выделить меропенем. - Макролиды. К макролидам относятся: кларитромицин, азитромицин (сумамед), джозамицин.
- Тетрациклины. Наиболее распространенные: тетрациклин, доксициклин, окситетрациклин.
- Аминогликозиды. Популярные из них: гентамицин, амикацин, изепамицин.
- Левомицетины. Торговые наименования: левомицетин, хлоромицетин.
- Гликопептидные антибиотики. Наиболее часто используют: ванкомицин, блеомицин.
- Линкозамиды. В медицине используются: линкомицин, клиндамицин.
- Фторхинолоны.
 Среди них чаще всего используют: ципрофлоксацин, левофлоксацин, гемифлоксацин. Являются антибиотиком для детей широкого спектра действия. Данные антибиотики не противопоказанные в детской практике, но их применение у ребенка резко ограничено.
Среди них чаще всего используют: ципрофлоксацин, левофлоксацин, гемифлоксацин. Являются антибиотиком для детей широкого спектра действия. Данные антибиотики не противопоказанные в детской практике, но их применение у ребенка резко ограничено.
Важно помнить, что указанные препараты имеют свои показания и противопоказания, а также применяются против определенных инфекций.
Указанные препараты имеют свои показания и противопоказания, обладают узким или широким спектром активности в отношении бактерий. Некоторые из перечисленных препаратов могут использоваться детям до года. Детские антибиотики существуют в таблетках, в суспензии, в ампулах для внутривенного и внутримышечного введения. Расчет дозы, разведение антибиотиков и введение необходимой дозы ребенку должно производиться медицинским персоналом во избежание нежелательных, побочных реакций, а также осложнений во время выполнения инъекций. Они должны назначаться исключительно врачом.
Длительность применения антибактериальных средств
Родители часто задают вопросы: «Сколько дней ставят антибиотик детям? Какой лучший антибиотик для детей? Что давать ребенку при приеме антибиотиков?». В большинстве случаев достаточно 5-7 дней применения. Существуют исключения, при которых длительность применения может возрастать до 10 – 28 дней. На второй вопрос однозначно ответить нельзя. У каждого лекарственного средства существуют свои показания и противопоказания, поэтому использование того или иного препарата зависит от ситуации (возраста, диагноза, сопутствующей патологии и др.). На третий вопрос многие доктора ответят одинаково: « Пробиотики». Пробиотик позволит восстановить нормальную микрофлору кишечника, которая подверглась влиянию антибактериального средства. Как правило, они назначаются курсом от 2 недель до 1 месяца.
В большинстве случаев достаточно 5-7 дней применения. Существуют исключения, при которых длительность применения может возрастать до 10 – 28 дней. На второй вопрос однозначно ответить нельзя. У каждого лекарственного средства существуют свои показания и противопоказания, поэтому использование того или иного препарата зависит от ситуации (возраста, диагноза, сопутствующей патологии и др.). На третий вопрос многие доктора ответят одинаково: « Пробиотики». Пробиотик позволит восстановить нормальную микрофлору кишечника, которая подверглась влиянию антибактериального средства. Как правило, они назначаются курсом от 2 недель до 1 месяца.
Вы всегда можете проконсультироваться с врачом, если вас интересуют какие-либо вопросы касательно лечения.
Согласно Евразийским рекомендациям, с целью преодоления антибиотикоустойчивости эксперты подчеркивают необходимость обращать внимание пациентов на строгое соблюдение режима применения лекарственного средства. Необходимо использовать оптимальные лекарственные формы антибиотиков с высокой биодоступностью, в частности, диспергируемые таблетки Солютаб, что согласуется с современной позицией ВОЗ и UNICEF. Преимущества диспергируемых таблеток Солютаб:
Преимущества диспергируемых таблеток Солютаб:
- Полностью всасываются в кишечнике. Вследствие этого эффект равен внутривенному эффекту.
- Создают высокую концентрацию в очаге инфекции.
- Лучшая переносимость.
- Хорошие органолептические свойства.
- Возможность растворять таблетки, что позволяет использовать данную лекарственную форму у детей.
- Для проглатывания требуется минимальное количество жидкости.
- Имеют преимущество перед суспензией – исключаются ошибки в приготовлении.
Диспергируемые таблетки, рекомендуемые ВОЗ и UNICEF:
- Флемоксин Солютаб
- Флемоклав Солютаб
- Супракс Солютаб
- Вильпрофен Солютаб
- Юнидокс Солютаб
Родителям детей стоит помнить, что незавершенный курс предписанного лечения антибиотиком приводит к формированию устойчивости бактерий и длительного нахождения микроба в организме.
Осложнения применения антибиотиков
Во время применения антибиотиков существует риск развития нежелательных реакций. К таким осложнениям относятся:
К таким осложнениям относятся:
- Гепатотоксичность – повреждение печени. Чаще всего отмечается при приеме моксифлоксацина, макролидов, клавуланата.
- Кардиотоксичность – повреждение сердца. Такая реакция может отмечаться при применении фторхинолонов, азитромицина, кларитромицина.
- Нейротоксичность – повреждение нервной системы. Отмечается у фторхинолонов.
- Аллергия. Характерна для пенициллинов, цефалоспоринов.
По факту, чем шире спектр противомикробной активности, тем выше риск развития нежелательных реакций.
Выбор антибиотика у ребенка
Ранее мы рассмотрели основные заболевания верхних и нижних дыхательных путей, при которых могут применяться противомикробные средства. Сейчас разберем основные препараты, которые могут использоваться при той или иной патологии, а также укажем необходимую дозировку лекарственного средства.
Не принимайте антибиотики без назначения врача.
Не используйте препараты самостоятельно! Препараты и дозировки приведены ниже исключительно в ознакомительных целях и не эквивалентны лечению, назначаемому врачом.
Острый средний отит
Препаратом выбора является амоксициллин 40-90 мг/кг/сут в 3 приема. Длительность терапии 10 дней, у детей < 5лет, 5-7 дней у детей >5 лет. Препаратом второй линии является амоксициллин/клавуланат. Препаратом третьей линией является джозамицин.
Острый риносинусит
Аналогично применению антибактериальных средств при остром среднем отите.
Острый тонзиллит
Препаратом выбора является амоксициллин 45-60 мг/кг в 3 приема, Феноксиметилпенициллин вн 25-50 мг/кг 3-4 раза в сутки. Препаратом второй линии является цефиксим. Препаратом третьей линией является джозамицин. Длительность терапии 10 дней.
Внебольничная пневмония
Терапия выбора – амоксициллин вн 45-90 мг/кг/сут в 3 приема. Препаратом второй линии является амоксициллин/клавуланат, цефуроксим в/м, цефтриаксон в/м. Препаратом третьей линией является джозамицин 40-50 мг/кг/сут в 2 приема.
Препаратом третьей линией является джозамицин 40-50 мг/кг/сут в 2 приема.
Антибиотики являются незаменимыми препаратами в борьбе с бактериальной инфекцией. Назначение данных лекарственных средств должно производиться исключительно по медицинским показаниям. Очень важно придерживаться предписанному режиму применения антибактериального средства. Не занимайтесь самолечением. При возникновении признаков инфекции обращайтесь к педиатру, который поможет установить диагноз, причину заболевания, а также назначить адекватное лечение.
Назад в будущее: к чему может привести бесконтрольный приём антибиотиков
Врачи Педиатрического университета рассказали об открытии пенициллина и риске вернуться в эпоху, когда антибактериальных препаратов ещё не изобрели.
17 сентября 1928 года Александр Флеминг открыл пенициллин. Это событие буквально перевернуло мир медицины – не сразу, правда, а спустя 20 лет. Человечество тогда вздохнуло с облегчением: туберкулез и многие другие инфекции перестали быть приговором, да и риск умереть от случайной царапины свёлся к минимуму.
Но уже в нобелевской речи 1945-го года Флеминг предупредил о новой глобальной угрозе – устойчивости бактерий к антибиотикам.
– Человек, бездумно играющийся с пенициллином для лечения всего подряд, в конце концов, окажется морально ответственным за смерть того, кто не смог побороть инфекцию, которая оказалась устойчива к пенициллину, — писал первооткрыватель.
В 2014 году ООН опубликовала отчет о масштабах уже свершившейся катастрофы. Исследование показало, что каждый год в мире более 700 тысяч человек умирает от инфекций, вызванных устойчивыми микробами.
– Почти половину антибиотиков используют при лечении заболеваний органов дыхания, хотя чаще они имеют вирусную природу. Профилактическое назначение антибиотиков не спасает от развития бактериальных осложнений, в первую очередь, от пневмонии. А вот устойчивость к ним возникает очень быстро! Этому способствует самолечение, возможность покупки антибиотиков без рецепта, а, значит, бесконтрольное использование антибактериальных препаратов пациентами или их родителями, несоблюдения дозирования, частоты введения и длительности курса, – говорит Светлана Петрова, доцент кафедры факультетской педиатрии СПбГПМУ.
При этом создание принципиально новых антимикробных препаратов – большая проблема.
– Вывод очевиден – есть вероятность возврата в доантибиотическую эру! – считает Светлана Петрова.
Но почему, собственно, возникает антибиотикорезистентность? Ответ на этот вопрос даёт иммунолог, врач-педиатр приемного отделения СПбГПМУ Андрей Гоголев.
– Как и все живые организмы, микробы постоянно эволюционируют. Они делятся и в процессе деления возможны изменения генетического материала, и микробы приобретают новые свойства. К новым свойствам микробов можно отнести, в том числе, и антибиотикорезистентность, резистентность к пенициллину, естественному антибиотику. Некоторые микробы выделяют особые ферменты, которые растворяют пенициллин. Поэтому сейчас естественный пенициллин уже практически не применяется. Приходится использовать полусинтетические или синтетические пенициллины, защищенные от бактериальных ферментов, — объясняет специалист.
Важно помнить, что бесконтрольный приём серьёзных лекарств – угроза не только для самого пациента, но и для его окружающих.
– Это популяционная проблема. Даже если человек никогда не пил антибиотики, но его заражает больной, у которого уже резистентный штамм, то лечение всё равно будет проходить сложно, – поясняет Андрей Гоголев.
Нередко врачи назначают антибактериальные препараты, чтобы перестраховаться. Как себя вести родителям в сомнительных случаях?
– Надо дать время организму ребенка справился с инфекцией самостоятельно. Обязательно вызвать врача. Должны быть четкие критерии: если повышенная температура тела держится больше 4 суток, то нужно сдать клинический анализ крови — это поможет врачу поставить точный диагноз. Если действительно это бактериальная инфекция – назначаем антибиотики первой линии, то есть пенициллинового ряда. Применяем ступенчатый подход — не надо сразу бить широкоспектральными антибиотиками. Если это вирусная инфекция — то назначение антибиотиков не требуется вообще. Если при вирусной инфекции после улучшения снова происходит ухудшение состояния, то назначение антибактериального препарата может быть необходимым, но только после клинического анализа крови. В котором доктор увидит изменение соответствующих показателей — отметил доктор Гоголев.
Если это вирусная инфекция — то назначение антибиотиков не требуется вообще. Если при вирусной инфекции после улучшения снова происходит ухудшение состояния, то назначение антибактериального препарата может быть необходимым, но только после клинического анализа крови. В котором доктор увидит изменение соответствующих показателей — отметил доктор Гоголев.
Добавим, что не менее важна и профилактика инфекций: если люди постараются избегать бактерий, то и применять антибиотики придется реже. Чаще всего микробы попадают в организм человека через пищу, поэтому ВОЗ сформулировала несколько несложных правил, чтобы обезопасить себя от пищевых инфекций:
- Подвергайте пищу тщательной термической обработке. Температура продукта должна быть минимум 70 °С.
- Съедайте приготовленную пищу горячей, поскольку при остывании велика вероятность размножения в ней различного рода бактерий. Если разогреваете пищу, то делайте это при той же температуре – не ниже 70 °С.

- Храните пищу при температуре не выше 10 °С.
- Не допускайте контакта сырой и приготовленной пищи. Например, не стоит резать ножом сырое мясо, а потом сразу сыр.
- Мойте руки перед приготовлением еды. Тщательно мойте фрукты и овощи.
- Держите кухню и все кухонные принадлежности в чистоте, не допускайте появления насекомых, и тем более, мышей и крыс.
- Помните, что опасные бактерии могут попасть в пищу от собак, кошек, птиц и других домашних животных. Соблюдайте простые правила гигиены и следите за здоровьем ваших питомцев.
Дата публикации: 16.09.2020
Ретроспективный анализ карт-извещений о нежелательных реакциях антибиотиков пенициллинового ряда с применением метода системы проблем, связанных с лекарственными препаратами | Матвеев
1. Лазарева Н.Б., Реброва Е. В., Борисов М.С. β-лактамные антибиотики:современная позиция в пульмонологической практике // Практическая пульмонология. 2018. Т. 2. С. 76–82.
В., Борисов М.С. β-лактамные антибиотики:современная позиция в пульмонологической практике // Практическая пульмонология. 2018. Т. 2. С. 76–82.
2. Коротков А. Самый популярный защищенный пенициллин // Российские аптеки. 2011. Т. 10. С. 66–69.
3. Кузьмина А.В., Поливанов В.А., Асецкая И.Л., Зырянов С.К. Медицинские ошибки при применении антибиотиков пенициллиновой группы // Клиническая микробиология и антимикробная химиотерапия. 2016. Т. 18. №2. С. 93–103.
4. Shenoy E.S., Macy E., Rowe T. Evaluation and management of Penicillin allergy // JAMA. 2019. Vol. 321. N 2. P. 188– 199. DOI:10.1001/jama.2018.19283
5. Jung I.Y., Kim J.J., Lee S.J., Kim J., Seong H., Jeong W., Kim J.M. Antibiotic-related adverse drug reactions at a Tertiary Care Hospital in South Korea // Biomed Res Int. 2017. DOI: 10.1155/2017/4304973
Antibiotic-related adverse drug reactions at a Tertiary Care Hospital in South Korea // Biomed Res Int. 2017. DOI: 10.1155/2017/4304973
6. Андреева И.В., Стецюк О.У. Аллергия на антибиотики у детей: кто виноват и что делать? // Педиатрическая фармакология. 2013. T. 10. №6. С. 42–52.
7. Яковлев С.В. Новая концепция рационального применения антибиотиков в амбулаторной практике // Антибиотики и химиотерапия. 2019. T. 64. №3–4. С. 48–58. DOI: 10.24411/0235-2990-2019-100017
8. ATC/DDD Index 2019. URL: https://www.whocc.no/atc_ddd_index/ (дата обращения: 05.08.2019)
9. Федеральный закон Российской Федерации №61-ФЗ от 12 апреля 2010 г. «Об обращении лекарственных средств». URL: http://www. consultant.ru/document/cons_doc_LAW_99350/ (дата обращения: 10.09.2019)
consultant.ru/document/cons_doc_LAW_99350/ (дата обращения: 10.09.2019)
10. Uppsala Monitoring Centre. The use of the WHO-UMC system for standardised case causality assessment. URL: https://www.who.int/medicines/areas/quality_safety/safety_efficacy/WHOcausality_assessment.pdf (дата обращения: 10.09.2019)
11. Binu K.M., Nimmy N.J., Varghese G.P. A survey of Drug related problems identified by community pharmacy in South India // International Journal of Pharmaceutical, chemical and biological sciences. 2012. Vol. 2. N 2. P. 368–374.
12. van Mil J.W., Westerlund L.O., Hersberger K.E., Schaefer M.A. Drug-related problem classification systems // Ann Pharmacother. 2004. Vol. 38. N 5. P. 859–867.
13. Матвеев А.В., Крашенинников А.Е., Егорова Е.А., Коняева Е.И. Применение системы проблем, связанных с лекарственными препаратами (drug-related problems), на примере группы нестероидных противовоспалительных средств // Фармация и фармакология. 2019. T. 7. №4. С. 215–223. DOI: 10.19163/2307-9266-2019-7-4-215-223
Матвеев А.В., Крашенинников А.Е., Егорова Е.А., Коняева Е.И. Применение системы проблем, связанных с лекарственными препаратами (drug-related problems), на примере группы нестероидных противовоспалительных средств // Фармация и фармакология. 2019. T. 7. №4. С. 215–223. DOI: 10.19163/2307-9266-2019-7-4-215-223
14. Blix H.S., Viktil K.K., Moger T.A., Reikvam A.R. Risk of drug-related problems for various antibiotics in hospital: assessment by use of a novel method // Pharmacoepidemiology and Drug Safety. 2008. Vol. 17. N 8. P. 834–841. DOI: 10.1002/pds.1595
15. Paulino E.I., Bouvy M.L., Gastelurrutia M.A., Mara Guerreiro, Henk Buurma. Drug related problems identified by European community pharmacists in patients discharged from hospital // Pharm World Sci. 2004. Vol. 26. P. 353–356.
16. Abunahlah N., Elawaisi A., Velibeyoglu F.M. Drug related problems identified by clinical pharmacist at the Internal Medicine Ward in Turkey // Int J Clin Pharm. 2018. Vol. 40. P. 360–367. DOI: 10.1007/s11096-017-0585-5
Abunahlah N., Elawaisi A., Velibeyoglu F.M. Drug related problems identified by clinical pharmacist at the Internal Medicine Ward in Turkey // Int J Clin Pharm. 2018. Vol. 40. P. 360–367. DOI: 10.1007/s11096-017-0585-5
17. Adusumilli P.K., Adepu R. Drug related problems: an over view of various classification systems // Asian J Pharm Clin Res. 2014. Vol. 7. P. 7–10.
18. Abdela O.A., Bhagavathula A.S., Getachew H. Risk factors for developing drug-related problems in patients with cardiovascular diseases attending Gondar University Hospital, Ethiopia // J Pharm Bioallied Sci. 2016. Vol. 8. N4. P. 289–295.
19. Al-Azzam S.I., Alzoubi K.H., AbuRuz S., Alefan Q. Drugrelated problems in a sample of outpatients with chronic diseases: a cross-sectional study from Jordan // Ther Clin Risk Manag. 2016. Vol. 12. P. 233–239. DOI: 10.2147/TCRM.S98165
2016. Vol. 12. P. 233–239. DOI: 10.2147/TCRM.S98165
20. Pharmaceutical Care Network Europe. PCNE DRP classification now 8.02.2017. URL: https://www.pcne.org/news/68/pcne-drp-classification-now-802 (дата обращения: 08.09.2019)
21. Eichenberger P.M. Classification of drug-related problems with new prescriptions using a modified PCNE classification system // Pharmacy World & Science. 2010. Vol. 3. N 32. P. 362–372.
22. Козлов Р.С., Голуб А.В. Стратегия использования антимикробных препаратов как попытка ренессанса антибиотиков // Клиническая микробиология и антимикробная химиотерапия. 2011. №13. С. 322–334.
23. Журавлева М.В., Романов Б.К., Городецкая Г.И. Актуальные вопросы безопасности лекарственных средств, возможности совершенствования системы фармаконадзора // Безопасность и риск фармакотерапии. 2019. T. 7. №3. С. 109–119. DOI: 10.30895/2312-7821-2019-7-3-109-119
2019. T. 7. №3. С. 109–119. DOI: 10.30895/2312-7821-2019-7-3-109-119
Антибактериальная терапия у детей: достижения и перспективы
Авторы: Подготовила Ирина Старенькая
Несмотря на значительные успехи, достигнутые в педиатрии за последние годы, проблема профилактики и лечения гнойно-септических заболеваний у детей остается по-прежнему актуальной. Наиболее уязвимыми для бактериальных инфекций являются новорожденные с тяжелой перинатальной патологией, особенно недоношенные. Не менее актуальна проблема инфекционных заболеваний у детей с тяжелой иммуносупрессией, которой сопровождается химиотерапия онкогематологических заболеваний. Такие дети не только наиболее подвержены инфекциям, но и переносят их значительно тяжелее. При лечении таких больных
врачи сталкиваются с рядом проблем: устойчивостью микроорганизмов к антибиотикам,
склонностью к генерализации инфекции, высоким риском осложнений и непереносимостью
антибиотиков.
При лечении таких больных
врачи сталкиваются с рядом проблем: устойчивостью микроорганизмов к антибиотикам,
склонностью к генерализации инфекции, высоким риском осложнений и непереносимостью
антибиотиков.Об основных аспектах антибактериальной терапии новорожденных и детей, страдающих онкогематологическими заболеваниями, мы попросили рассказать ведущих специалистов МЗ Украины.
Главный внештатный специалист по неонатологии МЗ Украины, заведующая кафедрой неонатологии КМАПО им. П.Л. Шупика, доктор медицинских наук, профессор Елизавета Евгеньевна Шунько отвечает на вопросы об особеностях антибактериальной терапии у новорожденных с инфекционной патологией.
– Чем обусловлена актуальность рационального подхода к антибактериальной терапии в
неонатологии?
– Проблема инфекции в педиатрии, особенно в неонатологии, в настоящее время приобретает
все большее значение по целому ряду причин. Инфекции перинатального периода в
структуре заболеваемости и смертности новорожденных выходят на второе-третье место.
Прежде всего, это связано с ухудшением репродуктивного здоровья матерей, значительно
возросло число беременных групп высокого риска, особенно с экстрагенитальной
патологией, в том числе с инфекционными заболеваниями. Неблагоприятное течение
беременности сказывается на особенностях развития плода, приводит к рождению ребенка с
иммунобиологическим нарушением резистентности организма к бактериальным и вирусным
инфекциям. В связи с этим частота инфекционной патологии у новорожденных в последнее
время приобретает все большую актуальность, а рациональная антибактериальная терапия,
становится одной из основных в практике неонатолога. Особенно серьезное беспокойство
вызывает проблема бактериальных инфекций у недоношенных новорожденных, у которых
они занимают одно из лидирующих мест в структуре заболеваемости и смертности.
Инфекции перинатального периода в
структуре заболеваемости и смертности новорожденных выходят на второе-третье место.
Прежде всего, это связано с ухудшением репродуктивного здоровья матерей, значительно
возросло число беременных групп высокого риска, особенно с экстрагенитальной
патологией, в том числе с инфекционными заболеваниями. Неблагоприятное течение
беременности сказывается на особенностях развития плода, приводит к рождению ребенка с
иммунобиологическим нарушением резистентности организма к бактериальным и вирусным
инфекциям. В связи с этим частота инфекционной патологии у новорожденных в последнее
время приобретает все большую актуальность, а рациональная антибактериальная терапия,
становится одной из основных в практике неонатолога. Особенно серьезное беспокойство
вызывает проблема бактериальных инфекций у недоношенных новорожденных, у которых
они занимают одно из лидирующих мест в структуре заболеваемости и смертности.
Во всех экономически развитых странах в последние годы значительно повысился уровень
оказания перинатальной помощи, возросла и выживаемость новорожденных, в том числе
глубоконедоношенных, а также детей с тяжелой перинатальной патологией. Рациональная
антибактериальная терапия во многом определяет уровень заболеваемости, смертности,
результаты лечения и состояние здоровья ребенка в последующем, качество его жизни.
Неонатологов всего мира беспокоит проблема нозокомиальных инфекций, связанных с
лечебно-диагностическим процессом. С точки зрения профилактики и лечения госпитальных
инфекций рациональная антибактериальная терапия приобретает еще большую значимость,
поскольку правильное назначение эффективных антибиотиков предупреждает развитие этой
патологии.
– Какие требования к антибактериальной терапии у новорожденных детей?
– В неонатологии, как и в медицине в целом, главенствующим является принцип «не
навреди», к которому следует стремиться при назначении всех лекарственных препаратов. Антибактериальная терапия часто применяется по жизненным показаниям (при тяжелом
сепсисе, например), но и в этих ситуациях необходимо отдавать предпочтение препаратам,
которые в наименьшей степени оказывают повреждающий эффект на развивающийся
организм ребенка.
Антибактериальная терапия часто применяется по жизненным показаниям (при тяжелом
сепсисе, например), но и в этих ситуациях необходимо отдавать предпочтение препаратам,
которые в наименьшей степени оказывают повреждающий эффект на развивающийся
организм ребенка.
В последнее время при назначении антибиотиков неонатологи сталкиваются с
определенными сложностями. Выбор препаратов достаточно разнообразен, вместе с тем
практический врач не имеет четкого алгоритма действий. Поэтому крайне важен обмен
опытом применения тех или иных препаратов, глубокий и тщательный анализ не только их
эффективности, но и степени безопасности, особенно в связи с возможными отдаленными
последствиями.
Для лечения новорожденных используют антибиотики пенициллинового ряда
(полусинтетические пенициллины), цефалоспорины, аминогликозиды, реже макролиды,
очень ограничены показания для фторхинолонов. Причем, если лет 10-15 назад для лечения
новорожденного ребенка назначали один антибиотик и этого было достаточно для
достижения клинического эффекта, то сегодня при наблюдающихся изменениях
биологических свойств микрофлоры, повышении ее патогенности и устойчивости к
антибактериальным препаратам чаще назначают два антибиотика, а при тяжелой патологии –
три. Поэтому в неонатологии принципиально важным остается вопрос безопасности
лекарственных препаратов. Помня об особенностях патологии неонатального периода (частое
наличие асфиксии, гипоксии, недоношенности и прочих патологических изменений),
особенно важно учитывать тот или иной органоповреждающий эффект каждого
применяемого лекарственного препарата.
Поэтому в неонатологии принципиально важным остается вопрос безопасности
лекарственных препаратов. Помня об особенностях патологии неонатального периода (частое
наличие асфиксии, гипоксии, недоношенности и прочих патологических изменений),
особенно важно учитывать тот или иной органоповреждающий эффект каждого
применяемого лекарственного препарата.
– Какие препараты особенно перспективны в этом отношении?
– Мы имеем широкий опыт использования лекарственных средств в лечении новорожденных,
поэтому можно утверждать о явных преимуществах определенных групп перед другими
препаратами. Мировым стандартом антибактериальной терапии у новорожденных стала
комбинация аминогликозидов и цефалоспоринов. Эти препараты оптимальны для назначения
при эмпирической антибактериальной терапии, когда возбудитель неизвестен. В литературе
описан синергизм препаратов групп аминогликозидов и цефалоспоринов, который ведет к
более эффективному подавлению широкого спектра патогенных микроорганизмов.
Один из «старейших» представителей аминогликозидов – гентамицин – назначается детям
уже много лет. К сожалению, он обладает выраженной ототоксичностью и
нефротоксичностью, что не позволяет его использовать в неонатологии. У препарата группы
аминогликозидов – Нетромицина наблюдается оптимальное соотношение эффективности и
безопасности. Среди всех препаратов аминогликозидового ряда Нетромицин характеризуется
наименьшими ототоксичностью и нефротоксичностью. Согласно данным литературы, у
Нетромицина практически полностью отсутствуют как ототоксический, так и
нефротоксический эффекты.
Для оценки ототоксичности аминогликозидов нами были проведены исследования по
изучению функции слуха у новорожденных с помощью эхо-скрининга. При применении
Нетромицина явных патологических изменений не было отмечено.
Очень важным преимуществом Нетромицина в неонатальной практике является возможность
однократного введения на протяжении суток. У новорожденных количество инвазивных
вмешательств должно быть минимальным, чему полностью соответствует Нетромицин,
оставаясь эффективным на протяжении 24 часов.
У новорожденных количество инвазивных
вмешательств должно быть минимальным, чему полностью соответствует Нетромицин,
оставаясь эффективным на протяжении 24 часов.
– Высокая степень безопасности препарата недостаточна для того, чтобы рекомендовать его к
применению. Есть ли у Нетромицина преимущества по отношению к клинической и
микробиологической эффективности?
– Изучая проблему инфекции у новорожденных и оценивая свойства основных возбудителей
бактериальной инфекци, мы убедились, что они имеют значительно более высокую
чувствительность к Нетромицину, тогда как по отношению к гентамицину в большинстве
случаев определяется резистентность. Исследования по изучению чувствительности
микроорганизмов к антибактериальным препаратам и контроль за формированием
антибиотикорезистентности проводятся нашей кафедрой с момента ее основания (1977 год),
под руководством профессора С.П. Катониной. Все это время мы работаем совместно с
Институтом эпидемиологии и инфекционных болезней им. Л.В. Громашевского АМН
Украины и накопили большой опыт по внедрению результатов клинико-биологического
контроля в клиническую практику. Мы проводим исследования микрофлоры новорожденных
детей в роддомах и специализированных неонатологических отделениях. По данным
последних наблюдений, микрофлора новорожденных отличается высокой чувствительностью
к Нетромицину (до 90% выделенной микрофлоры).
Л.В. Громашевского АМН
Украины и накопили большой опыт по внедрению результатов клинико-биологического
контроля в клиническую практику. Мы проводим исследования микрофлоры новорожденных
детей в роддомах и специализированных неонатологических отделениях. По данным
последних наблюдений, микрофлора новорожденных отличается высокой чувствительностью
к Нетромицину (до 90% выделенной микрофлоры).
Следует отметить, что новорожденные в последнее время часто отличаются сниженной
колонизационной резистентностью. Когда такой ребенок поступает в отделение интенсивной
терапии, его организм колонизируется госпитальной микрофлорой, устойчивой к
большинству антибактериальных препаратов. Нетромицин в этой ситуации отличается
выраженными преимуществами, поскольку чувствительность госпитальной микрофлоры к
нему остается достаточно высокой.
Клиническая и микробиологическая эффективность препарата оптимальна как для
эмпирической антибактериальной терапии (совместно с цефалоспоринами), так и для
целенаправленной антибактериальной терапии против большинства возбудителей инфекций
у новорожденных (как грамположительных, так и грамотрицательных). Нетромицин обладает
эффектом по отношению к таким грозным возбудителям, актуальным у новорожденных, как
синегнойная палочка и стафилококк.
На основании собственного положительного опыта применения Нетромицина и
многочисленных данных литературы по высокой эффективности и безопасности препарата,
его можно рекомендовать к широкому применению у новорожденных. У детей с тяжелой
перинатальной патологией, в том числе у глубоконедоношенных детей, Нетромицин может
быть препаратом стартовой эмпирической антибактериальной терапии.
Главный детский гематолог МЗ Украины, заведующая центром детской онкогематологии и трансплантации костного мозга УДСБ «Охматдет», кандидат медицинских наук, доцент Светлана Борисовна Донская рассказала о наиболее перспективных направлениях в лечении инфекции у детей со злокачественными гематологическими заболеваниями.
– Насколько актуальна проблема инфекционных заболеваний в детской
онкогематологии?
– Лечение онкологических заболеваний достаточно агрессивно и сопровождается глубокой
иммуносупрессией, поскольку при химиотерапии значительно угнетается иммунитет, при
этом на порядок возрастает риск инфекционных осложнений и их негативное влияние на
организм ребенка остается крайне неблагоприятным, ухудшая качество жизни, снижая
эффективность лечения и способствуя увеличению показателей смертности. Поэтому
вопросы профилактики и лечения инфекционных заболеваний в детской гематологии имеют
большое значение для улучшения конечных результатов лечения (снижение летальности,
увеличение числа вылеченных детей при снижении их инвалидизации).
– В связи с этим какие требования предъявляются к лечению инфекций при
гематологических заболеваниях у детей?
– Учитывая такую важную роль инфекционной патологии, ее лечение должно быть
максимально интенсивным для достижения быстрого и устойчивого эффекта. Современные
условия, отличающиеся повышением патогенности микрофлоры и ее резистентности к
антибиотикам, диктуют необходимость поликомпонентной антибактериальной терапии, при
этом количество антибактериальных препаратов, как правило, – не менее двух, а максимум
их не ограничен. Иногда нам приходится применять пять-шесть и более антибиотиков
одновременно, потому что от этого зависит жизнь ребенка.
Антибиотики, применяемые в онкогематологии, принадлежат к группам цефалоспоринов
(третьего или более поздних поколений), аминогликозидов и других препаратов широкого
спектра действия. Наиболее востребованы препараты последних генераций.
Такое интенсивное лечение на фоне достаточно агрессивной по отношению к растущему
организму химиотерапии требует от антибиотиков либо полного отсутствия, либо
минимального токсического эффекта. В определенных клинических ситуациях приходится
отказываться от некоторых необходимых медикаментов, поскольку наступает предел
переносимости для печени и почек, поэтому вопросы безопасности и переносимости
антибактериальной терапии в онкогематологии приобретают особое значение.
– Какие препараты, удовлетворяющие этим требованиям, вы могли бы отметить в качестве
наиболее перспективных?
– Выбор оптимальной комбинации антибиотиков определяется целым рядом факторов.
Прежде всего, следует учитывать наиболее вероятные возбудители и учитывать спектр
действия антибактериального препарата. В этом отношении надо обратить внимание на
препарат Нетромицин из группы аминогликозидов. Эффективность его не уступает
остальным представителям группы, но он отличается широким спектром действия и
доказанной активностью по отношению к большинству грамотрицательных и
грамположительных возбудителей.
Кроме того, Нетромицин характеризуется рядом преимуществ, которые выгодно отличают
его от множества антибиотиков: практически полное отсутствие токсического влияния на
печень и почки порой делают Нетромицин препаратом первого выбора у больных,
проходящих химиотерапию; высокий профиль безопасности обусловливает широкое
применение препарата в клинике детской онкогематологии. Широкий спектр действия
снижает риск образования резистентности к препарату и формирования устойчивых
штаммов, поэтому Нетромицин обладает высокой клинико-микробиологической
эффективностью.
Нетромицин хорошо сочетается с полусинтетическими пенициллинами и цефалоспоринами,
проявляя в ряде случаев синергизм по отношению к определенным возбудителям. Такое
качество является особенно ценным в онкогематологии, где не существует монотерапии
антибиотиками, а совместная «работа» нескольких препаратов определяет конечный эффект
лечения. Например, применение цефалоспоринов третьей генерации требует комбинации с
препаратами, имеющими активность против грамотрицательной флоры и стафилококка. В
этом случае применение Нетромицина позволяет избежать назначения третьего
антибиотика.
Нетромицин уже достаточно давно на фармакологическом рынке, его клиническая и
микробиологическая эффективность, безапасность подтверждены многочисленными
исследованиями. Во многих гематологических отделениях клиник Украины накоплен
достаточный опыт применения Нетромицина, проводились выборочные исследования по
оценке эффективности и токсичности препарата, результаты которых подтверждают ряд
преимуществ Нетромицина по сравнению с другими аминогликозидами.
СТАТТІ ЗА ТЕМОЮ
10.07.2021 Гастроентерологія Педіатрія Терапія та сімейна медицина Інновації в дитячій гастроентерології та нутриціології в практиці педіатра і сімейного лікаря18-19 травня 2021 р. відбулася науково-практична конференція «Інновації в дитячій гастроентерології та нутриціології в практиці педіатра і сімейного лікаря. Читання ім. професора Ю.В. Бєлоусова», присвячена світлій пам’яті видатного українського вченого та лікаря, заслуженого діяча науки і техніки України, завідувача кафедри педіатричної гастроентерології та нутриціології Харківської медичної академії післядипломної освіти (ХМАПО), доктора медичних наук, професора Юрія Володимировича Бєлоусова….
10.07.2021 Гастроентерологія Мікробіота і психоемоційний стан людиниУ цілому світі від депресивних розладів страждає близько 322 млн людей, що становить 4,4% населення світу. Незважаючи на те, що інтерес до розуміння механізмів виникнення та можливостей лікування патології у науковців та клініцистів не вщухає, кількість людей із депресією продовжує невпинно зростати, і не лише за рахунок глобального збільшення населення. Нещодавно дослідники почали ширше дивитися на патологію, інтегруючи концепцію цілісності людського організму. …
Врачи рассказали, чего следует избегать при лечении ковида на дому
Антибиотики, иммуномодуляторы, средства от кашля, жаропонижающее и витамины, — ко всем этим средствам прибегают люди, решившие самостоятельно лечиться от коронавирусной инфекции. Однако врачи предупреждают: бездумное применение препаратов может усугубить тяжесть состояния и нанести еще больший вред здоровью. «Газета.Ru» — о том, чего нельзя делать заболевшим.
При лечении коронавируса в амбулаторных условиях россияне часто допускают ошибки, которые не только уменьшают эффективность терапии, но могут также привести к серьезному ухудшению здоровья. Врачи утверждают: есть целый ряд препаратов, применять которые можно только по их назначению.
Так, иммунолог Мария Польнер сообщила, что наиболее частой ошибкой является бесконтрольное употребление иммуномодуляторов. «Пациенты считают, что раз есть приставка «иммуно», значит, препарат безусловно полезен и не несет никакого вреда. Но это не так. Нельзя смоделировать только часть иммунитета, это может повлечь за собой последствия, например, в виде развития или обострения аутоиммунных заболеваний», — пояснила врач «Газете.Ru».
Также, по ее словам, при первых же симптомах болезни пациенты начинают принимать антибактериальные средства. «И делают это бесконтрольно, из-за чего может развиться резистентность (сопротивляемость, — «Газета.Ru») патогенных бактерий, и когда уже действительно будет острая необходимость, антибиотики могут оказаться бессильны», — подчеркнула иммунолог.
Врачи настаивают: антибиотики можно принимать строго по назначению врача. «Если вы будете начинать пить антибактериальные препараты, а затем бросать их – это приведет к устойчивости организма, внутренние микроорганизмы перестанут реагировать на средство, и мы уже никогда не сможем вылечить болезнь», — предупредила любителей самолечения врач общей практики Анастасия Тараско.
Принимать антибиотики самостоятельно не стоит еще и потому, что они вообще не обладают эффективностью при вирусных инфекциях в целом и при COVID-19 в частности.
«Показанием для применения антибиотиков при ковиде являются только клинико-лабораторные признаки присоединения бактериальной инфекции. Самостоятельно это определить невозможно — это может сделать только врач»,
— объяснил заслуженный врач России, ведущий научный редактор Vrachu.ru Михаил Каган.
По его словам, бесконтрольное применение этих препаратов может представлять опасность, так как многие из них обладают побочными эффектами и, кроме того, могут приводить к видоизменениям резистентных бактерий, которые сами способны вызвать отдельный инфекционный процесс. Антибиотики опасны такими последствиями, как тошнота, рвота, спазм бронхов и аритмия.
«Кроме того, многие принимают местные антибиотики и антисептики в виде таблеток для рассасывания», — сообщила Мария Польнер. Она пояснила, что тем самым пациенты нарушают естественную микробиоту слизистых оболочек, что приводит снижению их защитных свойств, а значит вирус может легче проникнуть в организм. «Буквально сегодня обращалась пациентка с грибковым поражением рта, кандидозом, образовавшимся от лечения такими препаратами», — отметила иммунолог.
Нередко пациенты при домашнем лечении коронавируса самостоятельно применяют препараты с недоказанной эффективностью — в частности, арбидол, осельтамивир, гидроксихлорохин — их врачи тоже советуют избегать.
«Необходимо помнить, что нельзя руководствоваться принципом «вреда не будет, а вдруг поможет?». Абсолютно безвредных медикаментов нет.
Развитие побочных действий при отсутствии лечебного эффекта препарата может не только значительно ухудшить состояние пациента и способно в значительной степени «запутать» клиническую картину заболевания, что затрудняет принятие правильных решений в отношении рациональной лечебной тактики»,
— объяснил Михаил Каган.
Бездумно принимать для лечения от коронавируса нельзя даже витамины — по словам Марии Польнер, пациенты с COVID-19 нередко в больших дозах пьют витаминные комплексы, но это может вызвать аллергическую реакцию. И опасность не только в аллергии. «Люди забывают, что потребление витаминов и микроэлементов имеет такое же лекарственное воздействие, что и другие препараты, — предупредила Анастасия Тараско. — Например, бесконтрольное потребление витамина D серьезно влияет на почки. А прием витамина C в больших дозах чреват образованием камней, отеками, нарушением работы поджелудочной железы и даже повышением в крови лейкоцитов».
Внимательно стоит относиться и к употреблению адаптогенов – препаратов природного происхождения. «Такие средства, как, например, женьшень, работают накопительно. Если дозу превышать, то никакого улучшения иммунитета не будет. Только воздействие на печень, почки и желудочно-кишечный тракт, что может привести к обострению имеющихся хронических патологий», — пояснила Тараско.
Не менее распространенной ошибкой является стремление людей при недомогании снизить температуру — на это недавно обратили внимание в посвященной здоровью программе «О самом главном» на телеканале «Россия 1». Эксперты отметили, что при отсутствии хронических заболеваний температура до 38,5 °C считается нормой – именно она помогает организму справиться с вирусом, поэтому сбивать ее не следует, лучше вызвать скорую помощь.
И, наконец, не стоит злоупотреблять средствами от кашля. Проблема в том, что подобные препараты стимулируют выделение мокроты, тем самым затрудняя дыхание и усугубляя кислородное голодание, свойственное COVID-19.
Антибактериальная терапия при респираторных инфекциях у детей в амбулаторных условиях: проблемы и пути решения | Дронов И.А., Геппе Н.А., Малахов А.Б., Кондюрина Е.Г.
Инфекции дыхательных путей занимают первое место вструктуре заболеваемости детей: всреднем ежегодно каждый ребенок переносит неменее 4-х эпизодов респираторных инфекций. Чаще всего эти заболевания удетей имеют вирусную этиологию, однако огромное значение имеют ибактериальные инфекции, которые вбольшинстве случаев требуют применения антибиотиков [1]. Впедиатрической практике антибактериальная терапия (АБТ) заболеваний органов дыхания, протекающих без осложнений, проводится вамбулаторных условиях. При этом около 80% назначений антибиотиков делается поповоду инфекций верхних инижних дыхательных путей [2]. Поэтому именно при респираторных инфекциях возникает больше всего дискуссионных вопросов, связанных сАБТ.
Инфекции дыхательных путей занимают первое место в структуре заболеваемости детей: в среднем ежегодно каждый ребенок переносит не менее 4-х эпизодов респираторных инфекций. Чаще всего эти заболевания у детей имеют вирусную этиологию, однако огромное значение имеют и бактериальные инфекции, которые в большинстве случаев требуют применения антибиотиков [1]. В педиатрической практике антибактериальная терапия (АБТ) заболеваний органов дыхания, протекающих без осложнений, проводится в амбулаторных условиях. При этом около 80% назначений антибиотиков делается по поводу инфекций верхних и нижних дыхательных путей [2]. Поэтому именно при респираторных инфекциях возникает больше всего дискуссионных вопросов, связанных с АБТ.В докладе ВОЗ от 30 апреля 2014 г., посвященном проблеме устойчивости к противомикробным препаратам на глобальном уровне, было отмечено, что эта серьезная опасность уже не является лишь прогнозом на будущее, поскольку она проявляется сейчас в каждом регионе мира и представляет собой серьезную угрозу для здоровья людей [3].
Противоинфекционная терапия и прежде всего АБТ имеет принципиальное отличие от остальных направлений фармакотерапии в связи с тем, что ее последствия выходят далеко за рамки воздействия на человека, получающего лекарственный препарат. В последние годы все чаще выявляются штаммы бактерий, которые устойчивы к действию всех известных антибиотиков, увеличивается необходимость использования более дорогостоящих препаратов, отмечаются более тяжелое течение заболеваний и более высокая летальность среди пациентов с инфекциями, вызванными резистентными штаммами бактерий.
Основная причина роста резистентности бактерий – это широкое применение антибиотиков, прежде всего в медицинской практике, а также в ветеринарии и сельском хозяйстве. В этой связи во многих странах в настоящее время разрабатываются и внедряются национальные стратегии противодействия росту резистентности. Ключевыми в данных стратегиях являются мероприятия, направленные на рациональное применение антибактериальных препаратов: разработка и внедрение стандартных рекомендаций по лечению инфекционных заболеваний, надзор за назначением антибиотиков в лечебных учреждениях и продажей их в аптеках, контроль за лекарственной резистентностью возбудителей, оптимизация и внедрение образовательных программ для медицинских работников и населения [4].
В процессе принятия решения о назначении АБТ врач сталкивается с решением 3-х принципиальных вопросов:
1. Определение показаний к назначению АБТ.
2. Выбор оптимального препарата для АБТ (в случае положительного решения первого вопроса).
3. Определение режима применения выбранного препарата.
Каждый из этих вопросов сопряжен с целым рядом сложных проблем, оптимальное решение которых требует от практического врача не только глубоких знаний по основной специальности, но и понимания ключевых аспектов клинической микробиологии и фармакологии.
Весной 2014 г. в рамках работы Межрегионального педиатрического респираторного общества авторами начато тестирование участковых педиатров по вопросам АБТ при респираторных инфекциях. Тестирование проводится анонимно в рамках образовательных мероприятий для врачей в различных регионах Российской Федерации. Разработанные тестовые задания построены на основании современных российских и международных клинических рекомендаций. Тест включает 20 вопросов, касающихся этиологии и АБТ острого тонзиллофарингита (ОТФ), острого среднего отита (ОСО), острого риносинусита (ОРС) и внебольничной пневмонии (ВП) у детей. На каждый вопрос предлагается 5 вариантов ответов, при этом можно выбрать один или несколько ответов. В данной статье будут использованы полученные предварительные результаты тестирования – ответы 48 участковых педиатров из г. Москвы и Новосибирской области.
Определение показаний к назначению АБТ
В реальной клинической практике этиотропная терапия инфекционных заболеваний в амбулаторных условиях, как правило, проводится эмпирическим путем, т. е. без верификации возбудителя. Фармакоэпидемиологические исследования отчетливо показывают, что антибиотики назначаются существенно чаще (иногда в несколько раз), чем это требуется. Данное обстоятельство создает целый ряд существенных проблем, таких как стимуляция роста лекарственной резистентности бактерий, безосновательное увеличение стоимости лечения, развитие нежелательных лекарственных реакций. С другой стороны, отказ от применения антибиотика в ряде клинических ситуаций чреват развитием опасных осложнений или неблагоприятным исходом заболевания, что, безусловно, также определяет существенную проблему.
Острый тонзиллофарингит
ОТФ – одна из наиболее значимых причин обращения к педиатру и один из частых поводов для назначения антибиотиков у детей. Чаще всего это заболевание – проявление ОРВИ. Среди бактериальных возбудителей ОТФ доминирующее значение имеет β-гемолитический стрептококк группы А (БГСА, Streptococcus pyogenes), на долю которого приходится от 15 до 36% случаев заболевания [5–7]. При стрептококковой этиологии ОТФ необходимо обязательное назначение АБТ в связи с опасностью развития серьезных осложнений: ранних гнойных (средний отит, синусит, перитонзиллярный абсцесс и др.) и поздних негнойных (острая ревматическая лихорадка, гломерулонефрит и др.), что подтверждается данными Кокрановского систематического обзора [8].
В подавляющем большинстве случаев АБТ при нестрептококковом ОТФ не обоснованна. Однако данные фармакоэпидемиологических исследований в разных странах показывают, что АБТ назначается большинству пациентов с клинической картиной ОТФ. По данным российского масштабного исследования, антибиотики назначаются 95% пациентов с ОТФ. Для определения показаний к назначению антибиотика при ОТФ необходимо верифицировать случаи заболевания, вызванные БГСА. Для выявления случаев стрептококкового ОТФ по клиническим данным имеется несколько балльных шкал, из которых наибольшее распространение получила шкала Сентора в модификации МакАйзека (табл. 1) [9].
Как видно из таблицы 1, при повышении суммарной оценки вероятность стрептококковой инфекции увеличивается, но даже при максимальном значении она выявляется примерно у половины больных. У пациентов с баллом 0–1 лабораторное обследование и назначение антибиотика не рекомендуются. У пациентов с 2 баллами и выше рекомендуется лабораторное обследование для выявления БГСА, а в случае его невозможности – назначение антибиотика.
Исследования показали, что применение шкалы Сентора в модификации МакАйзека позволяет примерно в 2 раза сократить частоту назначения антибиотиков у пациентов с ОТФ [10]. В нашем исследовании, проведенном в подмосковной поликлинике и включавшем 119 детей с ОТФ, у детей со стрептококковой и нестрептококковой этиологией заболевания медиана суммы баллов по шкале Сентора в модификации МакАйзека была одинаковой (3 балла), а среднее значение не имело достоверных различий. При этом у 94% детей оценка была 2 балла и выше. Таким образом, результаты нашего исследования ставят под сомнение диагностическую ценность данной шкалы [7]. В целом на сегодняшний день можно говорить о том, что клинические данные не позволяют верифицировать стрептококковую этиологию ОТФ, а следовательно, не дают возможности принять обоснованное решение о назначении АБТ.
Многие годы ведущим методом верификации стрептококкового ОТФ является бактериологическое исследование, которое позволяет выявить различные возбудители и определить их чувствительность к антибиотикам. Исследование проводится в специализированной лаборатории (куда необходимо доставить материал в течение 2-х ч), а результат анализа может быть получен только через несколько суток [9]. Указанных недостатков лишены экспресс-тесты для выявления БГСА, которые позволяют в течение нескольких минут провести анализ непосредственно при осмотре больного. Данные тесты обладают чувствительностью и специфичностью в отношении БГСА более 95% и на этапе скрининга способны заменить бактериологическое исследование. Применение высокоточных тестов способствует раннему назначению АБТ при стрептококковом ОТФ и в то же время позволяет отказаться от необоснованного назначения антибиотиков при заболевании иной этиологии. Проведенное фармакоэкономическое исследование показало, что использование экспресс-тестов на БГСА – это наиболее выгодная стратегия диагностики при ОТФ как у детей, так и у взрослых [11]. Внедрение экспресс-диагностики БГСА при ОТФ во Франции привело к уменьшению применения антибиотиков на 41%, в нашем исследовании удалось снизить частоту назначения антибиотиков на 57% [7, 12].
Одно из тестовых заданий, которые были предложены участковым педиатрам, содержало вопрос: «Какие бактерии являются ключевыми возбудителями ОТФ?». Примерно 2/3 врачей указали единственный верный ответ – Streptococcus pyogenes. При этом в 40 и 38% тестов в качестве правильных ответов неверно были указаны Staphylococcus aureus и Streptococcus pneumoniae.
Таким образом, имеются объективные проблемы в определении показаний к назначению АБТ при ОТФ у детей, связанные со сложностью этиологической диагностики заболевания. Очевидное решение данных проблем – широкое внедрение диагностики стрептококкового тонзиллофарингита с помощью современных экспресс-тестов. Кроме того, у врачей нередко имеются неверные представления относительно этиологии ОТФ: во многих случаях этиологическая роль приписывается бактериям, которые часто выделяются из ротоглотки у детей, но не являются возбудителями заболевания.
Острый средний отит
ОСО встречается у детей преимущественно в первые 3 года жизни. Обычно заболевание развивается у пациентов с ОРВИ и может быть вызвано различными вирусами. Однако чаще причиной ОСО являются бактерии: прежде всего Haemophilus influenzae и Streptococcus pneumonae, а также Moraxella catarrhalis, существенно меньшее место в этиологической структуре занимают Streptococcus pyogenes и Staphylococcus aureus [2]. В США на долю заболевания приходилось до 46% случаев всех назначений антибиотиков у детей (до внедрения универсальной вакцинации против пневмококковой и гемофильной инфекций) [13].
Диагностика ОСО основывается на клинических данных и результатах отоскопии. Поскольку заболевание чаще встречается у детей раннего возраста, имеются очевидные проблемы с выявлением ключевой жалобы – боли в ухе. В этой связи в нашей стране ОСО констатируется у детей значительно реже, чем в странах, где педиатры рутинно используют отоскопию. По данным российского исследования, при внедрении в практику педиатра пневматической отоскопии выявление ОСО у детей с респираторными инфекциями увеличивалось более чем в 2 раза [14].
Во многих случаях ОСО купируется без применения антибиотиков, однако необходимо учитывать возможность развития опасных системных осложнений этого заболевания: мастоидита, гнойного менингита, абсцесса головного мозга и др. (чаще осложнения развиваются при пневмококковой этиологии заболевания). В качестве абсолютных показаний к назначению антибиотиков при ОСО рассматриваются возраст до 2 лет и тяжелое течение заболевания [2]. Результаты доказательных клинических исследований показывают, что во многих случаях выжидательная тактика в отношении АБТ не ухудшает прогноз заболевания, что позволило Американской академии педиатров рекомендовать отсрочку решения о назначении антибиотиков у детей старше 2 лет с нетяжелым ОСО в случае активного наблюдения в последующие дни. Соответственно, при положительной динамике через 2–3 сут целесообразно воздержаться от назначения антибиотиков [15]. Аналогичная тактика рекомендуется и в российских руководствах [2].
Таким образом, ключевой проблемой при ОСО является его верификация у детей раннего возраста. Решение данной проблемы заключается в применении отоскопии у пациентов с респираторными инфекциями. Считаем целесообразным внедрение наблюдательной тактики в отношении применения антибиотиков при диагностированном ОСО в тех клинических ситуациях, когда это возможно.
Острый риносинусит
ОРС имеет высокую распространенность: по данным эпидемиологических исследований, за 1 год его переносят от 6 до 15% людей. Заболевание вызывают различные вирусы, в небольшом количестве случаев (менее 2%) на фоне ОРВИ развивается бактериальный синусит, который в детской популяции чаще наблюдается у подростков [16]. Так же как при ОСО, основными бактериальными возбудителями при ОРС являются Streptococcus pneumoniaе, Haemophilus influenzae и Moraxella catarrhalis. При рецидивирующем течении заболевания отмечается роль и других возбудителей, прежде всего анаэробов [1–2, 16].
В подавляющем большинстве случаев при ОРС назначение антибиотиков не показано. В то же время отказ от АБТ при бактериальном процессе чреват развитием редких, но очень опасных осложнений: флегмоны орбиты, внутричерепных абсцессов, менингита, тромбоза венозных синусов, остеомиелита костей лицевого скелета и др. Основаниями для диагностики бактериального процесса и, соответственно, показаниями для назначения АБТ при ОРС считаются:
– сохранение симптомов более 10 дней;
– выраженное ухудшение состояния пациента после первоначального улучшения;
– тяжелое течение заболевания: высокая температура тела, обильные гнойные выделения из носа, выраженный болевой синдром, периорбитальный отек.
О бактериальном процессе может свидетельствовать повышение показателей СОЭ и/или С-реактивного белка. При подозрении на бактериальный ОРС целесообразны консультация оториноларинголога и проведение риноскопии. Рентгенологическое обследование (рентгенография или компьютерная томография) не рекомендуются для рутинного исследования и должны применяться у пациентов с тяжелым течением заболевания или подозрением на развитие осложнений [16].
Таким образом, ключевыми проблемами при ОРС являются отказ от назначения антибиотиков у детей с вирусной инфекцией и своевременное выявление пациентов с бактериальными осложнениями. Поскольку определяющее значение имеют клинические данные, для решения указанной проблемы необходимо ознакомление врачей с современными рекомендациями по ведению пациентов с ОРС и, при необходимости, совместное ведение этих пациентов с оториноларингологами.
Внебольничная пневмония
Основные возбудители ВП – бактерии, при этом имеются возрастные особенности этиологической структуры заболевания. Все новорожденные и дети первого полугодия жизни с ВП подлежат госпитализации. В возрасте от 6 мес. до 5 лет основным возбудителем заболевания является Streptococcus pneumoniae, на долю которого приходится 70–88% случаев, определенную роль в этом возрасте играют также Haemophilus influenzae, Mycoplasma pneumoniae и Chlamydia pneumoniae. У детей старше 5 лет увеличивается значение атипичных возбудителей (Mycoplasma pneumoniae, Chlamydia pneumoniae), но при этом остается важная роль Streptococcus pneumoniae. Заболевание может иметь вирусную этиологию (особенно в первые годы жизни), однако быстро дифференцировать такие случаи сложно, к тому же в таких ситуациях имеется высокая вероятность развития вирусно-бактериальной ассоциации. Поэтому при выявлении ВП у ребенка требуется обязательное и незамедлительное назначение АБТ [2, 17].
Согласно российским рекомендациям диагноз пневмонии может быть достоверным только в случае рентгенологического подтверждения [17]. В то же время ВОЗ предлагает для диагностики ВП у детей использовать клинические критерии, такие как лихорадка, кашель, тахипноэ. В одном из исследований, включавшем анализ рентгенограмм 1848 детей до 5 лет с установленным по критериям ВОЗ диагнозом «пневмония», показано, что у 82% пациентов не было изменений на рентгенограмме, у 4% имелись признаки бронхиолита и только у 14% были выявлены рентгенологические изменения, характерные для пневмонии [18]. Вероятнее всего, в подавляющем большинстве случаев имел место острый бронхит, который обычно является проявлением ОРВИ и, соответственно, не требует назначения АБТ, за исключением отдельных клинических ситуаций [2]. Очевидно, что критерии ВОЗ имеют значение для ситуаций, когда недоступно проведение рентгенологического исследования и анализа крови. В остальных случаях их использование приводит к значительному увеличению объема неоправданной АБТ. В то же время диагноз ВП при обращении к педиатру в амбулаторной практике своевременно (в первые 3 сут) верифицируется не более чем у 30% пациентов [19].
Таким образом, ВП рассматривается как абсолютное показание к назначению АБТ, в связи с чем не возникает вопросов о необходимости применения антибиотиков при установленном в соответствии со стандартом РФ диагнозе. Однако существуют проблемы, которые могут быть обусловлены как гипер-, так и гиподиагностикой заболевания. Внедрение алгоритма диагностики при подозрении на ВП и расширение возможностей для проведения быстрого обследования помогают нивелировать эти недостатки.
Выбор оптимального препарата для АБТ
Для оптимального выбора антибиотика в конкретной клинической ситуации необходимо учитывать целый ряд факторов: наличие у пациента аллергии, концентрацию лекарственного препарата в очаге инфекции, чувствительность возбудителя инфекции к антибиотикам. Поскольку в реальной клинической практике в амбулаторных условиях АБТ чаще всего проводится эмпирически (т. е. без выявления возбудителя и определения его чувствительности к антибиотикам), то необходимо рассматривать спектр возможных возбудителей и оценивать их возможную резистентность.
Острый тонзиллофарингит
Назначение антибиотиков при ОТФ (за исключением редких случаев) направлено против БГСА. Данный возбудитель не только не обладает способностью продуцировать β-лактамазы (как и другие стрептококки), но и не имеет других механизмов резистентности к β-лактамным антибиотикам – пенициллинам и цефалоспоринам. Однако БГСА может быть резистентен к антибактериальным препаратам других групп. В ходе динамического российского многоцентрового исследования, проходившего в 1999–2009 гг., были получены данные о резистентности 860 штаммов БГСА, большинство из которых были выделены из ротоглотки. По результатам данного исследования отмечаются высокий уровень резистентности штаммов БГСА к тетрациклинам, небольшой уровень резистентности к 14- и 15-членным макролидам (до 13%) и хлорамфениколу (до 10%), минимальная резистентность к 16-членным макролидам и линкозамидам (менее 4%), а также фторхинолонам (менее 5%) и ко-тримоксазолу (менее 1%) [20].
Как в отечественных, так и в зарубежных руководствах в качестве препаратов выбора для лечения стрептококкового тонзиллофарингита рассматриваются пенициллины – феноксиметилпенициллин и амоксициллин [2, 21]. Однако нередко может наблюдаться клиническая и микробиологическая неэффективность пенициллинов при стрептококковом ОТФ. Установлено, что ведущей причиной этого является продукция β-лактамаз копатогенной флорой ротоглотки (Bacteroides spp., Staphylococcus aureus и др.) [22]. В связи с этим у пациентов с рецидивирующим ОТФ и/или получавших недавно антибиотики рекомендуется применение ингибиторозащищенных аминопенициллинов или цефалоспоринов, а в случае аллергии на β-лактамные антибиотики – линкозамидов [2, 21]. Также в качестве возможных причин неэффективности пенициллинов при ОТФ рассматриваются подавление в результате АБТ α-гемолитических (зеленящих) стрептококков, которые являются представителями нормальной микрофлоры ротоглотки и препятствуют колонизации БГСА [22], и низкая приверженность пациентов к лечению [23]. В целом возможная неэффективность пенициллинов, которая может быть связана с разными причинами, ведет к снижению значимости этих антибиотиков в лечении ОТФ. В то же время в подавляющем большинстве случаев необоснованный отказ от использования пенициллинов является ошибочным.
Еще одна проблема при выборе антибиотика для лечения ОТФ – нередкое развитие аллергических реакций на пенициллины [24]. Если у пациентов есть указания на аллергию на β-лактамные антибиотики в анамнезе, то для лечения ОТФ рекомендуется использование макролидов [1–2, 21]. Однако в этом случае существует риск неудачи терапии из-за резистентности БГСА. Как было сказано выше, резистентность возбудителя в разной степени проявляется в отношении различных макролидов. Это подтверждает еще одно многоцентровое российское исследование, проведенное в 2004–2007 гг., в котором также были отмечены принципиальные региональные особенности резистентности БГСА к макролидам [25]. В целом с учетом имеющихся в настоящее время данных предпочтение в лечении ОТФ отдается 16-членным макролидам: джозамицину, мидекамицину, спирамицину.
Также фактором, влияющим на выбор АБТ, является трудность дифференциальной диагностики по клиническим признакам между стрептококковым ОТФ и инфекционным мононуклеозом. Использование аминопенициллинов (ампициллина, амоксициллина, в т. ч. в составе ингибиторозащищенных препаратов) при инфекционном мононуклеозе приводит к развитию пятнисто-папулезной сыпи практически у всех пациентов [24]. Необходимо отметить, что накоплены обширные данные по использованию цефалоспоринов при ОТФ у детей, которые были представлены в метаанализе, включавшем 35 исследований с участием более 7000 пациентов. Во всех исследованиях сравнивалась эффективность 10-дневных курсов перорального приема цефалоспорина (I–III поколения) и пенициллина. Установлено, что, несмотря на абсолютную активность против БГСА, клиническая и микробиологическая эффективность цефалоспоринов была существенно выше, чем у пенициллина. Более высокая эффективность цефалоспоринов может объясняться их устойчивостью ко многим β-лактамазам, слабой активностью в отношении α-гемолитических стрептококков, а также более значимыми концентрациями препаратов в небных миндалинах [26].
В ходе тестового контроля знаний участковым педиатрам был задан вопрос: «К каким антибактериальным препаратам всегда чувствителен Streptococcus pyogenes?». Только 54% и 40% врачей указали в качестве ответа пенициллины и цефалоспорины соответственно. При этом в 25% случаев неверно были указаны макролиды. Еще одно тестовое задание содержало вопрос: «Какие антибиотики считаются препаратами выбора для ребенка 3 лет со стрептококковым тонзиллофарингитом?». Только 17% и 48% врачей выбрали правильные ответы: пенициллин и амоксициллин соответственно. При этом 71% врачей указали в ответах амоксициллин/клавуланат, а 23% – азитромицин. В ответе на вопрос: «Какие макролиды обладают наибольшей активностью в отношении Streptococcus pyogenes?» только 27% участковых педиатров назвали джозамицин и лишь 8% – спирамицин. При этом 60 и 79% врачей неверно отметили азитромицин и кларитромицин соответственно.
Таким образом, имеется целый ряд проблем в выборе оптимального антибиотика при ОТФ у детей, связанных как с эффективностью, так и с безопасностью препаратов. Решение данных проблем заключается в учете всех актуальных факторов для выбора АБТ у конкретного пациента в конкретной клинической ситуации. К сожалению, участковые педиатры часто имеют неверные представления об эффективности антибиотиков при инфекциях, вызванных БГСА, что может быть причиной неправильного выбора препарата для АБТ.
Острый средний отит и риносинусит
В этиологической структуре ОСО и ОРС ключевую роль играют одни и те же бактериальные возбудители: Streptococcus pneumoniaе и Haemophilus influenzae, в меньшей степени – Moraxella catarrhalis, поэтому принципы выбора АБТ при данных заболеваниях во многом совпадают. Препаратом выбора при ОСО и ОРС является амоксициллин, который в подавляющем большинстве случаев высокоэффективен в отношении возбудителей заболеваний. По данным динамического российского многоцентрового исследования, проходившего в 1999–2009 гг., резистентность к амоксициллину у пневмококка составляет менее 0,5% (анализ почти 2,5 тыс. штаммов) [27], а у гемофильной палочки – менее 6% (анализ почти 700 штаммов) [28].
У детей при наличии риска того, что заболевание вызвано штаммом Haemophilus influenzae, продуцирующим β-лактамазы (при недавнем приеме антибиотиков), и в случае неэффективности стартовой терапии амоксициллином в течение 3-х дней рекомендуется применение ингибиторозащищенного аминопенициллина или цефуроксима аксетила. При рецидивирующем ОРС применение ингибиторозащищенного аминопенициллина целесообразно также в связи с увеличением роли анаэробных бактерий. У пациентов с аллергией на β-лактамные антибиотики при ОСО и ОРС рекомендуется применение макролидов: азитромицина или кларитромицина (другие препараты этой группы не имеют значимой активности против Haemophilus influenzae) [2]. Трудность составляет выбор антибиотика у детей с аллергией на β-лактамные антибиотики, в случае недавнего приема антибиотиков или при неэффективности макролидов. Необходимо учитывать, что даже азитромицин, имеющий в отношении Haemophilus influenzae высокую активность in vitro (резистентность в России – ниже 2% [28]), обеспечивает эрадикацию возбудителя менее чем в половине случаев, что, возможно, связано с недостаточной концентрацией антибиотика в жидкости среднего уха [29].
Использование препаратов других групп (линкозамиды, тетрациклины, хлорамфеникол, ко-тримоксазол, аминогликозиды, фторхинолоны) при ОСО и ОРС у детей не показано из-за низкой активности в отношении ключевых возбудителей, неудовлетворительного профиля безопасности и/или возрастных ограничений к применению [2]. В данном случае целесообразно проанализировать аллергоанамнез пациента: если реакция была зафиксирована на пенициллины, то можно рассмотреть вопрос о применении цефалоспоринов. Данные обзоров многочисленных исследований показали, что у пациентов с аллергией на пенициллины существенная частота перекрестной реакции наблюдается только на цефалоспорины I поколения (примерно в 11% случаев), тогда как на цефалоспорины III поколения она незначительна (менее 1%). Это дает основание для назначения цефалоспоринов III–IV поколения пациентам с аллергией на пенициллины [24, 30]. Соответственно, у детей с аллергией на пенициллины в случае недавнего приема антибиотиков в качестве альтернативных препаратов для лечения ОСО и ОРС можно рассматривать цефалоспорины III поколения. В инструкциях к ряду препаратов (цефтибутен, цефотаксим, цефтриаксон) такая возможность допускается. Однако необходимо учитывать, что пероральные цефалоспорины III поколения, как правило, обладают невысокой активностью в отношении Streptococcus pneumoniae (резистентные к пенициллину штаммы устойчивы к цефиксиму, цефтибутену) [27]. В то же время парентеральный цефалоспорин III поколения цефтриаксон не только высокоактивен в отношении возбудителей ОСО и ОРС, но и создает высокие концентрации в жидкости среднего уха. Это дает возможность использовать данный антибиотик при ОСО в виде короткого курса – 1–3 дня [2].
Одно из тестовых заданий, которые были предложены участковым педиатрам, содержало вопрос: «Какие бактерии являются основными возбудителями ОСО у детей?». Менее половины врачей указали 2 верных ответа: Haemophilus influenzae (48%) и Streptococcus pneumoniaе (40%). При этом в 40 и 38% тестов в качестве правильных ответов ошибочно были названы Streptococcus pyogenes и Staphylococcus aureus. Также был задан вопрос: «Какие бактерии являются основными возбудителями острого бактериального риносинусита у детей младше 5 лет?». Большинство врачей верно указало в ответах Streptococcus pneumoniaе и Haemophilus influenzae – в 63 и 54% случаев соответственно. Но в то же время только 8% участковых педиатров назвали среди основных возбудителей Moraxella catarrhalis, а 52% ошибочно указали Staphylococcus aureus. Еще один вопрос звучал следующим образом: «Какие антибиотики считаются препаратами выбора для лечения нетяжелого ОСО у ребенка 10 мес., который ранее не получал АБТ?». Только 40% участковых педиатров дали верный ответ – амоксициллин. При этом 52% неверно назвали амоксициллин/клавуланат, а 21% – азитромицин.
Таким образом, определенной сложностью в лечении ОСО и ОРС является выбор препарата для АБТ у детей с аллергией на пенициллины при неэффективности макролидов. Эта проблема во многом может быть решена путем применения цефалоспоринов III поколения. Частое неверное представление участковых педиатров об этиологии ОСО и ОРС может приводить к ошибкам в выборе антибиотика.
Внебольничная пневмония
Как уже упоминалось, ВП у детей могут вызывать различные бактерии, при этом имеются принципиальные возрастные особенности этиологии (табл. 2). Безусловно, основным критерием выбора антибиотика для лечения ВП у детей является этиологическая структура заболевания. При выборе препарата для АБТ также нужно учитывать возраст ребенка, тяжесть заболевания и наличие осложнений, преморбидный фон и ряд других факторов.
В качестве основного препарата для лечения ВП у детей от 3 мес. до 5 лет как российские, так и зарубежные руководства указывают амоксициллин, который сохраняет высокую активность в отношении пневмококка – основного и наиболее опасного возбудителя ВП в этом возрасте. Эффективность амоксициллина при ВП (в т. ч. при тяжелой) у детей показана в ряде современных систематических обзоров [19]. В руководстве Американского общества по инфекционным заболеваниям в качестве одного из препаратов для лечения ВП у детей назван левофлоксацин [31]. В этой связи необходимо отметить, что все зарегистрированные в настоящее время в России фторхинолоны противопоказаны для применения у детей до 18 лет (исключение – ципрофлоксацин, который разрешен по отдельным показаниям), а на отечественном фармацевтическом рынке нет пероральной формы левофлоксацина для детей. Поэтому в нашей стране основными препаратами для АБТ при ВП у детей остаются пенициллины, макролиды и цефалоспорины, в отдельных случаях – антибиотики из других групп (табл. 3).
В российских рекомендациях ингибиторозащищенные аминопенициллины рассматриваются в качестве препаратов выбора для лечения ВП у детей в определенных случаях – в частности, при наличии фоновых заболеваний или у детей, которые получали антибиотики в последние 3 мес. [17]. В случае если ВП вызвана атипичными бактериями, а также у пациентов с аллергией на пенициллины рекомендуется использовать макролиды. При этом нужно учитывать, что у детей первых лет жизни в этиологической структуре заболевания определенную роль играет Haemophilus influenzae, в отношении которой из макролидов активность могут проявлять только азитромицин и кларитромицин [28]. В то же время в отношении Streptococcus pneumoniae большую активность проявляют 16-членные макролиды [25].
Необходимо отметить, что в подавляющем большинстве случаев при ВП назначается эмпирическая АБТ, т. е. без верификации возбудителя, что может быть сопряжено с ошибочным выбором антибиотика. Наибольшее значение данная проблема имеет при ВП у детей школьного возраста, когда в этиологической структуре важную роль играют и типичные, и атипичные бактерии [17].
При ответе на заданный в ходе тестирования вопрос: «Какие возбудители чаще вызывают ВП в возрасте от 3 мес. до 5 лет?» большинство педиатров (81%) отметили единственный верный ответ – Streptococcus pneumoniae. Нередко отмечались и неверные ответы, в частности, 1/4 врачей выбрали Mycoplasma pneumoniae, которая в этом возрасте не играет большой роли в этиологии ВП. Также был задан вопрос: «Какие антибиотики считаются препаратами выбора для лечения ВП, вызванной типичными возбудителями, у ребенка 4 лет?». Только 31% участковых педиатров назвали амоксициллин, тогда как амоксициллин/клавуланат (второй правильный ответ) – 79%. При этом 21 и 38% врачей ошибочно назвали азитромицин и кларитромицин соответственно.
Таким образом, при выборе антибиотика для лечения ВП имеет место проблема, связанная с разнообразием этиологии заболевания. Определенной проблемой является неверное представление части педиатров относительно этиологии ВП у детей разного возраста и эффективности антибиотиков при ВП. В частности, отмечается недооценка роли амоксициллина в качестве эффективного антипневмококкового препарата.
Определение режима применения выбранного препарата
Для достижения целей АБТ (которые могут иметь некоторые отличия в зависимости от заболевания) большое значение имеет не только правильный выбор антибиотика, но и определение оптимального режима его применения: дозировки, длительности, а в ряде случаев – и других критериев.
Острый тонзиллофарингит
Целью АБТ при стрептококковом ОТФ является не только излечение пациента, но и эрадикация БГСА, которая предотвращает развитие осложнений (в т. ч. поздних) и распространение инфекции. В связи с этим при ОТФ рекомендуется 10-дневный курс АБТ, за исключением 2-х антибиотиков:
• бензатинпенициллина – пенициллина пролонгированного действия (эффект длится несколько недель), который вводится однократно в/м;
• азитромицина – макролида, имеющего специфическую фармакокинетику (концентрация длительно сохраняется в тканях после отмены), который назначается на 5 дней. При этом курсовая доза данного препарата при ОТФ должна быть в 2 раза выше обычной (60 мг/кг, а не 30 мг/кг) [1–2].
Ряд исследований показал, что назначенный 10-дневный курс лечения пенициллином большинство больных не проходит, что ведет к снижению эффективности терапии. В связи с этим начали проводиться клинические испытания коротких курсов антибиотиков [32]. В Кокрановском систематическом обзоре, включавшем 20 доказательных исследований (более 13 тыс. пациентов), сравнивалась эффективность коротких курсов АБТ и стандартного 10-дневного курса лечения пенициллином при ОТФ у детей. Установлено, что микробиологическая эффективность и частота рецидивов не имели достоверных различий при короткой и стандартной длительности курса АБТ [33].
В ходе тестирования участковым педиатрам был задан вопрос: «Какой курс лечения может быть рекомендован ребенку 5 лет при остром стрептококковом тонзиллофарингите?». Лишь 29% врачей отметили правильный ответ – 10-дневный курс лечения пенициллином, еще 52% отметили второй верный ответ – 5-дневный курс лечения азитромицинами. При этом по 33% врачей неверно указали 7-дневный курс лечения пенициллином и 3-дневный курс лечения азитромицином.
Таким образом, основная проблема в определении режима АБТ у детей с ОТФ – это низкая комплаентность пациентов. В случае низкой приверженности к лечению целесообразно применение антибиотиков, которые обеспечивают высокую эффективность и при коротких курсах применения. Также проблему составляет то, что врачи недостаточно осведомлены о необходимой длительности АБТ при стрептококковом ОТФ.
Острый средний отит
Определенной проблемой в лечении пневмококковых инфекций, в частности ОСО, ВП, является выбор дозы амоксициллина (в т. ч. в составе ингибиторозащищенных пенициллинов). В российских рекомендациях для лечения ОСО (а также ОРС и ВП) у детей указана доза 40–45 мг/кг/сут [2].
Так же как и другие стрептококки, Streptococcus pneumoniae не продуцирует β-лактамазы, его резистентность к β-лактамным антибиотикам обусловлена модификацией пенициллиносвязывающего белка. Преодоление резистентности в данном случае возможно путем повышения дозы амоксициллина до 80–90 мг/кг/сут. Использование указанных доз амоксициллина рекомендуется для лечения инфекций у детей (вызванных Streptococcus pneumoniae) в регионах с высоким уровнем резистентности пневмококка к пенициллину; пациентам с риском того, что заболевание вызвано резистентным штаммом пневмококка [17].
В течение последних десятилетий отмечается глобальный рост уровня резистентности пневмококка к пенициллину. По данным динамического российского многоцентрового исследования, проходившего в 1999–2009 гг., доля штаммов пневмококка с высокой резистентностью к пенициллину составила 2,1%, с промежуточной резистентностью – 9,1%. Однако, как уже было сказано выше, уровень резистентности Streptococcus pneumoniae к амоксициллину составил всего 0,4% [27]. Аналогичная картина, когда резистентность Streptococcus pneumoniae к амоксициллину была существенно меньше, чем к пенициллину, наблюдалась во время исследований, выполненных в других странах [19]. Полученные данные свидетельствуют о том, что на сегодняшний день в России нет оснований для широкого применения высоких доз амоксициллина.
Определенной проблемой является выбор кратности применения амоксициллина, в т. ч. в комбинации с ингибитором β-лактамаз. Согласно рекомендациям и инструкциям по применению эти препараты можно использовать как 3, так и 2 р./сут [2]. По данным Кокрановского систематического обзора, при ОСО у детей эффективность амоксициллина не имеет отличий в случаях приема суточной дозы препарата за 2 или 3 раза [34]. В то же время необходимо учитывать, что предиктором эффективности амоксициллина, как и других β-лактамных антибиотиков, является показатель Т>МПК, т. е. время (Т), в течение которого концентрация антибиотика в крови превышает минимальную подавляющую концентрацию (МПК) для возбудителя. Считается, что для достижения надежного эффекта показатель Т>МПК должен составлять не менее 40% от времени между приемами препарата, а максимальный эффект должен наблюдаться при значении более 50% [35]. В ряде исследований было показано, что показатель Т>МПК для Streptococcus pneumoniae достоверно выше в случае разделения суточной дозы амоксициллина или амоксициллина/клавуланата на 3 приема по сравнению с 2-кратным приемом [36–37]. В связи с этим при лечении среднетяжелых и тяжелых форм ОСО дозу амоксициллина или амоксициллина/клавуланата (при пероральном приеме) целесообразно назначать 3 р./сут.
Рекомендуемая длительность АБТ при ОСО составляет от 5 до 10 дней в зависимости от тяжести заболевания. Исключение составляют азитромицин, который допустимо применять 3–5 дней, а также цефтриаксон, длительность курса которого составляет 1–3 дня [1–2].
Участковым педиатрам был задан вопрос: «Какая тактика лечения целесообразна в случае выделения у ребенка 1 года со средним отитом штамма Streptococcus pneumoniae, резистентного к пенициллину?». Только 19% врачей выбрали верный ответ – назначение амоксициллина в высокой дозе. При этом 60% неверно указали амоксициллин/клавуланат, а 56% – азитромицин.
Таким образом, при выборе режима АБТ при ОСО существует проблема, связанная с выбором режима применения амоксициллина и ингибиторозащищенных аминопенициллинов. Решение проблемы заключается в определении на основании современных научных данных контингента пациентов, требующих повышения дозы амоксициллина и разделения суточной дозы амоксициллина на 3 приема. Также проблемой является низкий уровень осведомленности врачей о возможности преодоления резистентности Streptococcus pneumoniae к пенициллинам.
Острый риносинусит
Вследствие схожей этиологической структуры бактериального ОРС и ОСО при выборе режима применения АБТ имеют место проблемы, описанные выше. Рекомендуемая длительность АБТ при бактериальном ОРС составляет от 7 до 14 дней в зависимости от тяжести заболевания. Исключение составляет азитромицин, который допустимо применять 3–5 дней [2]. Дополнительно следует отметить, что, согласно современным рекомендациям, детям с бактериальным ОРС целесообразно назначение антибиотиков в комбинации с назальными кортикостероидами [16].
Внебольничная пневмония
В связи с тем, что Streptococcus pneumoniae занимает важное место в этиологической структуре ВП, при выборе режима применения АБТ в лечении данного заболевания имеются те же проблемы, что при ОСО и бактериальном ОРС. Очевидную проблему составляет выбор оптимальной продолжительности АБТ при ВП у детей. Российские и зарубежные руководства рекомендуют проводить АБТ от 7 до 14 дней (для азитромицина – 3–5 дней) в зависимости от этиологии, тяжести и течения заболевания [2, 19]. При этом в последнее время появляются рекомендации по использованию более коротких курсов АБТ при ВП. В Кокрановском систематическом обзоре, включавшем 3 крупных рандомизированных исследования (почти 6 тыс. пациентов), было показано, что у детей в возрасте от 2 мес. до 5 лет с нетяжелой пневмонией 3-дневный курс АБТ эффективен так же, как 10-дневный курс [38]. Однако в ряде публикаций результаты данного обзора были подвергнуты серьезной критике [19]. Это связано с тем, что диагноз ставился в соответствии с критериями ВОЗ, о которых было сказано выше; имеется высокая вероятность того, что у большинства детей, включенных в эти исследования, была вирусная инфекция, и применение АБТ у них не требовалось в принципе. В то же время недавнее доказательное исследование, включавшее детей с рентгенологически подтвержденной нетяжелой ВП в возрасте от 6 мес. до 5 лет, показало, что эффективность 3-дневного курса АБТ составляет только 60%. При этом 5- и 10-дневный курсы показали эффективность во всех случаях [39].
Таким образом, имеет место проблема выбора продолжительности проведения АБТ у детей с ВП. Детальный анализ имеющихся в настоящее время научных данных показывает, что длительность АБТ при подтвержденной ВП у детей должна составлять не менее 5 дней.
Заключение
В настоящее время АБТ у детей с респираторными инфекциями в амбулаторной практике сопряжена с целым рядом серьезных проблем, которые связаны как с правильным определением показаний к назначению антибиотиков, так и с оптимальным выбором антибактериального препарата и режима его применения. Решение этих проблем требует проведения организационных мероприятий, направленных на выполнение современных клинических рекомендаций и усиление контроля за фармакотерапией при респираторных инфекциях (прежде всего за счет вневедомственной экспертизы).
На наш взгляд, необходимо принципиальное изменение подхода к повышению уровня знаний врачей относительно применения антибиотиков. Первые результаты проведенного нами тестирования участковых педиатров демонстрируют низкий уровень их осведомленности о современных аспектах АБТ. Это требует внедрения образовательных технологий, которые направлены на формирование умений и навыков, связанных с применением антибиотиков в педиатрической практике: интерактивных семинаров и практикумов с решением ситуационных задач, исходным и итоговым контролем знаний. С целью оценки эффективности системы образования врачей необходимо проведение динамических фармакоэпидемиологических исследований применения антибиотиков в детских амбулаторных учреждениях.
Литература
1. Острые респираторные инфекции у детей: лечение и профилактика. Научно-практическая программа. М.: Международный фонд охраны здоровья матери и ребенка, 2002. 72 с.
2. Современные клинические рекомендации по антимикробной терапии. Вып. 2. Смоленск: МАКМАХ, 2007. 608 с.
3. Устойчивость к антибиотикам — серьезная угроза общественному здравоохранению.URL: http://www.who.int/mediacentre/news/releases/2014/amr-report/ru.
4. Laxminarayan R., Duse A., Wattal C. et al. Antibiotic resistance-the need for global solutions / /Lancet Infect. Dis. 2013. Vol. 13. N 12. P. 1057–1098.
5. Linder J.A., Bates D.W., Lee G.M., Finkelstein J.A. Antibiotic treatment of children with sore throat // JAMA. 2005. Vol. 294. N 18. P. 2315–2322.
6. Bisno A.L. Acute pharyngitis // N. Engl. J. Med. 2001. Vol. 344. N 3. P. 205–211.
7. Dronov I.A., Botneva A.V., Neskorodova K.A., Malakhova-Kapanadze M.A. The experience of rapid diagnosis of streptococcal tonsillopharyngitis in children in outpatient care // 4th European Congress of Clinical Microbiology and Infectious Diseases, Barcelona, Spain, 10-13 May 2014. Poster R342.
8. Spinks A., Glasziou P.P., Del Mar C.B. Antibiotics for sore throat // Cochrane Database Syst. Rev. 2013. Vol. 5. N 11. CD000023.
9. Шпынев К.В., Кречиков В.А. Современные подходы к диагностике стрептококкового фарингита // КМАХ, 2007. Т. 9. № 1. C. 20–33.
10. McIsaac W.J., White D., Tannenbaum D., Low D.E. A clinical score to reduce unnecessary antibiotic use in patients with sore throat // CMAJ. 1998. Vol. 158. N 1. P. 75–83.
11. Maizia A., Letrilliart L., Colin C. Diagnostic strategies for acute tonsillitis in France: a cost-effectiveness study // Presse Med. 2012. Vol. 41. N 4. Р. 195–203.
12. Portier H., Grappin M., Chavanet P. New strategies for angina case management in France // Bull. Acad. Natl. Med. 2003. Vol. 187. N 6. P. 1107–1116.
13. Jacobs M.R. Emergence of antibiotic resistance in upper and lower respiratory tract infections // Am. J. Manag. Care. 1999. Vol. 5. Suppl. 11. Р. 651–661.
14. Тарасова Г.Д. Эпидемиология острого среднего отита в детской практике: Мат-лы Межд. конф. «Антибактериальная терапия в педиатрии». 25-26 мая 1999. С. 26–29.
15. American Academy of Pediatrics Subcommittee on Management of Acute Otitis Media. Diagnosis and management of acute otitis media // Pediatrics. 2004. Vol. 113. N 5. P. 1451–1465.
16. Fokkens W.J., Lund V.J., Mullol J. et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2012 // Rhinol. Suppl. 2012. Vol. 23. P. 1–298.
17. Внебольничная пневмония у детей: распространенность, диагностика, лечение, профилактика. Научно-практическая программа. М., 2010. 64 с.
18. Hazir T., Nisar Y.B., Qazi S.A. et al. Chest radiography in children aged 2-59 months diagnosed with non-severe pneumonia as defined by World Health Organization: descriptive multicentre study in Pakistan // BMJ. 2006. Vol. 333. P. 629.
19. Геппе Н.А., Малахов А.Б., Волков И.К. и др. К вопросу о дальнейшем развитии научно-практической программы по внебольничной пневмонии у детей // РМЖ. Педиатрия. 2014. № 3. С. 188–193.
20. Азовскова О.В., Иванчик Н.В., Дехнич А.В. и др. Динамика антибиотикорезистентности респираторных штаммов Streptococcus pyogenes в России за период 1999–2009 гг. // КМАХ. 2012. Т. 14. № 4. С. 309–321.
21. Gerber M.A., Baltimore R.S., Eaton C.B. et al. Prevention of Rheumatic Fever and Diagnosis and Treatment of Acute Streptococcal Pharyngitis // Circulation. 2009. Vol. 119. P. 1541–1551.
22. Brook I., Gober A.E. Role of bacterial interference and beta-lactamase-producing bacteria in the failure of penicillin to eradicate group A streptococcal pharyngotonsillitis // Arch. Otolaryngol. Head Neck Surg. 1995. Vol. 121. N 12. Р. 1405–1409.
23. Pichichero M.E. The Importance of Bacteriologic Eradication in the Treatment of Group A Streptococcal Tonsillopharyngitis // Clin. Pediatr. 2007. Vol. 46. P. 3–16.
24. Pichichero M.E. A review of evidence supporting the American Academy of Pediatrics recommendation for prescribing cephalosporin antibiotics for penicillin-allergic patients // Pediatrics. 2005. Vol. 115. N 4. P. 1048–1057.
25. Сидоренко С.В., Грудинина С.А., Филимонова О.Ю. и др. Резистентность к макролидам и линкозамидам среди Streptococcus pneumoniae и Streptococcus pyogenes в Российской Федерации // Клин. фармакол. и терапия. 2008. Т. 17. № 2. С. 1–4.
26. Casey J.R., Pichichero M.E. Metaanalysis of cephalosporin versus penicillin treatment of group A streptococcal tonsillopharyngitis in children // Pediatrics. 2004. Vol. 113. N 4. P. 866–882.
27. Козлов Р.С., Сивая О.В., Кречикова О.И. и др. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. // КМАХ. 2010. Т. 12. N 4. С. 329–341.
28. Сивая О.В., Козлов Р.С., Кречикова О.И. и др. Антибиотикорезистентность Haemophilus influenzae в России: результаты многоцентрового проспективного исследования ПеГАС // КМАХ. 2014. Т. 16. № 1. С. 57–69.
29. Leibovitz E., Jacobs M.R., Dagan R. Haemophilus influenzae: a significant pathogen in acute otitis media / /Pediatr. Infect. Dis. J. 2004. Vol. 23. N 12. P. 1142–1152.
30. Campagna J.D., Bond M.C., Schabelman E., Hayes B.D. The Use of Cephalosporins in Penicillin-allergic Patients: A Literature Review // J. Emerg. Med. 2012. Vol. 42. N 5. P. 612– 620.
31. Bradley J.S., Byington C.L., Shah S.S. et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America // Clin. Infect. Dis. 2011. Vol. 53. N 7. P. 25–76.
32. Pichichero M.E. Streptococcal Tonsillopharyngitis: Advantages of Shorter Antibiotic Courses. 2001. URL: http://www.medscape.com/viewarticle/418264.
33. Altamimi S., Khalil A., Khalaiwi K.A. et al. Short versus standard duration antibiotic therapy for acute streptococcal pharyngitis in children // Cochrane Database Syst. Rev. 2009. Vol. 21. N 1. CD004872.
34. Thanaviratananich S., Laopaiboon M., Vatanasapt P. Once or twice daily versus three times daily amoxicillin with or without clavulanate for the treatment of acute otitis media // Cochrane Database Syst. Rev. 2013. Vol. 12. CD004975.
35. Craig W.A. Antimicrobial resistance issues of the future // Diagn. Microbiol. Infect. Dis. 1996. Vol. 25. N 4. P. 213–217.
36. Jacobs M.R. Building in efficacy: developing solutions to combat drug-resistant S. pneumonia // Clin. Microbiol. Infect. 2004. Vol. 10. Suppl. 2. P. 18–27.
37. Fonseca W., Hoppu K., Rey L.C. et al. Comparing pharmacokinetics of amoxicillin given twice or three times per day to children older than 3 months with pneumonia // Antimicrob. Agents Chemother. 2003. Vol. 47. N 3. P. 997–1001.
38. Haider B.A., Saeed M.A., Bhutta Z.A. Short-course versus long-course antibiotic therapy for non-severe community-acquired pneumonia in children aged 2 months to 59 months // Cochrane Database Syst. Rev. 2008. Vol. 16. N 2. CD005976.
39. Greenberg D., Givon-Lavi N., Sadaka Y. et al. Short-course Antibiotic Treatment for Community-acquired Alveolar Pneumonia in Ambulatory Children: A Double-blind, Randomized, Placebo-controlled Trial // Pediatr. Infect. Dis. J. 2014. Vol. 33. N 2. P. 136–142.
.
обструктивный, хронический, острый у детей, у взрослых. Симптомы, лечение бронхита, антибиотики при бронхите
Бронхит — заболевание бронхов воспалительного характера. Бронхи — элемент дыхательной системы человека, который связывает трахею и легкие. Выделяют два главных бронха (с ними и связана трахея), а также их ответвления. Вместе они образуют бронхиальное дерево, посредством которого воздух попадает в легкие. По своей структуре бронхи похожи на трубочки. На их конце находятся альвеолы, через которые кислород проникает в кровь.Бронхи воспаляются под воздействием вирусов, вторичных инфекционных поражений, токсичных веществ, пыли, аммиака, дыма и заболеваний легочной системы. Бронхит наиболее опасен для людей пожилого возраста, курильщиков и людей с патологиями сердца и легких хронической формы. Заболевание бывает хроническим и острым. Симптоматика этих форм несколько отличается.
Острая форма развивается в большинстве случаев зимой и по начальным признакам походит на простуду. Кашель в начале заболевания — сухой, затем постепенно переходит во влажный. Мокрота при этом белая, желтая, иногда зеленоватая. Бронхит острой формы может сопровождаться повышением температуры тела и продолжаться не более трех недель.
Хроническая форма говорит о длительном течении заболевания с периодическими обострениями. Такой бронхит часто развивается у заядлых курильщиков. При хронической форме причиной кашля является чрезмерное выделение мокроты слизистой бронхов, а при остром или инфекционном бронхите — воспалительный процесс дыхательных путей. При наличии у пациента одышки можно говорить об обструктивном типе заболевания.
Лечением бронхита занимаются врачи-пульмонологи. При наличии острой формы врачи назначают соблюдение постельного режима, обильное питье, обезболивающие и жаропонижающие средства, такие как парацетамол. При бактериальном бронхите пульмонологи рекомендуют антибактериальные препараты. При терапии хронической формы применяют бронходилататоры, антибиотики и кортикостероиды. В качестве профилактики может применяться вакцинация населения от гриппа и от патологий, спровоцированных пневмококками. Если не начать лечение бронхита своевременно, велика вероятность, что он перерастет в эмфизему и приведет к осложнению дыхания. Чтобы обезопасить себя, необходимо как минимум вести здоровый образ жизни, а также соблюдать профилактические правила.
Заразен ли бронхит?
Бронхит является инфекционным заболеванием, а значит представляет опасность для окружающих. Чихая или кашляя, человек распространяет инфекцию в окружающую среду. Заражение может произойти и при разговоре с больным. Таким образом, бронхит заразен по причине воздушно-капельного распространения его возбудителей.
Причины бронхита
Как мы уже выяснили, бронхит — заболевание инфекционной природы. Его возбудителями являются бактерии (стафилококки, пневмококки и стрептококки), вирусы (аденовирус, вирус гриппа и парагрипп, респираторный синцитиальный вирус и др.) и атипичные представители вроде хламидий и микоплазм. В редких случаях причиной развития бронхита может стать грибок. Развитию заболевания способствует снижение деятельности иммунной системы. В зону риска входят лица старше 50 лет, люди с никотиновой и алкогольной зависимостью, работники вредного производства и пациенты с сопутствующими хроническими патологиями внутренних органов.
Симптомы и признаки бронхита
Основным симптомом бронхита любой формы является кашель, который, в свою очередь, может быть сухим или влажным. Сухой кашель не сопровождается выделением мокроты и характерен для вирусного и атипичного бронхита. Влажный с зеленой мокротой — явный признак бактериального бронхита. Для острой формы характерен приступообразный кашель с сопутствующими головными болями. Рассмотрим особенности симптоматики острого и хронического бронхитов. К признакам острой формы относят:
- повышение температуры тела до 39°С;
- вялость и утомляемость;
- озноб;
- потливость;
- рассеянные хрипы и жесткое дыхание при аускультации;
- одышка и боли в области грудины (при тяжелом бронхите).
Для хронической формы характерны:
- кашель с мокротой;
- сбивающееся дыхание при физических усилиях;
- возможна высокая температура.
Кровохарканье при данном заболевании встречается редко. Обычно этот симптом сведен к минимуму, но приступы сильного кашля могут спровоцировать разрыв сосуда в слизистой трахее.
Типы бронхита
Мы уже говорили, что бронхит может быть острым и хроническим, но это не вся его классификация. Например, типология острого острой формы заболевания включает следующие виды:
-
По причине развития бронхита выделяют инфекционный, смешанный бронхит и бронхит как последствие ингаляционного воздействия. Инфекционный бронхит — заболевание, спровоцированное патологическим влиянием вирусов и бактерий. Как последствие ингаляций оно может развиться по причине химического фактора. Смешанный тип бронхита объединяет в себе несколько факторов, например, бактериальный и химический.
-
В зависимости от механизма развития заболевания выделяют первичный и вторичный типы бронхита. Первичный — самостоятельная патология, вторичный — следствие других заболеваний.
-
По локации поражения различают бронхиолит, трахеобронхит и бронхит, поражающий средние бронхи.
-
По характеру воспаления бронхит может быть гнойным (выделения гнойного характера) и катаральным (выделения слизистого характера).
-
По характеру нарушения вентиляции легких выделяют обструктивный и необструктивный бронхит. При обструктивной форме поражаются бронхиолы и мелкие бронхи. Для этого типа бронхита характерно длительное течение. При необструктивной форме отсутствует нарушение вентиляции легких, а само заболевание протекает в целом благоприятно для пациента.
-
В зависимости от характера протекания заболевания выделяют затяжной и рецидивирующий бронхит. Второй наиболее распространен среди детей дошкольного возраста.
- Первичный и вторичный бронхиты (развивается самостоятельно и является следствием заболеваний легких соответственно).
- В зависимости от характера выделений различают катаральный (слизистая мокрота), смешанный (слизисто-гнойная мокрота) и гнойный (гнойная мокрота) бронхиты.
- Бронхит с обструкцией и без нее.
- Дистальный и проксимальный типы бронхита (в зависимости от локации бронхиального поражения).
Диагностика и обследование при бронхите
При подозрении на бронхит пациента обязательно направляют сдавать клинический анализ крови. Допуская возможность развития у больного пневмонии, врач дополнительно отправляет его и на рентген. Если при кашле у пациента выделяется мокрота, ее также исследуют: проводят микроскопическое исследование, окрашивая препарат по Граму.
При хронической форме бронхита следует провести посев мокроты на микрофлору и выявить чувствительность к антибактериальным средствам. Возможно взятие мазка из зева на выявление микрофлоры и грибов.
В случаях, когда бронхит становится частым явлением в жизни пациента, следует сделать анализ крови на антитела к инфекциям атипичного вида.
Спирография, или диагностика работы внешнего дыхания, проводится при наличии у пациента обструктивного бронхита. При нарушении бронхиальной проходимости дополнительно назначается проба с бронходилататором. Это помогает специалистам выявить сопутствующие заболевания и возможность обратимости патологии.
Определить наличие сопутствующих заболеваний помогает и бронхоскопия. При рецидивах бронхита врачи назначают рентгенологическую диагностику: флюорографию, рентгенографию и компьютерную томографию. Стоит сказать, что компьютерная томография наиболее информативна.
Лечение бронхита
Для успешного лечения бронхита важно провести своевременную диагностику и обратиться к пульмонологу для дальнейшего лечения. Врач подберет препараты и назначит процедуры в случае необходимости. В лечении бронхита важно соблюдать постельный либо полупостельный режим, иначе вместо выздоровления Вас ждут малоприятные последствия в виде осложнений. Для терапии бронхита используют противоинфекционные препараты. Как правило, такое лечение включает применение антибиотиков, противовирусных средств, отхаркивающих препаратов, бронходилататоров и витаминных комплексов. Лечение бронхита у взрослых, детей и беременных женщин имеет свои особенности. Разберем подробнее как лечить и вылечить бронхит, а также какие средства применяются для этого в медицине.Антибиотики при бронхите
Применение антибиотиков при бронхите является первостепенной мерой. Но назначать такие препараты должен исключительно Ваш лечащий врач после полного обследования и диагностики. Почему это так важно? Ответ крайне прост: при некоторых формах бронхита прием антибиотиков может лишь усугубить ситуацию (например, в случае вирусного бронхита). Итак, в лечении заболевания применяются следующие виды антибактериальных препаратов:
- Аминопенициллины (примеры: Амоксиклав, Амоксициллин, Аугментин). Направленно действуют на вредные микроорганизмы, уничтожая их клеточные стенки. Важно помнить, что антибиотики пенициллинового ряда способны вызывать аллергическую реакцию.
- Макролиды (примеры: Макропен, Сумамед). Тормозят процессы размножения микробов, нарушая синтез белка в их клетках. При затяжном бронхите макролиды можно применять в течение длительного времени. Плюсом препаратов этой группы является возможность их применения при лечении детей, беременных и кормящих женщин.
- Фторхинолоны (примеры: Офлоксацин, Левофлоксацин и Моксифлоксацин). Обладают широким спектром активности, но могут вызвать дисбактериоз. Их действие направлено на нарушение ДНК патогенных микроорганизмов. Часто такие препараты применяются в терапии обострений хронического бронхита.
- Цефалоспорины (примеры: Цефтриаксон, Цефазолин). Хорошо переносятся и подходят для борьбы с микроорганизмами, которых не смогли победить антибиотики-пенициллины. В основном препараты этого ряда назначаются пациентам с обструктивным бронхитом.
- Природные антибиотики от бронхита. Они не могут полностью заменить лекарства, но могут уберечь человека от многих инфекций. Преимуществом таких средств является то, что они укрепляют иммунную систему, не нарушая микрофлору кишечника. К ним относят чеснок, лук, корень хрена, гранат, черную редьку, малину, калину, мед, прополис, алоэ, мумие, ромашку, календулу, шалфей и эфирные масла некоторых растений.
Хронический бронхит характеризуется изменением структуры слизистой бронхов. В основном эта форма встречается у людей зрелого возраста. Для лечения хронического бронхита используются антибактериальные препараты из групп макролидов, тетрациклинов, а также средства с широким спектром активности. Для лечения острого бронхита не всегда применяют антибиотики, ведь в большинстве случаев данная форма вызвана зловредной активностью вирусов в организме человека. При обструктивном бронхите применение антибактериальных средств начинают только после выявления инфекции бактериальной природы. В случаях ее обнаружения назначают препараты групп фторхинолонов, аминопенициллинов и макролидов. Гнойный бронхит зачастую развивается на почве неграмотного лечения. В таких случаях при необходимости прибегают к помощи антибиотиков с широким спектром действия, наиболее успешно здесь и применение ингаляций.
Другие препараты при бронхите
Применение антибиотиков при бронхите мы рассмотрели. Теперь перейдем к противовирусным, отхаркивающим и бронхорасширяющим средствам. При обнаружении вирусной природы бронхита в состав лечения необходимо включить противовирусные препараты. Наиболее распространены лекарства Виферон, Генферон и Кипферон.
Терапию бронхитов трудно представить без назначения отхаркивающих средств. На сегодняшний самыми распространенными препаратами этой группы стали АЦЦ, Лазолван, Мукалтин, Бронхипрет, Бромгексин и Амброксол. Формы выпуска подобных средств разнообразны (сиропы, таблетки-шипучки, порошки и простые таблетки), а потому удобны в применении.
Если у пациента наблюдается одышка, в его лечение включаются бронходилататоры или, говоря простым языком, бронхорасширяющие средства — таблетки Эуфиллин и Теотард, аэрозоли для ингаляций Беротек, Сальбутамол. Комбинированным препаратом с бронхорасширяющим и отхаркивающим эффектом является Аскорил.
Помощь в лечении бронхита оказывают поливитамины. Дозировку и частоту приема любого препарата должен назначать лечащий врач.
Уколы при бронхите
{banner}Лечение бронхита в домашних условиях
Лечить воспаление бронхов народными средствами и процедурами удобно в домашних условиях. Распространенным методом такой терапии являются паровые ингаляции: для этого подойдет пар свежесвареной картошки. Вдыхать пары нужно осторожно, чтобы не получить ожог слизистой и не ухудшить состояние. Для ингаляций можно также использовать эфирные масла пихты, сосны и эвкалипта. Такие процедуры помогут увлажнить пораженную слизистую, усмирить кашель и уничтожить микробы.При бронхите высокоэффективными являются ингаляции небулайзером. Для раствора можно использовать обычную минеральную воду, физраствор или раствор Рингера. Такие ингаляции позволяют ускорить процесс отхождения мокроты, снять воспаление и облегчить дренаж бронхиального древа.
Большое распространение в лечении бронхита получили травяные сборы из чабреца, душицы, липы, подорожника, солодки и мать-и-мачехи. Травы успешно применяются при комплексной терапии хронической формы заболевания. Такой настой можно приготовить дома, смешав пол литра кипятка со столовой ложкой сбора и настояв его в течение двух часов. При бронхите полезно пить козье молоко и кумыс. Шалфей с молоком поможет ослабить приступообразный кашель. При бронхите в целом полезно обильное питье, особенно горячих напитков с медом и ягодами. Широкое распространение в народной терапии бронхита получила настойка лука (или чеснока) с медом. Для ее приготовления необходимо смешать натертый лук с медом в пропорции 3:1. Перед приемом следует проконсультироваться у врача по поводу возможного обострения состояния органов желудочно-кишечного тракта.
При домашнем лечении бронхита следует обратить внимание на свой рацион: в него должны входить белки и витамины в достаточном количестве. Не рекомендовано соблюдение ограничивающих диет. На период лечения больным необходимо отказаться от вредных привычек и работы на вредном производстве. Для домашнего лечения хронического бронхита успешно применяется гимнастика Стрельниковой.
Дыхательная гимнастика при бронхите
Дыхательная гимнастика проявила себя как успешный метод предотвращения и устранения застоя мокроты и восстановления структуры пораженной слизистой оболочки. Также дыхательные упражнения стимулируют защитные способности слизистой, устраняют воспаление и борются с болезненной микрофлорой. Наиболее известна и эффективна при бронхите дыхательная гимнастика Стрельниковой — она учит пациентов правильно дышать. Согласно Стрельниковой, вдыхать нужно коротко, но сильно и резко. Вдох через нос происходит громко и активно, а выдох через рот или нос — бесшумно и пассивно. Выполнять упражнения нужно ритмично.
Стрельникова разработала свой набор движений, который соединила с техникой дыхания. Вдох, согласно ее подходу, должен осуществляться единовременно с движением. Гимнастику Стрельниковой можно делать в любом положении: лежа, сидя и стоя. Нельзя делать упражнения через «не могу», тогда они не принесут пользы. Гимнастика Стрельниковой полезна при остром и хроническом бронхите. В случае острой формы заболевания упражнения следует начать на второй-третий день лечения антибиотиками. В период обострений хронического бронхита помимо гимнастики пользу принесет и физиотерапия.
Компрессы и горчичники при бронхите
Компрессы применяются при лечении бронхита в силу того, что действуют непосредственно на источник воспаления, улучшая микроциркуляцию и расслабляя гладкую мускулатуру бронхов. Данный метод особенно распространен при лечении детского бронхита. Компрессионное лечение почти не имеет противопоказаний, поскольку сами компрессы производятся из натуральных материалов и не оказывают негативного влияния на организм человека. Повязки с лекарством прикладывают в места проекции бронхов: на грудь, спину и горло. Важно знать, что лекарственные вещества не должны прикладываться к коже пациента — между кожей и компрессом должна быть проложена марля. Компресс должен быть закреплен и утеплен сверху теплой тканью. Согревающие компрессы нельзя прикладывать больным с повышенной температурой тела. Примером лекарства для компрессов является Димексид — препарат на основе чесночной вытяжки. Из подручных средств можно сделать лекарственную смесь самому. Для этого можно смешать мед, чеснок, водку и масла.
Еще один метод лечения при бронхите — горчичники. Особенное распространение получили горчичники на основе растительного масла. Для получения такого компресса необходимо нагреть масло на сковороде до 50°С, и промокнуть в нем горчичники. Их прикладывают на ночь в грудной и спинной области. Для прогревания можно использовать специальные гели и мази. Такое лечение успешно применяется при бронхите у детей. Для лечения взрослых чаще используется перцовый пластырь. Его действующим компонентом является красный перец. Перед креплением кожу следует обезжирить. Пластырь приклеивают в промежуток между лопатками и позвоночником, а также на ступни. Важно помнить, что прогревания имеют ограничения и противопоказания. Проводить подобные мероприятия противопоказано при наличии патологий сердечно-сосудистой системы, высокой температуре, сыпи и индивидуальной непереносимости веществ, входящих в состав согревающего компресса. Прогревания при бронхите у людей пожилого возраста требуют обязательной консультации лечащего врача.
Бронхит у детей
Симптомы бронхита у детей совпадают с признаками заболевания у взрослых, а вот лечение несколько отличается. Если у ребенка наблюдается одышка, необходимо исключить бронхиальную астму. При частом возникновении бронхита у детей имеет смысл проконсультироваться у аллерголога и выявить причины такого состояния. При лечении детского бронхита распространено применение ингаляций, которые могут проводиться на основе минеральной воды, отхаркивающих препаратов и бронходилататоров. В некоторых случаях для ингаляций используют антибиотики. Для домашних ингаляций хорошо подходит небулайзер. Антибактериальные препараты для детской терапии стараются назначать минимально. Как правило, их прием совмещается с применением антигистаминных и иммуностимулирующих средств. Эффективным детским фитоантибиотиком при бронхите является Умкалор. Препарат обладает бактериостатическим действием и успешно применяется в период долечивания бронхита. Чтобы избежать развития дисбактериоза на фоне приема антибиотиков, рекомендуется принимать средства, поддерживающие микрофлору кишечника. Продолжительность эффективного и своевременного лечения составляет до трех недель.
Бронхит при беременности
Бронхит довольно часто развивается в период беременности и требует своевременного лечения, так как может стать серьезной угрозой для мамы и плода. Симптомы заболевания у беременных идентичны общим, а вот препараты для его лечения отличаются. Для терапии бронхита у будущих мам нельзя использовать препараты типа тетрациклина, стрептомицина и левомицетина. Эуфиллин применяется, но с большой осторожностью. Антибиотик, разрешенный для лечения бронхита в период беременности, — Вильпрафен. Бронхит у женщин в положении стараются лечить при помощи ингаляций. В лечении любого заболевания у беременных есть свои сложности, ведь в течение первых трех месяцев следует избегать приема лекарств. Антибиотики при бронхите редко назначаются будущим мамам. В случае такой необходимости применяют антибактериальные средства пенициллинового ряда, так как они наиболее безопасны для плода. Во втором триместре можно использовать цефалоспорины.Профилактика бронхита
К профилактическим мерам бронхита относят:- Укрепление иммунитета в осенние и зимние периоды. Для этого подойдут препараты Бронхомунал, Рибомунил и поливитамины.
- Вакцинация ПНЕВМО 23 и от гриппа, которую рекомендовано проводить тем, кто оказался в зоне риска заражения бронхитом. Это актуально при наличии заболеваний хронической формы, при планировании беременности, при работе с людьми и при частом приеме противосвертывающих средств.
- Соблюдение правил гигиены, в частности мытье рук и применение одноразовых платков для носа, является профилактической мерой не только бронхита, но и многих других инфекционных заболеваний.
Осложнения после бронхита
При отсутствии своевременного лечения бронхита растет риск развития осложнений. В большинстве случаев осложнениям подвержены дети, пожилые и люди с ослабленным иммунитетом. Наиболее распространены следующие осложнения заболевания:
- Перерастание заболевания в хроническую форму. Хронический бронхит развивается на почве неграмотного или несвоевременного лечения заболевания, а также при частом воздействии негативных факторов.
- Воспаление легких.
- Бронхоэкстазы — расширения бронхов необратимого характера.
- Недостаточность дыхательной деятельности и дефицит кислорода.
- Недостаточность работы сердечной системы. Это осложнение связано с тем, что недостаток кислорода мешает полноценной работе сердца. Вследствие сердечного переутомления ухудшается работа внутренних органов и нарушается рН-баланс.
- Бронхиальная астма выступает в качестве осложнения аллергического типа бронхита.
- Бронхообструкция с характерным нарушением дыхания и затрудненным выдохом. Симптомом является свист при выдыхании.
- Эмфизема легких является последствием обструктивного бронхита хронической формы. Наблюдаются нарушения газообмена в легких и их эластичности, разрастание соединительной ткани, а также сужение бронхов и появление одышки при физических нагрузках.
- Диффузный пневмосклероз проявляется искажением и сморщиванием легочной ткани. При этой патологии легкие уменьшаются в размере и, соответственно, нарушается снабжение организма кислородом в достаточном количестве.
- Редки случаи осложнения в виде легочного сердца. Поражение структур легкого провоцирует рост артериального давления, нарушение газового обмена и гипертрофию правого желудочка.
Пенициллин — правильное назначение детям
Aust Prescr. 2020 июн; 43 (3): 81–84.
, Качественное использование лекарств, безопасность лекарств и надзор за противомикробными препаратами, фармацевт [1], * , штатный специалист, инфекционные заболевания [1], * и Грег Роулз, врач общей практики [2]Мона Мостагим
* оба этих автора внесли равный вклад
Брендан Дж. Макмаллан
* оба этих автора внесли одинаковый вклад
[1] Детская больница Сиднея
[2] Ридделлс-Крик, Виктория.
* оба этих автора внесли равный вклад
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution Non-Commercial No Derivatives (CC BY-NC-ND) 4.0.
РЕЗЮМЕ
Пенициллины обычно назначают детям. Рекомендации в информации о продукте могут быть не самыми подходящими дозами для детей и могут содержать клинические показания, которые предпочтительно лечить другими антибиотиками
Авторитетные рекомендации, например, Терапевтические рекомендации: антибиотики, предлагать актуальные рекомендации по оптимальному выбору, пути введения , дозировка и продолжительность перорального приема пенициллинов у детей
В большинстве случаев для расчета дозы в мг на кг следует использовать вес ребенка, не превышая максимальную дозу для взрослых
При назначении более высоких доз амоксициллина или флуклоксациллина в зависимости от веса проверьте объем пероральной жидкости, необходимый для завершения курса лечения для обеспечения адекватного снабжения
Ключевые слова: антибиотиков, контроль противомикробных препаратов, использование не по назначению, пенициллины, педиатрия
Введение
Нормы назначения и отпуска антибиотиков для младенцев и детей младшего возраста выше, чем для любой другой возрастной группы до 65 лет. 1 Пенициллины, такие как амоксициллин и комбинация амоксициллин / клавуланат, входят в число наиболее часто используемых антибиотиков в системе первичной медико-санитарной помощи.
При наличии показаний очень важно, чтобы детям был назначен оптимальный выбор, дозировка, режим и продолжительность приема антибиотиков. Австралийские руководства, в том числе «Терапевтические рекомендации: антибиотик», 2 , содержат современные рекомендации по назначению пероральных пенициллинов детям. Вместо этого врачи могут заказать дозу, рекомендованную в информации о продукте, поскольку она находится в свободном доступе в Интернете и интегрирована во многие электронные системы назначения лекарств. 3 Однако рекомендации в информации о продукте могут быть не самыми подходящими дозами для детей (см. Вставку). Он может включать только показания и дозы, одобренные Управлением терапевтических товаров при регистрации. Поскольку большинство пероральных препаратов пенициллина в Австралии используются более 20 лет и, как правило, не защищены патентами, актуальная информация о дозировках может не включаться в информацию о продукте, особенно для детей.
Box
Примеры ловушек при назначении пероральных пенициллинов детям
Амоксициллин
У 2-летнего ребенка с массой тела 12 кг легкая или умеренная пневмония, которую можно лечить пероральными антибиотиками.Рекомендуемая в терапевтических рекомендациях доза составляет 25 мг / кг / дозу или 300 мг каждые восемь часов.
Рекомендуемая доза в информации о продукте составляет 13,3 мг / кг / дозу или 160 мг каждые восемь часов. Если бы это было соблюдено, ребенок получил бы примерно половину дозы, рекомендованной действующими руководящими принципами.
Амоцициллин / клавулановая кислота
У 5-летнего ребенка массой 20 кг есть средний отит, резистентный к амоксициллину, и он лечится амоксициллин / клавулановой кислотой.Доза, рекомендованная в терапевтических рекомендациях, составляет 7: 1 в соотношении 22,5 мг / кг амоксициллина (450 мг) с 3,2 мг / кг клавулановой кислоты каждые 12 часов.
В информации о продукте рекомендуется формула 4: 1 амоксициллин: клавулановая кислота в дозе 13,3 мг / кг амоксициллина (265 мг) и 3,3 мг / кг клавулановой кислоты каждые восемь часов. Эта дозировка и частота отличаются от текущих рекомендаций, а избыток клавулановой кислоты увеличивает риск побочных эффектов со стороны желудочно-кишечного тракта.
Флуклоксациллин
Трехлетний ребенок весом 15 кг получает перорально флуклоксациллин в качестве постепенной терапии остеомиелита после выписки из больницы.Терапевтические рекомендации рекомендуют 25 мг / кг / дозу или 375 мг каждые шесть часов.
В информации о продукте рекомендуется 125 мг флуклоксациллина каждые шесть часов, что составляет примерно треть дозы, рекомендованной в текущих руководствах.
Назначение детям
Многие детские инфекции вообще не требуют антибиотиков, в том числе:
распространенные самоограниченные инфекции
вирусные инфекции
бактериальные инфекции, требующие дренажа или другого физического лечения (например,грамм. кожный абсцесс, стоматологические инфекции, требующие своевременного лечения зубов).
Совместное принятие решений с родителями — эффективный подход к правильному использованию антибиотиков и сокращению чрезмерного использования антибиотиков.
«Дети — не маленькие взрослые» — частый комментарий от педиатров. Эпидемиология, клинические проявления и прогноз некоторых инфекций у детей отличаются от взрослых. Понимание этого является ключом к своевременной диагностике и хорошему контролю над противомикробными препаратами.К тому же фармакокинетика у детей может быть разной. Это было очевидно с самого начала приема пероральных пенициллинов — секреция желудочного сока, перистальтика кишечника и pH препарата влияют на абсорбцию. В зависимости от возраста и нездоровья ребенка это может привести к увеличению или уменьшению абсорбции по сравнению со взрослым. Однако величина этих эффектов наиболее велика в течение первых двух лет жизни. 4
В педиатрических исследованиях требования к дозировке часто превышали ожидаемую дозу для размера тела. 4 , 5 Прямое сравнение педиатрических исследований осложнялось неполнотой информации о возрасте или весе пациентов, использовании различных концентраций продукта, мерных ложках и «округлении» доз для удобного введения. 4 , 6
В идеале эмпирическое назначение должно основываться на вероятном возбудителе и фармакокинетике и фармакодинамике антибиотика. Информация о дозировке для детей включена в «Терапевтические рекомендации», «Детский дозатор AMH» и в руководства детских больниц.
Когда требуется пенициллин, его следует назначать в дозах, которые, как ожидается, позволят безопасно максимизировать время, в течение которого препарат остается выше минимальной ингибирующей концентрации для патогена. Если возможно, анализ культур и результатов тестирования на чувствительность гарантирует, что будет использован правильный препарат с самым узким спектром действия.
Пенициллины узкого спектра действия активны в отношении Streptococcus pyogenes (стрептококки группы А). Феноксиметилпенициллин широко используется при рожистом воспалении, стрептококковом тонзиллите и стоматологических инфекциях, требующих применения антибиотиков.
Амоксициллин активен против чувствительной Escherichia coli . Добавление ингибитора бета-лактамаз клавулановой кислоты увеличивает способность лечения определенных грамотрицательных организмов.
При инфекциях Streptococcus pneumoniae (кроме менингита) с пониженной чувствительностью к пенициллину может оказаться эффективным увеличение дозы пенициллина или амоксициллина. Использование амоксициллина / клавулановой кислоты в этом случае не дает дополнительных преимуществ, поскольку резистентность к пенициллину у Streptococcus pneumoniae не опосредуется бета-лактамазой. 7 При пневмонии легкой и средней степени тяжести пероральный амоксициллин рекомендуется в терапевтических рекомендациях в дозе 25 мг / кг каждые восемь часов и в рекомендациях Всемирной организации здравоохранения 8 в дозе 40 мг / кг каждые 12 часов. Он не уступает парентеральным вариантам в этом состоянии.
Амоксициллин / клавулановая кислота подходит для лечения штаммов, продуцирующих бета-лактамазы, штаммов Haemophilus influenzae и Moraxella catarrhalis . Если требуется более высокая доза амоксициллина, детям в возрасте двух месяцев и старше следует назначать препарат с более низкой дозой клавулановой кислоты.
Продолжительность терапии зависит от показаний. Многие распространенные неосложненные инфекции можно лечить более короткими курсами антибиотиков, чем обычно. 9
Дозирование по возрасту или весу — практические проблемы
Во многих случаях неясно, основаны ли принципы дозирования и рекомендуемые возрастные группы в информации о продукте на удобстве или возникают по другим причинам — они не учитывают рост и метаболизм развитие происходит в каждой возрастной группе.В пределах возрастных групп, например в возрасте шести или 12 лет, средний ребенок 10 может получать дозы феноксиметилпенициллина, которые либо превышают максимальную, либо не соответствуют минимальной дозе для веса. Для амоксициллина это приводит к существенным различиям для детей чуть выше или ниже 20 кг.
Диапазоны доз дополнительно расширяются для пациентов с самым низким и самым высоким процентилем веса для возраста, наиболее очевидно среди детей 10–14 лет, у которых разница между 5-м и 90-м процентилями является наибольшей.Достижение адекватных концентраций лекарств у пациентов с избыточным весом и ожирением является растущей проблемой в таких странах, как Австралия, где около четверти детей и подростков (5–17 лет) попадают в эту категорию. 11 Дозы, основанные только на возрасте, могут быть субтерапевтическими и приводить к неэффективности лечения и повышенному риску резистентности, или могут быть чрезмерно большими дозами, основанными на более высоком возрастном диапазоне. 12 В большинстве случаев для расчета дозы в мг на кг следует использовать вес ребенка, не превышая максимальную дозу для взрослых.
Объем и размер упаковки
Расхождения между дозой и продолжительностью, рекомендованными в информации о продукте и руководствах, создают новые проблемы. 13 Детям старшего возраста могут потребоваться дополнительные таблетки, а детям младшего возраста может потребоваться больший объем пероральной жидкости по сравнению с тем, что предоставляется в стандартных упаковках. 14
Феноксиметилпенициллин
Когда феноксиметилпенициллин стал доступен, для взрослых стали обычно применяться дозы в диапазоне от 60 до 120 мг 3–6 часов. 15 — 17 Дозы для детей обычно уменьшались вдвое, но при тяжелых детских инфекциях эти половинные дозы часто удваивались. 17 — 19 В австралийской информации о продуктах продолжают применяться те же общие принципы, которые допускают широкий диапазон доз. Дозы феноксиметилпенициллина для лечения тонзиллита у детей два раза в день не указаны в информации о продукте, хотя этот упрощенный режим обычно назначается и, как сообщается, дает аналогичные результаты. 20 Терапевтические рекомендации рекомендуют 15 мг / кг (до 500 мг) 12-часового приема феноксиметилпенициллина при фарингите или тонзиллите, требующих антибиотиков.
Амоксициллин
Рекомендации в информации о продукте для суспензий амоксициллина — 250 мг / 5 мл и 125 мг / 5 мл — обычно не отличаются от доз, используемых в исследованиях, проведенных в 1970-х годах. Педиатрические дозы предусмотрены только для детей с массой тела менее 20 кг. 21 В информации о продукте рекомендуются дозы 6.6 мг / кг каждые восемь часов (20 мг / кг / день) с удвоением дозы для тяжелых инфекций, инфекций с менее восприимчивыми организмами или инфекций нижних дыхательных путей. Вполне вероятно, что такие низкие дозы часто недостаточны — данные из США по острому среднему отиту показывают, что 83% из Streptococcus pneumoniae чувствительны к амоксициллину в дозе 40 мг / кг / день. 22 Дозировка два раза в день в дозе 60 мг / кг / день (по 30 мг / кг / доза до максимум 1 г каждые 12 часов) разрешена для использования при остром среднем отите в Австралии.Назначение амоксициллина новорожденным в Австралии не разрешается, как и более высокие дозы амоксициллина, несмотря на то, что они были изучены и лицензированы за рубежом. 23 Терапевтические рекомендации 2 рекомендует дозы 15 мг / кг каждые восемь часов для инфекций мочевыводящих путей (с чувствительными микроорганизмами) и 25 мг / кг каждые восемь часов при пневмонии.
Амоксициллин / клавулановая кислота
Клавулановая кислота (клавуланат), ингибитор бета-лактамазы, добавляется к основной цепи амоксициллина.Педиатрические составы этой комбинации в соотношении 7: 1 (400 мг: 57 мг в 5 мл) обеспечивают более высокий компонент амоксициллина при таких показаниях, как острый средний отит. Это оптимизирует эффективность и сводит к минимуму диарею, связанную с употреблением слишком большого количества клавулановой кислоты. 24 Несмотря на это, продукты с большей долей клавулановой кислоты (4: 1, 125 мг: 31,25 мг в 5 мл) по-прежнему рекомендуются для детей в информации о продукте.
Флуклоксациллин
Утвержденные в Австралии показания для применения флуклоксациллина включают пневмонию и инфекции кожи и костей.Для детей в информации о продукте рекомендуется назначать половину или четверть дозы для взрослых в зависимости от возраста. В ранних исследованиях дозы флуклоксациллина 12,5 мг / кг для детей давали такие же концентрации, как у взрослых, получавших дозу 500 мг. Однако новорожденные имели более высокую абсорбцию, чем дети более старшего возраста, 25 и младенцы в возрасте до шести месяцев имели лучшую абсорбцию, чем дети старшего возраста, получавшие жидкие препараты. 26 Более высокие дозы и дозы в зависимости от веса, рекомендованные во многих руководствах для лечения костных инфекций у детей, не включены в информацию о продукте.
Заключение
Доказательства в пользу оптимального назначения пенициллина для детей остаются ограниченными по сравнению со взрослыми. Рекомендации по дозировке, доступные в информации о продукте, содержат рекомендации, которые часто заменяются регулярно обновляемыми, основанными на фактах источниками, такими как терапевтические рекомендации.
Лица, выписывающие рецепты, должны иметь доступ к доказательствам и обновленным руководствам для принятия решений в интересах детей. Для улучшения этого и поддержки надлежащего использования пенициллинов и других противомикробных препаратов в обществе необходимо сотрудничество между регулирующими органами, фармацевтическими компаниями и поставщиками программного обеспечения.
Сноски
Брендан МакМаллан, Грег Роулз и Мона Мостагим внесли свой вклад в самое последнее издание eTG. Брендан Макмаллан и Мона Мостагим также дали советы для разделов Детского пособия по дозированию AMH.
СПИСОК ЛИТЕРАТУРЫ
2. Группа экспертов по антибиотикам. Антибиотик. В eTG полный [Интернет]. Мельбурн: ограниченные терапевтические рекомендации; 2019 г. https://tgldcdp.tg.org.au [цитируется 1 мая 2020 г.] 7. Санчес Наварро А. Новые препараты амоксициллина / клавулановой кислоты: фармакокинетический и фармакодинамический обзор.Клин Фармакокинет 2005; 44: 1097-115. . 10.2165 / 00003088-200544110-00001 [PubMed] [CrossRef] [Google Scholar] 12. Гэйд К., Кристенсен Х.Р., Далхофф К.П., Холм Дж. К., Холст Х. Несоответствия в практике дозирования у детей с избыточным весом или ожирением: ретроспективное когортное исследование. Pharmacol Res Perspect 2018; 6: e00398. . 10.1002 / prp2.398 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 18. Bowerbank AG. Феноксиметилпенициллин. Br Med J 1955; 2: 1028-9. https://doi.org/10.1136/bmj.2.4946.1028-c [Google Scholar] 19.Фармацевтическая ассоциация Австралии. Австралийский фармацевтический формуляр APF. 10-е изд. Виктория; 1969. [Google Scholar] 20. Лан А.Дж., Колфорд Дж. М., Колфорд Дж. М., младший Влияние частоты дозирования на эффективность 10-дневной терапии пенициллина или амоксициллина при стрептококковом тонзиллофарингите: метаанализ. Педиатрия 2000; 105: E19. . 10.1542 / peds.105.2.e19 [PubMed] [CrossRef] [Google Scholar] 21. Мудрый PJ, Neu HC. Опыт применения амоксициллина: общее резюме клинических испытаний в США.J заразить Дис 1974; 129 (Дополнение 2): S266-71. . 10.1093 / infdis / 129.Supplement_2.S266 [PubMed] [CrossRef] [Google Scholar] 22. Либерталь А.С., Кэрролл А.Е., Чонмайтри Т., Ганиатс Т.Г., Хоберман А., Джексон М.А. и др. Диагностика и лечение острого среднего отита. Педиатрия 2013; 131: e964-99. . 10.1542 / peds.2012-3488 [PubMed] [CrossRef] [Google Scholar] 24. Куен Дж., Исмаэль З., Лонг П.Ф., Баркер К.И., Шарланд М. Сообщенные показатели диареи после пероральной терапии пенициллином в педиатрических клинических испытаниях. J Pediatr Pharmacol Ther 2015; 20: 90-104.10.5863 / 1551-6776-20.2.90 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25. Бергдал С., Эрикссон М., Финкель Ю. Концентрация в плазме после перорального приема ди- и флуклоксациллина у младенцев и детей. Фармакол Токсикол 1987; 60: 233-4. . 10.1111 / j.1600-0773.1987.tb01741.x [PubMed] [CrossRef] [Google Scholar] 26. Бергдал С., Эрикссон М., Финкель Ю., Леннергрен К. Пероральная абсорбция флуклоксациллина у детей грудного и раннего возраста. Acta Pharmacol Toxicol (Копен) 1986; 58: 255-8. . 10.1111 / j.1600-0773.1986.tb00105.x [PubMed] [CrossRef] [Google Scholar]Почему детей следует обследовать, чтобы определить, настоящие ли они
Выберите автора: Аарон Барбер, AT, ATC, PESAbbie Roth, MWC, Адам Остендорф, MD Адриан Бейлис, доктор философии, CCC-SLP, Адриенн М. Флуд, Совет продвинутых поставщиков медицинских услуг CPNP-AC, Aila Co, MDAlaina White, AT, ATCAlanaless Milton, MDAleDA, MDAleDA Jayne Кемпер, MD Александра Функ, PharmD, DABATA Александра Санкович, MD Алексис Кленке, RD, LDAlice Bass, CPNP-PCAlison PeggAllie DePoyAllison Rowland, AT, ATCAllison Strouse, MS, AT, ATCAmanda E.Граф, доктор медицины Аманда Смит, RN, BSN, CPNAmanda Sonk, LMTAmanda Whitaker, MD Эмбер Паттерсон, MD Амберл Пратер, доктор философии, LPCCAmy Coleman, LISWAmy Dunn, MDAmy E. Valasek, MD, MScAmy Fanning, PT, DPTAmy Garee, CPNahP-PCA ХессЭми Лебер, доктор медицины, доктор медицинских наук, Эми Моффетт, CPNP-PC, Эми Рэндалл-МакСорли, MMC, кандидат юридических наук, Анастасия Фишер, доктор медицины, FACSMAndala Hardy, Андреа Брун, CPNP-PC, Андреа М. Бургер, MEd, CCC-SLPA, Билл-Шандер, Билл, Билл, Эндрю LISW-SAnn Pakalnis, MD Анна Лиллис, MD, PhDAnnette Haban-BartzAnnie Drapeau, MDAnnie Temple, MS, CCC-SLP, CLCAnthony Audino, MDAnup D.Патель, Ари Рабкин, ФДариана Хоэт, доктор философии Эшли Куссман, МДЭшли Экстайн, Эшли Крун Ван Дист, Эшли М. Дэвидсон, AT, ATC, MSAshley Minnick, MSAH, AT, ATCAshley General, FNPAshley Park-PCW. -SAshley Tuisku, CTRSAsuncion Mejias, MD, PhDAurelia Wood, MD Бейли Янг, DOBecky Corbitt, RNBelinda Mills, MD Бенджамин Филдс, PhD, MEdBenjamin Kopp, MDBernadette Burke, AT, ATC, MSBethan Martin, OVI Уокер, доктор философии Бхувана Сетти, доктор медицинских наук, Билл Кульджу, магистр медицины, ATBlake Skinner, Бонни Горли, MSW, LSW, Брэд Чайлдерс, RRT, BS, Брэнди Когдилл, RN, BSN, CFRN, EMT-PBreanne L.Бауэрс, PT, DPT, CHT, CFST Брендан Бойл, MD, MPH Брайан Бо, MD Брайан К. Каспар, доктор философии Брайан Келлог, MD Бриана Кроу, PT, DPT, OCS Агри Торунер, доктор медицинских наук, Кейтлин Талли, Калеб Мосли, Каллиста Дамман, Ками Винкельспехт, доктор медицинских наук, Кэнис Креран, доктор медицинских наук, доктор Карл Х. Бэкес, доктор медицинских наук, Карло Ди Лоренцо, доктор медицинских наук, Карол Баумхардт, доктор медицинских наук, Карло Ди Лоренцо, доктор медицинских наук, Карол Баумхард, доктор медицинских наук, Кейси Коттрилл, доктор медицинских наук, Би-би-си Нэбассин, Нэбассин, Нэбассин, Нэбассин, Нэнблкен PhDCharae Keys, MSW, LISW-SCharles Elmaraghy, MD Челси Достер, BSCheryl Boop, MS, OTR / LCheryl G.Бакстер, CPNPШерил Гариепи, MDChet Kaczor, PharmD, MBAChris Smith, RNChristina Ching, MDChristina DayChristine Johnson, MA, CCC-SLPChristine Mansfield, PT, DPT, OCS, MDChristine PrusaChristopher Goettee, PTC, DPT , OCS, NASM-PESCody Hostutler, PhDConnor McDanel, MSW, LSWCorey Rood, MDCorinne Syfers, CCLSCourtney Bishop. PA-CC Кортни Холл, CPNP-PC, Кортни Портер, RN, MSCrystal Milner, Курт Дэниелс, доктор медицины Синтия Холланд-Холл, доктор медицинских наук, MPHDana Lenobel, FNP, Дана Ноффсингер, CPNP-AC, Дейн Снайдер, MD Дэниел Кури, MD Дэниел Пи Джуста, MD Дэниел, Дэниел Wessells, PT, MHAD, Дэвид Аксельсон, MD Дэвид Стукус, MD Дин Ли, MD, PhD Дебби Терри, Н. П. Дебора Хилл, LSW, Дебора Зеркл, LMTDeena Chisolm, PhD Дейпанджан Нанди, MDDeipanjan NandiDS, MDDenisomin, R.Уильямс, доктор медицины, магистр здравоохранения, FAAP, дипломированный специалистDonna TeachDoug WolfДуглас Маклафлин, MDDrew Duerson, MDEd MinerEdward Oberle, MD, RhMSUSEdward Shepherd, MDEileen Chaves, PhDElise Berlan, MDElise DawkinsElizabeth A. Cannon, LPCCa, LPCC , MT-BCE Эмили А. Стюарт, доктор медицинских наук, Эмили Декер, доктор медицинских наук, Эмили Гетчман, Эмма Высоцки, PharmD, RDNEric Butter, PhDEric Leighton, AT, ATCEric Sribnick, MD, PhDErica Domrose, RD, LDEricca L Lovegrove, RDErika Roberts, Эрин Гейтс, М.Ed., CSCSErin Shann, BSN, RNErin TebbenFarah W. Brink, MDGail Bagwell, DNP, APRN, CNSGail Swisher, ATGarey Noritz, MDGary A. Smith, MD, DrPHGeri Hewitt, MDGina Hounam, PhDGina McDowellGina Minotregory D. , MDGriffin Stout, MDGuliz Erdem, MDHailey Blosser, MA, CCC-SLP, Hanna MathessHeather Battles, MDHeather Clark, Heather Yardley, PhD, Генри Спиллер, Herman Hundley, MS, AT, MD, CSCS, Hiren Patel, MDHoma Amini, D. , MDIhuoma Eneli, MDIlana Moss, PhDIlene Crabtree, PTIrene Michael, MDIrina Buhimschi, MDIvor Hill, MDJackie Cronau, RN, CWOCNJacqueline Wynn, PhD, MDDJacquelyn Doxie King, PhDJaimeson, MDJaimes-Dawn Маттингли, доктор медицинских наук, Джейми Маклин, доктор медицинских наук, Джейн Абель, Джанель Хюфнер, магистр медицины, CCC-SLP, Дженис Таунсенд, доктор медицинских наук, доктор медицинских наук, Джаред Сильвестр, Джейссон Эйхольц, Жан Хрущак, магистр медицины, CCC / SLP, Джефф Сидс, доктор медицинских наук, доктор медицинских наук, Джеффри Аулетта, Джеффри Беннет, Леон, Джеффри Беннет, Джеффри ell, PT, MSPTJena HeckJenn Gonya, PhDJennifer Borda, PT, DPTJennifer HofherrJennifer LockerJennifer Reese, PsyD Дженнифер Смит, MS, RD, CSP, LD, LMT Дженни Уортингтон, PT, DPT Джерри Р.Mendell, MD Джессалин Майер, MSOT, OTR / L, Джессика Бейли, PsyD, Jessica Bogacik, MS, MT-BC, Джессика Боуман, MD, Джессика Брок, Джессика Баллок, MA / CCC-SLP, Джессика Бушманн, RD, Джессика Шерр, PhD, Джим О’Ши, O’Shea, OTJo, MOT, MOT -SJohn Ackerman, PhD John Caballero, PT, DPT, CSCSJohn Kovalchin, MD Джонатан Д. Теккерей, MD Джонатан Финлей, MB, ChB, FRCPJonathan M. Grischkan, MD Джонатан Наполитано, MD Джошуа Уотсон, MDJulee, RT , OTR / LJulie ApthorpeJulie Leonard, MD, MPHJulie Racine, PhD, Julie Samora, MD Джастин Индик, MD, PhD, Кэди Лейси, Кейли Хейг, MA, MT-BC, Кейли Матесик, Камила Тваймон, LPCC-SKara Malone, MDKara Miller, Allen .Meeks, OTKari Dubro, MS, RD, LD, CWWSKari Phang, MDKarla Vaz, MDKaryn L. Kassis, MD, MPHKasey Strothman, MDKatherine Deans, MDKatherine McCracken, MDKathleen (Katie) RoushKathryn B.S. Обринба, доктор медицины Кэти Бринд’Амур, магистр Кэти Томас, APR Катрина Холл, Массачусетс, CCLS, Катрина Руге, LPCC-SKatya Harfmann, MD Кайла Зимпфер, PCCKelley SwopeKelli Dilver, PT, DPTKelly AbramsKelly BooneKelly HustonNally, J. PCKelly Pack, LISW-SKelly Tanner, PhD, OTR / L, BCPKelly Wesolowski, PsyDKent Williams, MDKevin Bosse, PhD, Кевин Клингеле, MDKim Bjorklund, MDKim Hammersmith, DDS, MPH, MSKimberly Bates, MDKimberly DPS, PT, DPT, SCS Кирк Сабалка, Крис Джатана, MD, FAAP Криста Победитель, AuD, CCC-AKristen Armbrust, LISW-SKristen Cannon, MD Кристен Мартин, OTR / LKristi Roberts, MS MPHКристина Бут, MSN, CFNPKristina Reberzie, MDKyleen, MDKyleen , МАЛАура Брубакер, BSN, RN, Лаура ДаттнерL Аурел Бивер, LPCЛорен Дуринка, AuDLauren Garbacz, PhDLauren Justice, OTR / L, MOTLauren Madhoun, MS, CCC-SLPLauryn RozumLee Hlad, DPMLeena Nahata, MD , DPT Линдси Шварц, Линдси Фатер, PsyD, Лиза Голден, Лиза М.Хамфри, MD Логан Бланкемейер, MA, CCC-SLPLori Grisez PT, DPTLorraine Kelley-QuonLouis Bezold, MDLourdes Hill, LPCC-S Любна Мазин, PharmDLuke Tipple, MS, CSCSLynda Wolfe, PhDLyndsey MillerLynn Rosenthal, MS , Доктор медицины Манмохан К. Камбодж, доктор медицины Марк Левит, доктор медицины Марк П. Михальский, доктор медицины Марсель Дж. Казавант, доктор медицинских наук Марси Джонсон, LISW-SMarco Corridore, доктор медицины Маргарет Басси, OTR / LMaria HaghnazariMaria Vegh, MSN, RN, BSN, Марисса Гала Кондонан, Э. Марк Смит, MS RT R (MR), физик ABMP Марни Вагнер, доктор медицины Мэри Энн Абрамс, доктор медицины, магистр здравоохранения Мэри Фристад, доктор философии, ABPP Мэри Кей Шарретт Мэри Шулл, доктор медицины Мэттью Уошам, доктор медицины, магистр здравоохранения Миган Хорн, Мэгэн Брундретт, доктор медицины Меган Лиган, Меган Лиган, О. Доктор медицинских наук, М.Эд Меган Касс, PT, DP TM Меган Фишер, BSN, RN Meika Eby, MD Мелани Флуеллен, LPCC Мелани Люкен, LISW-SMelissa и Микаэль Макларен Мелисса МакМиллен, CTRS Мелисса Винтерхальтер, MDMeredith Merz Lind, MDMichael T. DPTMitch Ellinger, CPNP-PC, Молли Гарднер, PhDMonica Ardura, DOMonica Ellis, Моника Голдшмидт, MDMotao Zhu, MD, MS, PhDNancy AuerNancy Cunningham, PsyDNancy Wright, BS, RRT, RCP, AE-C, Наоми Кертес, SIC, LPDC- CSNatalie Rose, BSN, RNNathalie Maitre, MD, PhD, Общенациональная детская больница, Национальная детская больница, эксперты по поведенческому здоровью Ниту Бали, MD, MPH Нехал Парих, DO, MS Николь Майер, OTR / L, MOTNicole Caldwell, MDNicole Dempster, Психол Поликоль, Психол Гринвуд , BCBA-DNina WestNkeiruka Orajiaka, MBBSOliver Adunka, MD, FACSOlivia Stranges, CPNP-PCOlivia Thomas, MDOmar Khalid, MD, FAAP, FACCOnnalisa Nash, CPNP-PCOula KhouryPaige Duly, CTRSParker Huston C., PhDP.Уолц, доктор медицины Патрик Куин, BSN, RNPedro Weisleder, MDPeter Minneci, MDPeter White, PhDPreeti Jaggi, MDRachael Morocco-Zanotti, DORachel D’Amico, MDRachel Schrader, MDRachel D’Amico, MDRachel Schrader, CPNP-PCRachel Tyson, LSWRajan Thakkara Льюис, AuD, CCC-AR, Эгги Эш-младший, Рено Равиндран, MD Ричард Киршнер, MD Ричард Вуд, MD Роберт А. Ковач, MD, Ph.D. Рошель Кроуз, CTRS Рохан Генри, MD, MS , ATCСаманта Боддапати, доктор философии Саманта Мэлоун, Сэмми Лебедь, Сандра К.Ким, врач Сара Бентли, MT-BC Сара Брейдиган, MS, AT, ATC Сара Н. Смит, MSN, APRN Сара О’Рурк, MOT, OTR / L, клинический руководитель Сара А. Денни, MD Сара Клайн, CRA, RT (R) Сара Дрисбах, CPN, APN Сара Гринберг Сара Хасти, BSN, RNC-NIC Сара Кейм, доктор медицины Сара Майерс Сара О’Брайен, доктор медицинских наук Сара Саксбе Сара Шмидт, LISW-SS Сара Скотт Сара Трейси Сара Верли, доктор медицинских наук, доктор медицинских наук, доктор медицинских наук, Скотт Скотт, доктор медицинских наук Сатья Гедела (Великобритания) , MDSean EingSean Rose, MDSeth Alpert, MDShana Moore, MA, CCC-AS, Shannon Reinhart, LISW-SShari UncapherShann Wrona, DNP, PNP, PMHSShawn Pitcher, BS, RD, USAWShawNaye Scott-MillerSheila LeeNSimonites, MSR AC / PC, CPONStefanie Bester, MDStefanie Hirota, OTR / LStephanie Burkhardt, MPH, CCRCStephanie CannonStephanie Santoro, MDStephanie Vyrostek BSN, RNStephen Hersey, MDSteve Allen, MDSteven C.Матсон, доктор медицины Стивен Чичора, доктор медицины Стивен Кафф, Суэллен Шарп, OTR / L, MOT Сьюзан Колас, доктор медицины Сьюзан Крири, доктор медицины Суруп Пинто, доктор медицины Табата Баллард, Таббета Греко, Таби Эванс, Табита Джонс-Макнайт, доктор медицины Тэхагод Мохаммед, доктор медицинских наук, Дэниэл-Макнайт, доктор Тэхагод Мохаммед, доктор медицинских наук, Дамара Янг-Маар, MS, RPhТереза Миллер, BA, RRT, RCP, AE-C, CPFTThomas Pommering, DOThomas Savage, Тиаша Летостак, PhD, Tiffanie Ryan, BCBA Тим Робинсон, Тимоти Крайп, MD, PhD, Трейси Л. Сиск, RN, BSN, MHATracie Robo, MD MATravis Gallagher, ATTrevor MillerTyanna Snider, PsyDTyler Congrove, ATVanessa Shanks, MD, FAAP Венката Рама Джаянти, MDVidu Garg, MDVidya Raman, MDW.Гаррет Хант, доктор медицинских наук Уолтер Самора, доктор медицинских наук Уоррен Д. Ло, доктор медицины Венди Андерсон, доктор медицинских наук Венди Кливленд, Массачусетс, LPCC-SW, Уитни Маккормик, CTRS, Уитни Рэглин Биньял, доктор медицинских наук, Уильям Коттон, доктор медицинских наук, Уильям Дж. Барсон, доктор медицинских наук, Уильям Рэй, доктор медицинских наук, Уильям 902 35
Пенициллины, цефалоспорины, гликопептиды, макролидные антибиотики, аминогликозиды, противотуберкулезные агенты, противовирусные агенты, вакцины
Автор
Мухаммад Васим, MS, MBBS, FAAP, FACEP, FAHA Профессор экстренной медицины и клинической педиатрии, Медицинский колледж Вейля Корнелла; Лечащий врач отделения неотложной медицины и педиатрии, Линкольнский медицинский и психиатрический центр; Адъюнкт-профессор экстренной медицины, адъюнкт-профессор педиатрии, Медицинский факультет Университета Святого Георгия, Гренада
Мухаммад Васим, магистр медицины, MBBS, FAAP, FACEP, FAHA является членом следующих медицинских обществ: Американской академии педиатрии, Американской академии наук Медицина неотложной помощи, Американский колледж врачей неотложной помощи, Американская кардиологическая ассоциация, Американская медицинская ассоциация, Ассоциация специалистов в области клинических исследований, Общественная ответственность в медицине и исследованиях, Общество академической неотложной медицины, Общество моделирования в здравоохранении
Раскрытие: нечего раскрывать.
Соавтор (ы)
Мари-Мишлин Ломини, доктор медицины Лечащий врач, Медицинский центр Линкольна; Врач детской подростковой медицины, Бостонские врачи по детскому здоровью
Мари-Мишлин Ломини, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Гаитянской медицинской ассоциации за рубежом, Общества Красного Креста Гаити
Раскрытие информации: раскрывать нечего.
Главный редактор
Рассел Стил, доктор медицины Профессор-клиницист, медицинский факультет Тулейнского университета; Врач, штатный врач, Ochsner Clinic Foundation
Рассел Стил, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации иммунологов, Американского педиатрического общества, Американского общества микробиологии, Американского общества инфекционных болезней, Медицинского центра штата Луизиана. Общество, Общество детских инфекционных болезней, Общество педиатрических исследований, Южная медицинская ассоциация
Раскрытие информации: нечего раскрывать.
Дополнительные участники
Джозеф Домачовске, доктор медицины Профессор педиатрии, микробиологии и иммунологии, кафедра педиатрии, отделение инфекционных заболеваний, Медицинский университет штата Нью-Йорк, штат Нью-Йорк
Джозеф Домачовске, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha , Американская академия педиатрии, Американское общество микробиологии, Общество инфекционных болезней Америки, Общество педиатрических инфекционных заболеваний, Phi Beta Kappa
Раскрытие: Получен грант на исследования от: Pfizer; GlaxoSmithKline; AstraZeneca; Merck; Американской академии педиатрии, Novavax, Regeneron , Diassess, Actelion
Полученный доход в размере 250 долларов США или более от: Sanofi Pasteur.
Николас Джон Беннетт, MBBCh, PhD, FAAP, MA (Cantab) Доцент педиатрии, содиректор отдела управления противомикробными препаратами, медицинский директор, Отделение детских инфекционных заболеваний и иммунологии Детского медицинского центра Коннектикута
Николас Джон Беннетт, MBBCh, PhD, FAAP, MA (Cantab) является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия педиатрии
Раскрытие информации: получил исследовательский грант от: Cubist
Полученный доход в размере не менее чем 250 долларов от: Horizon Pharmaceuticals, Shire
Юридические консультации по вопросам Medico: Разн.
Благодарности
Лесли Л. Бартон, доктор медицины Почетный профессор педиатрии, Медицинский колледж Университета Аризоны
Лесли Л. Бартон, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Ассоциации директоров детских программ, Американского общества инфекционных болезней и Общества педиатрических инфекционных болезней
Раскрытие: Ничего не нужно раскрывать.
Хайди Коннолли, доктор медицины Адъюнкт-профессор педиатрии и психиатрии, Школа медицины и стоматологии Рочестерского университета; Директор службы педиатрической медицины сна, Центр сильных расстройств сна
Раскрытие: Ничего не раскрывать.
Брент Р. Кинг , доктор медицины, МММ Клайв Нэнси и Пирс Раннеллс Заслуженный профессор экстренной медицины; Профессор педиатрии Центра медицинских наук Техасского университета в Хьюстоне; Заведующий отделением неотложной медицины, начальник отделения неотложной помощи больницы Мемориал Германн и больницы LBJ
Раскрытие: Ничего не раскрывать.
Джефф Л. Майерс, доктор медицинских наук Заведующий отделением детской и врожденной кардиохирургии, хирургическое отделение, Массачусетская больница общего профиля; Доцент хирургии Гарвардской медицинской школы
Раскрытие: Ничего не раскрывать.
Марк И. Нойман, доктор медицины, магистр здравоохранения Доцент педиатрии Гарвардской медицинской школы; Лечащий врач отделения неотложной медицинской помощи, Детская больница Бостон
Mark I Neuman, MD, MPH является членом следующих медицинских обществ: Society for Pediatric Research
Раскрытие: Ничего не раскрывать.
Хосе Рафаэль Ромеро, доктор медицины Директор программы стипендий по педиатрическим инфекционным заболеваниям, доцент кафедры педиатрии, Объединенное отделение детских инфекционных болезней, Университет Крейтон / Медицинский центр Университета Небраски
Хосе Рафаэль Ромеро, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американского общества микробиологов, Американского общества инфекционных болезней, Нью-Йоркской академии наук и Общества педиатрических инфекционных болезней
Раскрытие: Ничего не раскрывать.
Маника Сурядевара, доктор медицины Научный сотрудник педиатрических инфекционных болезней, педиатрический факультет, Медицинский университет штата Нью-Йорк, штат Нью-Йорк,
Раскрытие: Ничего не раскрывать.
Изабель Вирелла-Лоуэлл, MD Отделение педиатрии, отделение легочных заболеваний, детской пульмонологии, аллергии и иммунологии
Раскрытие: Ничего не раскрывать.
Гарри Уилкс, MBBS, FACEM Директор отделения неотложной медицины, Больница Голгофы, Канберра, АКТ; Адъюнкт-профессор, Университет Эдит Коуэн, Западная Австралия,
Раскрытие: Ничего не раскрывать.
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие: Ничего не раскрывать.
Грейс М. Янг, доктор медицины Доцент кафедры педиатрии, Медицинский центр Университета Мэриленда
Раскрытие: Ничего не раскрывать.
Антибиотиков для лечения респираторных заболеваний у детей
Когда они нужны детям, а когда нет
Если у вашего ребенка болит горло, кашель или насморк, вы можете ожидать, что врач пропишет ему антибиотики.Но в большинстве случаев детям не нужны антибиотики для лечения респираторного заболевания. На самом деле антибиотики могут принести больше вреда, чем пользы. Вот почему:
Антибиотики борются с бактериями, а не с вирусами.
Если у вашего ребенка бактериальная инфекция, могут помочь антибиотики. Но если у вашего ребенка вирус, антибиотики не помогут вашему ребенку почувствовать себя лучше и не убережут других от болезни.
- Простуда и грипп — оба вируса.
- Простуда в груди также обычно вызывается вирусами.
- Бронхиолит — это особый тип простуды, который часто вызывает хрипы и может вызвать тяжелое заболевание у младенцев. Это также вызвано вирусом.
- Большинство инфекций носовых пазух (синусит) вызываются вирусами. Симптомы — большое количество слизи в носу и носовые выделения.
- Окрашенная слизь не обязательно означает, что у вашего ребенка бактериальная инфекция.
Антибиотики не помогают лечить вирусы и некоторые инфекции.
Грипп всегда вызывается вирусом.В этих случаях могут потребоваться антибиотики. Существуют специальные лекарства, которые в некоторых случаях можно использовать для борьбы с вирусом гриппа. Иногда младенцы и дети заражаются не только гриппом, но и бактериальными инфекциями. Когда у ребенка Грипп и бактериальная инфекция, могут потребоваться антибиотики.
Иногда бактерии могут вызывать инфекции носовых пазух, но даже в этом случае инфекция проходит сама по себе примерно через неделю. Многие распространенные ушные инфекции проходят сами по себе без антибиотиков.
Большинство болей в горле вызываются вирусами.Но некоторые виды ангины, например, ангины, являются бактериальными инфекциями. Симптомы включают жар, покраснение и проблемы с глотанием. Ваш врач решит, нужен ли вашему ребенку тест на стрептококк. Если анализ покажет, что это стрептококк, врач назначит антибиотики.
Когда вашему ребенку нужны антибиотики?
В этих случаях у вашего ребенка МОЖЕТ быть бактериальная инфекция, и если это произойдет, вам следует проконсультироваться с врачом:
- Кашель не проходит через 14 дней.
- Симптомы инфекции носовых пазух не проходят в течение 10 дней или проходят, а затем снова ухудшаются.
- У вашего ребенка выделения из носа и температура не ниже 102 ° F в течение нескольких дней подряд или выделения из носа и головная боль, которая не проходит.
Вашему ребенку будут нужны антибиотики в следующих случаях:
- Если у ребенка бактериальная форма пневмонии.
- Диагноз коклюш.
- У вашего ребенка ангина, по результатам экспресс-теста или посева из горла.
ПОМНИТЕ: Для младенцев младше 3 месяцев звоните своему педиатру при любой температуре выше 100,4 ° F. Очень маленькие дети могут иметь серьезные инфекции, которые могут нуждаться в антибиотиках и даже могут быть помещены в больницу.
Антибиотики опасны.
Побочные эффекты антибиотиков — частая причина того, что дети обращаются в отделение неотложной помощи. Лекарства могут вызывать диарею или рвоту, и примерно у 5 из 100 детей на них есть аллергия. Некоторые из этих аллергических реакций могут быть серьезными и опасными для жизни.
Неправильное и чрезмерное употребление антибиотиков способствует изменению бактерий, поэтому лекарства не помогают избавиться от них. Это называется «устойчивость к антибиотикам». Когда бактерии устойчивы к лекарствам, используемым для их лечения, инфекции легче передаются от человека к человеку. Устойчивые к антибиотикам инфекции также дороже лечить и труднее лечить.
При неправильном применении антибиотики тратят деньги.
Большинство антибиотиков недорого стоят.Но деньги, потраченные на лекарства, в которых нет необходимости, — деньги потрачены зря. В тяжелых случаях лечение инфекций, устойчивых к антибиотикам, может стоить тысячи долларов.
Этот отчет предназначен для вас, когда вы разговариваете со своим врачом. Это не заменяет медицинские консультации и лечение. Вы используете этот отчет на свой страх и риск. © 2018 ABIM Foundation. Разработан в сотрудничестве с Американской академией педиатрии.
02/2013
Не слишком мало, не слишком много: проблемы выбора пероральной дозы антибиотиков для детей
- Дж. А. Белицки, научный сотрудник по клиническим исследованиям12,
- СНГ Баркер, научный сотрудник по клиническим исследованиям 13,
- С. Саксена, клинический читатель в первичном звене 4,
- ICK Wong, профессор фармацевтической практики 56,
- PF Long, читатель по фармакогнозии7,
- M Sharland, профессор детских инфекционных болезней 1
- 1 Группа исследования детских инфекционных заболеваний, Институт инфекций и иммунитета, St George’s, Лондонский университет, Лондон, Великобритания
- 2 Детская фармакология, Детская больница Базельского университета, Базель, Швейцария
- 3 Институт здоровья детей, Университетский колледж Лондона, Лондон, Великобритания
- 4 Школа общественного здравоохранения, Имперский колледж Лондона, Лондон, Великобритания
- 90 004 5 Центр практики и исследований безопасных лекарств, Департамент фармакологии и фармации, Медицинский факультет Ли Ка Шинга, Гонконгский университет, Китай
- 6 Центр исследований детской фармации, Школа фармацевтики UCL, Университетский колледж Лондон, Лондон, Великобритания
- 7 Институт фармацевтических наук, Королевский колледж Лондона, Лондон, Великобритания
- Для корреспонденции: J Bielicki jbielick {at} sgul.ac.uk
JA Bielicki и его коллеги сравнивают общие стратегии выбора дозы антибиотиков для детей и обсуждают, как лучше всего сбалансировать удобство использования и точность
В глобальном масштабе антибиотики являются наиболее распространенными лекарствами, используемыми для лечения остро больных детей.1 2 Антибиотик дозы должны быть выбраны для достижения оптимального уничтожения бактерий с минимальными нежелательными эффектами, такими как лекарственная токсичность или отбор устойчивых патогенов. Учитывая проблемы, связанные с повышением устойчивости к антибиотикам, оптимальное использование антибиотиков для детей имеет важное значение для глобального управления антимикробными препаратами.3
Проблемы достижения оптимальной дозировки у детей
Дозирование лекарств у детей сложнее, чем у взрослых. По мере развития органов и иммунной системы в детстве, то, как лекарства всасываются, транспортируются и выводятся организмом (фармакокинетика), изменяется, что, в свою очередь, влияет на действие лекарства на организм (фармакодинамика) .4 В течение первых двух лет. жизни, эволюция функции почек и метаболизма печени имеет важное влияние на оптимальную дозу антибиотика.Неточное дозирование может привести к проблемам, поскольку более высокие дозы антибиотиков усиливают нежелательные побочные эффекты, особенно диарею, и могут способствовать отбору устойчивых бактерий5.
Поиск подходящих лекарственных форм для детей также является более сложной задачей, чем для взрослых. Дозы антибиотиков необходимо титровать для достижения оптимальной эффективности и адаптации к изменениям созревания.6 Для достижения правильной дозы может потребоваться, например, дробление или измельчение таблеток.7 Хотя жидкие препараты антибиотиков являются наиболее гибкими для дозирования, измерение небольших объемов может быть неточным. .8 В целом, шприцы оказались более точными, чем дозирующие чашки или ложки, 9 и использование изображений для демонстрации правильного дозирования может еще больше повысить точность.10 Тем не менее, в одном исследовании в США более двух третей предотвратимых побочных эффектов лекарственных препаратов вне больницы были вызваны ошибками родителей в применении лекарств, что указывает на трудности с предоставлением простых и понятных инструкций. …
Аллергия на антибиотики у детей: больше, чем просто этикетка — FullText — International Archives of Allergy and Immunology 2019, Vol.180, № 2
Абстрактные
В рамках широкой категории побочных реакций на лекарства у детей в последнее время особое внимание уделяется оценке детей с аллергией на антибиотики, в частности с аллергией на бета-лактам. Все чаще признаются потенциальные последствия маркировки бета-лактамной аллергии. Надлежащая оценка детей с подозрением на реакцию на антибиотики имеет важное значение, поскольку все чаще признается, что ярлык «аллергия на пенициллин» связан с неблагоприятными последствиями для здоровья и экономики.В этом обзоре будут рассмотрены 3 основных класса антибиотиков, вызывающих аллергические реакции у детей: бета-лактамы (производные пенициллина и цефалоспорины), макролиды и сульфаниламиды. Эта статья представляет собой повествовательный обзор распространенности, диагностики и лечения различных типов аллергии на антибиотики у детей. Наш обзор показывает, что аллергия на антибиотики часто преувеличивается и не диагностируется надлежащим образом в педиатрических возрастных группах. В последнее время произошел сдвиг в диагностической парадигме от использования кожных тестов и, если отрицательные, проблемы, к использованию провокации только в педиатрической возрастной группе.Необходимы более масштабные исследования для установления полезности и безопасности этого нового подхода, а также обновленные руководства.
© 2019 S. Karger AG, Базель
Предпосылки
Побочные реакции на лекарства (НЛР) часто встречаются у детей, с большей частотой у стационарных пациентов по сравнению с амбулаторным населением. Систематический обзор нежелательных реакций у педиатрических пациентов (17 проспективных исследований) показал, что общая частота нежелательных реакций в стационарных условиях составила 9.53% (95% ДИ 6,81–12,26%) по сравнению с 1,46% (95% ДИ 0,7–3,3%) в амбулаторных условиях [1]. На тяжелые реакции приходилось 12,29% (95% ДИ 8,43–16,17%) этих реакций; частота госпитализаций в связи с нежелательными реакциями составила 2,09% (95% ДИ 1,02–3,77%). Международная проспективная обсервационная когорта ( n = 1278) госпитализированных детей в стационары отметила частоту нежелательных реакций на уровне 16,5% (95% ДИ 14,5–18,7%), причем частота их резко различается в зависимости от страны [2]. Было отмечено, что побочные эффекты у детей представляют собой «серьезную проблему общественного здравоохранения», поскольку в национальных базах данных регистрируется меньшая частота случаев, чем в исследованиях госпитализированных детей и амбулаторных больных, и содержится призыв улучшить представление отчетов в национальные системы отчетности [3].
В рамках широкой категории нежелательных реакций у детей в последнее время особое внимание уделяется оценке детей с аллергией на антибиотики, в частности с аллергией на бета-лактам, поскольку амоксициллин является наиболее распространенным лекарством, назначаемым детям [4] и распространенный виновник ADR. Было отмечено, что до 6% детей имеют аллергию на бета-лактам [5]. В метаанализе сообщалось, что распространенность немедленных реакций на производные пенициллина у пациентов, сообщающих о гиперчувствительности к β-лактамам, составляла 1.98% (95% ДИ 1,35–2,60) в педиатрической группе, 7,78% (95% ДИ 6,53–9,04) во взрослой группе и 2,84% (95% ДИ 1,77–3,91) в комбинированной группе, как было протестировано в различных исследования с использованием кожных проб и оральных проб [6]. Аллергии на другие антибиотики, о которых сообщают сами пациенты, встречаются реже и составляют в основном антибиотики семейства макролидов [7] и сульфаниламиды (например, триметоприм-сульфаметоксазол) [8].
Для ADR описаны различные факторы риска. Изучение подозреваемых реакций на лекарственные препараты у 97 детей показало, что семейный анамнез лекарственной аллергии в значительной степени связан с подтвержденными аллергическими реакциями на лекарства [9].Недавно было обнаружено, что генотипы HLA-B, HLA-C и HLA-DRB1 сильно связаны с немедленными и отсроченными реакциями на бета-лактам у детей [10]. В отличие от других аллергических состояний возраст, пол и атопия не являются значимыми факторами риска развития побочных реакций [11]. К другим факторам риска относятся иммуносупрессия, муковисцидоз, предыдущее воздействие соответствующего лекарства, пролонгированная доза и продолжительность лечения, способ введения (парентеральный и кожный пути более сенсибилизирующий) и сопутствующая вирусная инфекция (до 100% детей и подростков с Вирус Эпштейна-Барра с сыпью при приеме амоксициллина) [12].Учитывая социальное бремя и проблемы, связанные с диагностикой и лечением, в этом обзоре будут рассмотрены 3 основных класса антибиотиков, которые, как сообщается, вызывают аллергические реакции у детей: бета-лактамы (производные пенициллина и цефалоспорины), макролиды и сульфаниламиды.
Классификация
Всемирная организация здравоохранения определяет ADR как «все предполагаемые фармакологические эффекты лекарственного средства, за исключением терапевтических неудач, преднамеренной передозировки, злоупотребления лекарством или ошибок при введении» [13].Нежелательные реакции делятся на предсказуемые и непредсказуемые реакции [14]. Прогнозируемые реакции (передозировка, побочные эффекты, лекарственные взаимодействия) определяются как возникающие у здоровых детей, связанные с известным фармакологическим действием лекарства и обычно дозозависимые по своей природе [14]. Напротив, у восприимчивых детей возникают непредсказуемые реакции, которые не связаны с фармакологическим действием лекарства и не зависят от дозы [14]. Непредсказуемые реакции можно подразделить на непереносимость лекарств, идиосинкразию лекарств, лекарственную аллергию и псевдоаллергические реакции.
Лекарственная аллергия составляет около 5–10% всех нежелательных реакций [15]. В настоящее время нет международного консенсуса по классификации лекарственных аллергических реакций [16]. Распространенным определением является разделение реакций на немедленные (реакция в течение часа после введения лекарства) или немедленных (реакция более чем через час после введения лекарства; часто через несколько дней или недель) [17, 18], хотя существуют и другие системы классификации. Эти реакции также можно классифицировать на основе традиционной системы классификации Гелла и Кумбса на тип I (опосредованный иммуноглобулином [IgE]), тип II (цитотоксический), тип III (иммунный комплекс) и тип IV (гиперчувствительность замедленного типа) [14, 19].
Патогенетические механизмы аллергии на антибиотики
Немедленные реакции возникают в течение часа после введения лекарства и считаются IgE-опосредованными (тип Гелла и Кумбса I) [14, 19, 20]. Клинические проявления включают любую комбинацию кожных симптомов (эритема, крапивница, ангионевротический отек), респираторных симптомов (одышка, кашель, хрип), желудочно-кишечных симптомов (сильная боль в животе, обильная рвота или диарея) или сердечно-сосудистых симптомов (гипотония или окончание болезни). дисфункция органов, такая как гипотония, обморок, недержание мочи) [19, 21, 22].Наиболее частая клиническая картина — изолированные кожные симптомы.
Анафилаксия является потенциально смертельной реакцией, опосредованной IgE, и определяется, когда аллергическая реакция затрагивает как минимум 2 системы органов или если гипотензия развивается после воздействия известного аллергена [23]. Анафилаксия может носить двухфазный характер в 20% случаев (вторая реакция от нескольких часов до 72 часов после исчезновения клинических симптомов) [24].
Как правило, немедленные реакции требуют сенсибилизирующей дозы до появления клинической реактивности, поэтому реакции наблюдаются только при втором (или последующем) курсе лечения, если не пропущены дозы при первом курсе [25].Модифицированная классификация предполагает, что IgE-опосредованные реакции могут возникать в течение 6 часов после приема препарата (немедленно) и до 4 дней после последнего воздействия [26]. Однако совсем недавно сообщалось, что некоторые из реакций, определяемых как немедленные, на самом деле опосредованы прямой активацией тучных клеток из-за определенных антибиотиков (противогрибковые агенты, аминогликозиды и сульфонамиды), которые имеют большие количества третичных аминов и вторичных аминогрупп с легкостью протонированные атомы азота. Эти антибиотики вызывают дегрануляцию тучных клеток за счет связывания с человеческим рецептором, связанным с G-белком (MrgprX2).Эти реакции часто называют псевдоаллергическими реакциями [27, 28].
Непосредственные реакции (тип IV по Геллу и Кумбсу) возникают более чем через час после приема лекарства, хотя обычно происходят через несколько дней или даже недель [14, 19]. Патофизиология не немедленных реакций полностью не определена, но считается, что они вызваны замедленным механизмом, зависимым от Т-клеток. Наиболее частыми клиническими проявлениями немедленной реакции являются изолированные кожные симптомы, такие как макулопапулезная экзантема или отсроченная крапивница / ангионевротический отек [14, 19].Изолированная макулопапулезная экзантема составляет около 90% всех кожных реакций на лекарства, и большинство этих экзантем имеют доброкачественный характер [29, 30]. Среди немедленных реакций существует подкатегория серьезных кожных побочных реакций (SCAR), которые включают фиксированную лекарственную сыпь, реакцию, подобную сывороточной болезни (SSLR), синдром Стивенса-Джонсона (SJS) и лекарственную реакцию с эозинофилией и системными симптомами (DRESS). .
Реакции Гелла и Кумбса типа II и III не входят в классификацию немедленных и немедленных реакций и включают цитотоксические реакции (тип II; лекарственная анемия или тромбоцитопения) и иммунные комплексные реакции (тип III; сывороточная болезнь, васкулит) [14, 19].
В целом считается, что иммунный ответ на лекарство требует, чтобы лекарство (если молекулярная масса <1000 Дальтон) ковалентно связывалось с белком гаптена, чтобы стимулировать иммунный ответ. Совсем недавно была предложена концепция PI (фармакологическое взаимодействие с иммунными рецепторами), которая постулирует, что даже в отсутствие гаптена некоторые лекарства могут напрямую связываться через нековалентные связи с Т-клеточными рецепторами или с определенными молекулами HLA и напрямую стимулировать иммунный ответ. [31].Также предполагается, что для того, чтобы вызвать иммунный ответ, недостаточно наличия низкомолекулярного лекарственного средства, способного взаимодействовать с HLA или HLA-представленным пептидом, и что перекрестное распознавание другого эпитопа (например, от патогена) является недостаточным. требуется для активации эффекторных Т-клеток, чтобы вызвать наблюдаемые клинические симптомы (гетерологичный иммунитет) [20]. Действительно, были получены доказательства связи между SJS, вызванным котримоксазолом / токсическим эпидермальным некролизом (TEN), и аллелями HLA, включая HLA-B * 15:02, HLA-C * 06:02 и HLA-C * 08:01 [32 ] и для амоксициллина ассоциации клавулановой кислоты были зарегистрированы с DRB1 * 15: 01-DRB5 * 01: 01 — DQB1 * 06: 02 e [33, 34] и HLA-A * 02: 01 [35].
Диагноз
История и клиническая картина
Установление диагноза аллергии на антибиотики требует подтверждения истории болезни и подтверждающих тестов. Самым важным компонентом в диагностике лекарственной аллергии у детей является анамнез. Важно установить временные рамки реакции, включая время ее проявления в зависимости от приема лекарств и продолжительности симптомов. Поскольку большинство реакций носят кожный характер, важно учитывать морфологию кожных поражений (например,g., пятнисто-папулезный (рис. 1a), крапивница (рис. 1b) или с признаками образования пузырей и отслоения кожи), а также узнать о связанных системных симптомах. Вопросы также должны включать, какие лекарства использовались в то время (включая обезболивающие, такие как нестероидные противовоспалительные средства, которые также могут вызывать аллергические реакции), и использовались ли эти лекарства раньше (поскольку большинство аллергических реакций требует периода предварительной сенсибилизации). Существует утвержденная шкала вероятности нежелательной лекарственной реакции Наранхо, которая оценивает вероятность «истинной» лекарственной аллергии, хотя она обычно не используется в клинической практике и не была проверена специально в педиатрической популяции [36].
Рис. 1.
Макулопапулезная экзантема у 8-летней девочки с положительным немедленным пероральным введением амоксициллина. b Крапивница у 6-месячного младенца с положительным немедленным провокацией амоксициллина.
Стоит отметить, что, хотя история имеет первостепенное значение, исследования показывают, что пациенты и семьи, сообщающие истории, имеют низкую точность в диагностике лекарственной аллергии [37]. В то время как в некоторых случаях характер высыпания весьма наводит на мысль о патогенезе, часто бывает сложно, особенно в педиатрии, отличить вирусную сыпь от реакции, вызванной лекарством.Макулопапулезные высыпания часто вызываются вирусами и клинически неотличимы от реакций гиперчувствительности замедленного типа. Кроме того, вирусная инфекция считается наиболее частой причиной острой крапивницы у детей [38]. Определить виновника сыпи особенно сложно, когда сыпь сочетается (часто геморрагическая) с симптомами суставов. SSLR (реакция, подобная сывороточной болезни) определяется, когда через 7–21 день после воздействия лекарства развиваются большие эритематозные уртикарные бляшки с темными или экхимотическими очагами, часто связанные с отеком рук и ног (рис.2а). Помимо характерных кожных проявлений, пациенты с SSLR могут иметь лихорадку, недомогание, лимфаденопатию, боль в животе, тошноту, рвоту, диарею, миалгии, головные боли и самоограниченный симметричный артрит [39]. Прогноз SSLR отличный, симптомы обычно исчезают в течение нескольких недель после прекращения приема лекарственного средства [40]. Напротив, вирусные инфекции редко могут быть связаны с подобной сыпью, называемой «мультиформная крапивница», которая напоминает острую крапивницу (рис.2б). Однако в случае мультиформной крапивницы по сравнению с SSLR сыпь появляется быстрее (через 1–3 дня после острого вирусного заболевания). Подобно SSLR, это самоограничивающееся состояние с благоприятным долгосрочным прогнозом [41].
Рис. 2.
a Сывороточная болезнь, подобная реакции у годовалого младенца. Более мягкую реакцию вызвал вызов. b Многоформная крапивница — заражение отрицательным амоксициллином и допустимость последующего использования. c Фиксированная лекарственная сыпь (вызванная цефтриаксоном и вызванная провокацией).
Напротив, тяжелые кожные побочные эффекты характеризуются отчетливой клинической картиной. Эти реакции редки (1–5 на 1 000 000), но могут быть опасными для жизни. К ним относятся лекарственная сыпь с эозинофилией и системными симптомами (DRESS), синдром Стивенса-Джонсона (SJS), токсический эпидермальный некролиз (TEN) и острый генерализованный экзантематозный пустулез (AGEP). Сообщалось, что антибиотики, в основном бета-лактамы, являются основной причиной этих тяжелых реакций у детей [42].
SJS / TEN является наиболее тяжелым из всех SCAR и характеризуется продромом лихорадки и недомогания, быстро сменяющимся центробежной болезненной и темной экзантемой.Характерные особенности сыпи включают боль, отслоение кожи и поражение слизистых оболочек. Могут быть видны таргетоидные папулы, но в отличие от многоформных мишеней доброкачественной эритемы, они двухцветные и плоские. Пораженная кожа без пузырей часто отслаивается при прямом латеральном надавливании (признак Никольского) [43]. Помимо кожи, могут быть задействованы и другие органы с эпителиальной выстилкой, а неэффективный кожный барьер может привести к сепсису и нарушениям жидкости и электролитов [19]. Считается, что SJS и TEN являются одним и тем же заболеванием по спектру тяжести, определяемому процентом отслоения кожи, относящимся к площади поверхности тела, включающей SJS (<10%), перекрытие SJS / TEN (10-30%) и TEN ( > 30%) [19].Лечение состоит из отмены препарата-виновника и поддерживающей терапии (уход за раной, наблюдение за инфекцией, состояние жидкости и питания, электролитный баланс, функция почек и дыхательных путей и адекватный контроль боли) [44]. SCORe of TEN (SCORTEN) — это клиническая система оценки, которая обычно используется для прогнозирования внутрибольничной смертности у взрослых и основана на процентном соотношении отслоения кожи и физиологических изменений, в то время как она помогает прогнозировать заболеваемость у детей, ее использование в педиатрии не подтверждено [45].
DRESS, который также называют синдромом лекарственной гиперчувствительности, обычно проявляется лихорадкой, сыпью и поражением внутренних органов [19]. Было высказано предположение, что вирусная реактивация герпесвирусов 6 и 7 играет роль в патогенезе заболевания за счет расширения репертуара Т-клеток, специфичных к лекарствам [46]. В отличие от других отсроченных высыпаний, которые начинаются через 1-2 недели после приема лекарств, DRESS обычно возникает позже (через 2-6 недель после) и имеет длительное течение [47]. Кожная сыпь у пациентов с DRESS имеет некоторые общие черты с доброкачественной сыпью замедленной гиперчувствительности.Клинические признаки, наиболее полезные для дифференциации этих двух состояний, включают отек лица, лихорадку, лимфаденопатию, недомогание и наличие системного поражения (например, более чем 2-кратное повышение сывороточной аланинтрансферазы, повышение креатинина и / или протеинурию) [19]. Атипичный лимфоцитоз сообщается у 27–67% пациентов, а эозинофилия — у 66–95%. Системные кортикостероиды являются основным методом лечения пациентов с DRESS [48].
AGEP — еще один пример реакции гиперчувствительности замедленного типа, в которой Т-клетки играют решающую роль [49].Т-клетки, специфичные к лекарствам, продуцируют большое количество нейтрофил-стимулирующего хемокина CXCL8 (Il-8), что объясняет инфекцию, имитирующую клинические особенности AGEP. Для него характерно внезапное появление многочисленных стерильных нефолликулярных пустул на фоне диффузно эритематозной кожи, сопровождающееся лихорадкой и лейкоцитозом [49]. Это часто начинается в областях изгиба и происходит в течение нескольких дней после контакта с виновником. Недавнее исследование показало, что среднее время задержки до извержения составляет 1 день для антибиотиков и 11 дней для других препаратов, вызывающих нарушение [19].Полное выздоровление обычно ожидается в течение 1-2 недель после отмены триггера. Может использоваться местный кортикостероид, что коррелирует с уменьшением средней продолжительности госпитализации [48].
Наконец, фиксированная лекарственная сыпь (рис. 2c) повторяется в той же области, когда назначается лекарство-виновник, в основном НПВП / антибиотики [19]. Кольцевые, от темных до фиолетовых, отечные бляшки развиваются в течение 30–8 часов после воздействия препарата и рассасываются в течение 1 недели, оставляя характерную макулярную гиперпигментацию [19].Слизистая оболочка (губы и гениталии), а также акральная кожа являются наиболее частыми локализацией [50]. В педиатрической популяции описаны фиксированные лекарственные высыпания в сочетании с различными классами антибиотиков, включая производные пенициллина [51], макролиды [52] и сульфаниламиды [53].
Подтверждающие тесты
Лабораторные тесты являются поддерживающими, но не подтверждающими при любой лекарственной аллергической реакции. Если в анамнезе имеется возможная IgE-опосредованная (немедленная) реакция, Национальный институт здравоохранения и медицинского обслуживания рекомендует получить уровень триптазы в сыворотке (маркер активации тучных клеток), поскольку повышенный уровень триптазы в сыворотке специфичен для анафилаксии, особенно если повторить триптазу, когда реакция пройдет нормально [54].Однако эта рекомендация основана на данных наблюдательных исследований низкого качества, и эта рекомендация не согласуется во всех руководствах, поскольку другие клетки (например, базофилы) могут играть роль в немедленных реакциях [55]. Для немедленных реакций, в частности, SCAR, вспомогательные лабораторные исследования могут включать ферменты печени, функцию почек и общий анализ крови [19].
Кожные пробы
Для немедленных реакций проверенные реагенты для кожных проб существуют только для пенициллина, а не для каких-либо других антибиотиков или любых других низкомолекулярных препаратов [19, 54].Если анамнез соответствует возможной немедленной реакции на пенициллин или амоксициллин, в нескольких руководствах рекомендуется кожная проба (эпикутанная, а затем внутрикожная) в качестве исследования первой линии с последующим провокационным тестом на лекарственные препараты (DPT) в случае отрицательного результата [19, 26]. Рекомендуется проводить кожные пробы с использованием основных (пенициллоилполилизин) и второстепенных (пенициллин G, пенициллоат и / или пениллоат) детерминант, а также ампициллина, хотя не все второстепенные детерминанты обычно доступны для тестирования [19].
Кожные пробы безопасны, но отмечены как «неприятные» и трудные для проведения у детей младшего возраста [26, 56, 57]. Кожные пробы имеют высокую отрицательную прогностическую ценность до 98% при диагностике аллергии на пенициллин, хотя большинство этих исследований проводится на взрослой популяции и относятся к пенициллину, но не к амоксициллину [58, 59]. Кроме того, многочисленные исследования показали, что положительная прогностическая ценность кожных проб у детей низкая и составляет около 20% [60]. Кроме того, сообщается, что в 80% случаев кожные пробы могут быть ложноположительными и что чувствительность ниже 10% [60, 61].
Тест на провокацию лекарств
Было проведено несколько недавних исследований, оценивающих роль АКДС в отсутствие предшествующих кожных тестов у детей с историей немедленных реакций на пенициллины, и было обнаружено, что это безопасно и эффективно. В исследовании 818 детей, проведенном Mill et al. [61] с подозрением на аллергию на амоксициллин, которые были оценены с помощью АКДС в отсутствие превентивных кожных тестов, только 2,1% детей имели немедленную реакцию, причем все они были легкими кожными реакциями саморассасывания.Исследование 155 детей школьного возраста с подозрением на аллергию на пенициллин показало, что АКДС столь же безопасна, и только у 2,6% детей наблюдались немедленные реакции, все из которых были легкими кожными реакциями саморассасывания [62]. В результате в некоторых кругах аллергологов появилась тенденция рассматривать АКДС при отсутствии превентивных кожных тестов при оценке аллергии на пенициллин и амоксициллин, особенно если реакция была легкой немедленной реакцией (т. Е. Ограничивалась кожей) [ 63, 64].
Были опубликованы нераздражающие концентрации цефалоспоринов, а также некоторых других распространенных антибиотиков, хотя этот тест не стандартизирован, и отрицательный кожный тест не исключает аллергию, поскольку прогностическая ценность этого теста неизвестна [19].Для некоторых распространенных антибиотиков, таких как пенициллин и амоксициллин, доступны анализы сывороточного IgE in vitro, но их чувствительность и специфичность недостаточно хорошо описаны (хотя в целом считается, что специфичность выше, чем чувствительность) [14, 19]. В целом считается, что сывороточно-специфические IgE-тесты in vitro мало полезны, хотя некоторые руководящие принципы рекомендуют включать их в оценку аллергии на пенициллин, если кожные пробы отрицательны, несмотря на убедительный анамнез немедленной клинической реактивности [65].Кроме того, в случае пероральных цефалоспоринов (например, цефпрозила), которые чаще всего используются у детей, кожные пробы ограничиваются прик-тестами и, следовательно, вряд ли будут полезны.
Для антибиотиков, отличных от бета-лактамных антибиотиков, валидированные кожные пробы недоступны, а в контексте немедленной реакции единственным доступным тестом является провокация на лекарство. В общем, рекомендуется проводить градуированное заражение в контексте низкой вероятности лекарственной аллергии (например, если немедленная реакция была отдаленной или изолированной кожной реакцией) [15].Есть только два исследования, в которых оценивается использование кожных проб для диагностики аллергии на макролиды у детей. В первом исследовании кожная проба (SPT и ID) с внутривенным введением кларитромицина имела чувствительность 75% и специфичность 90% с положительной прогностической ценностью 33% [66]. Второе исследование показало чувствительность 0% и PPV 0% [67].
Для легких не немедленных реакций на пенициллин или амоксициллин руководство менее определено в отношении роли кожных тестов перед DPT и фактически Британского общества аллергии и клинической иммунологии, а также недавнего отчета Американской академии аллергии, астмы и иммунологии и Всемирная организация по аллергии рекомендовала рассматривать применение АКДС без превентивного кожного тестирования у детей с умеренными немедленными реакциями на амоксициллин или пенициллин [26, 68].Кожные пробы имеют очень низкую чувствительность (хотя и высокую специфичность) в диагностике немедленных реакций на пенициллины. Ретроспективный обзор 352 детей с немедленными реакциями на амоксициллин в анамнезе показал, что чувствительность и специфичность кожных проб составляет 8 и 99,7% (соответственно) [69]. Кроме того, было показано, что АКДС безопасна и эффективна при диагностике немедленных реакций на пенициллины. В исследовании Mill et al. [61], DPT имел отрицательную прогностическую ценность 89.1 в диагностике немедленных реакций на пенициллины и был безопасным (3,8% немедленных легких кожных самоограниченных реакций).
При тяжелых побочных кожных реакциях кожные пробы и АКДС противопоказаны, за исключением, возможно, SSLR, где новые исследования показали, что АКДС безопасна для детей. Однако для подтверждения безопасности этого подхода необходимы дальнейшие исследования [61, 70].
Другие исследования
В отношении некоторых легких не немедленных реакций, таких как фиксированная лекарственная сыпь, AGEP и пятно на коже макулопапулезной экзантемы, тестирование на кожные пятна показало некоторую клиническую полезность в диагностике [71].В Северной Америке патч-тестирование противопоказано в контексте тяжелой кожной побочной реакции, хотя в Европе патч-тестирование использовалось для более тяжелых немедленных реакций [72–74].
Тест активации базофилов (проверка базофильной стимуляции лекарственным аллергеном и последующей экспрессии CD63 или CD203c) перспективен при диагностике немедленной лекарственной аллергии, но пока не является стандартом лечения [75, 76]. Тест на трансформацию лимфоцитов — еще один новый тест с некоторыми коммерческими методами, доступными в настоящее время, но на сегодняшний день существует мало литературы о его полезности [77].
Менеджмент
Общий
Менеджмент обычно требует отказа от любых лекарств, вызвавших аллергическую реакцию. При немедленных реакциях (особенно на бета-лактамные антибиотики), а также при легких не немедленных реакциях рекомендуется направление к специалисту по аллергии, чтобы исключить (или исключить) лекарственную аллергию. Браслет MedicAlert рекомендуется всем детям с подтвержденной лекарственной аллергией.
В случае подтвержденной IgE-опосредованной аллергии рекомендуется избегать, а при необходимости использования в будущем можно рассмотреть возможность десенсибилизации.Индукция десенсибилизации — это процесс, который позволяет ребенку временно использовать лекарство, на которое у него аллергия, безопасно, путем временного изменения иммунного ответа на лекарство, пока ребенок продолжает принимать лекарство [15]. Как правило, он показан только в ситуации, когда нет альтернативных лекарств, не обладающих перекрестной реакцией. Как правило, индукция лекарственной десенсибилизации показана только при немедленных (или умеренных немедленных) реакциях и противопоказана при тяжелых кожных побочных реакциях [19].Протоколы индукции десенсибилизации были опубликованы для нескольких антибиотиков (таблица 1) [19]. Процедура всегда включает в себя возрастающие дозы соответствующего лекарства с течением времени (от часов до дней) в условиях, подготовленных для лечения анафилаксии [19].
Таблица 1.
Стратегии лечения основной аллергии на антибиотики у детей
Перекрестно-реактивные препараты
Считается, что перекрестная реактивность между цефалоспоринами и пенициллинами очень низкая, а аллергия на цефалоспорины встречается гораздо реже, чем аллергия на пенициллин [78 ].Было рекомендовано безопасно применять цефалоспорины второго и третьего поколения у детей с аллергией на пенициллин в анамнезе при условии, что аллергическая реакция не опасна для жизни [79]. Альтернативным рассмотрением может быть кожная проба на цефалоспорины (пока не подтверждена) или дифференцированное введение цефалоспоринов у ребенка с аллергией на пенициллин в анамнезе [19]. У ребенка, у которого в анамнезе была реакция на цефалоспорин, перед его введением было бы рекомендовано либо тестирование, либо дозированная проба на пенициллин [19].Меньше известно о перекрестной реактивности небета-лактамных антибиотиков (таких как макролиды или аминогликозиды) [19].
Важность устранения аллергии на пенициллин у детей
Обследование детей с подозрением на реакцию на антибиотики пенициллина имеет важное значение, поскольку все чаще признается, что ярлык «аллергия на пенициллин» связан с неблагоприятными последствиями для здоровья и экономики. Особенно остро это проявляется в случае антибиотиков пенициллинового ряда, так как большинство детей, отнесенных к категории аллергиков, после обследования на аллергию оказываются толерантными [5, 80, 81], а антибиотики пенициллинового ряда являются одними из наиболее распространенных лекарств, назначаемых детям [82, 83].
Признак аллергии на пенициллин связан с назначением альтернативных антибиотиков более широкого спектра действия, которые имеют высокий риск побочных эффектов, а также повышают риск устойчивости к антибиотикам [84–86]. Использование антибиотиков широкого спектра действия связано с увеличением продолжительности госпитализации и более высокими затратами на здравоохранение [87–90]. В результате был реализован ряд национальных и международных инициатив с целью избавления детей от «аллергии на пенициллин», включая стационарные и амбулаторные программы [91, 92], программы под руководством отделений неотложной помощи [93] и программы под руководством аптек. [94, 95].
Прогноз
Прогноз для пенициллиновых антибиотиков лучше всего описан в контексте немедленных или умеренных немедленных реакций. Многочисленные исследования показали, что естественная история немедленных или умеренных не немедленных реакций на антибиотики пенициллинового ряда имеет высокую скорость разрешения с течением времени (до 80% через 10 лет), которая может быть даже выше для амоксициллина у детей, чем для других антибиотиков пенициллина ( до 100% в течение 5 лет) [14, 26, 96]. Меньше известно о естественном течении реакций на другие лекарства.Кроме того, естественная история тяжелых побочных кожных реакций не была хорошо описана.
Заключение
Наш обзор показывает, что аллергия на антибиотики часто завышается и не диагностируется надлежащим образом в педиатрических возрастных группах. В последнее время произошел сдвиг в диагностической парадигме от использования кожных тестов и, если отрицательные, проблемы, к использованию провокации только в педиатрической возрастной группе. Необходимы более масштабные исследования для установления полезности и безопасности этого нового подхода, а также обновленные руководства.Для людей с подтвержденной немедленной аллергией существуют эффективные протоколы десенсибилизации для основных классов антибиотиков, хотя основное лечение для людей с тяжелыми реакциями (например, Стивен Джонсон и TEN) по-прежнему строго избегается.
Пациенты дали согласие на публикацию своих фотографий.
Нет никаких финансовых интересов (акции, патенты, трудоустройство, гонорары или роялти) или нефинансовых отношений (политических, личных или профессиональных), которые могут быть истолкованы как повлиявшие на написание рукописи.
Заявление о раскрытии информации
Авторы не заявляют о конфликте интересов.
Список литературы
- Impicciatore P, Choonara I, Clarkson A, Provasi D, Pandolfini C, Bonati M. Частота побочных реакций на лекарства у педиатрических стационарных / амбулаторных пациентов: систематический обзор и метаанализ проспективных исследований.Br J Clin Pharmacol. Июль 2001 г., 52 (1): 77–83.
- Рашед А.Н., Вонг И.С., Крансуик Н., Хефеле Б., Томлин С., Джекман Дж и др. Побочные реакции на лекарства у детей — международный надзор и оценка (ADVISE): многоцентровое когортное исследование. Drug Saf. 2012 июн; 35 (6): 481–94.
- Aagaard L, Christensen A, Hansen EH.Информация о побочных реакциях на лекарства у детей: качественный обзор эмпирических исследований. Br J Clin Pharmacol. 2010 Октябрь; 70 (4): 481–91.
- Компакт-диск с рецептами антибиотиков для амбулаторных больных. https://www.cdc.gov/antibiotic-use/community/pdfs/Annual-Report-2016-H.pdf. По состоянию на 11 июня 2019 г.
- Ребело Гомес Э., Фонсека Дж., Араухо Л., Демоли П. Утверждения о лекарственной аллергии у детей: от самоотчета до подтвержденного диагноза. Clin Exp Allergy. 2008, январь; 38 (1): 191–8.
- Харандян Ф., Фам Д., Бен-Шошан М.Положительные результаты тестов на аллергию на пенициллин: систематический обзор и метаанализ статей, опубликованных с 2010 по 2015 годы. Postgrad Med. 2016 август; 128 (6): 557–62.
- Lange L, Koningsbruggen SV, Rietschel E. Анкетный опрос распространенности и характера аллергических реакций на лекарства у немецких детей.Pediatr Allergy Immunol. 2008 ноя; 19 (7): 634–8.
- Орхан Ф., Каракас Т., Чакир М., Акколь Н., Бахат Э., Сонмез Ф.М. и др. Лекарственная аллергия, о которой сообщают родители, у городских школьников 6-9 лет. Pediatr Allergy Immunol. 2008 Февраль; 19 (1): 82–5.
- Арикоглу Т., Аслан Г., Батмаз С.Б., Эскандари Г., Хелвачи И., Куюджу С.Диагностическая оценка и факторы риска лекарственной аллергии у детей: от истории болезни до кожных и провокационных тестов. Int J Clin Pharm. 2015 август; 37 (4): 583–91.
- Сингвиджарн П., Мануякорн В., Махасиримонгкол С., Ваттанапокаякит С., Инунчот В., Вичукчинда Н. и др. Связь генотипов HLA с гиперчувствительностью к бета-лактамным антибиотикам у детей.Азиатский Pac J Allergy Immunol. 2019 апрель, Epub опережает печать.
- Ponvert C, Le Clainche L, de Blic J, Le Bourgeois M, Scheinmann P, Paupe J. Аллергия на бета-лактамные антибиотики у детей. Педиатрия. 1999 Октябрь; 104 (4): e45.
- Томпсон Д.Ф., Рамос К.Л.Сыпь, вызванная антибиотиками, у пациентов с инфекционным мононуклеозом. Энн Фармакотер. 2017 Февраль; 51 (2): 154–62.
- Bates DW, Cullen DJ, Laird N, Petersen LA, Small SD, Servi D и др .; Исследовательская группа по профилактике ADE. Частота нежелательных явлений и потенциальных нежелательных явлений.Значение для профилактики. ДЖАМА. 1995 Июль; 274 (1): 29–34.
- Хан Д.А., Соленский Р. Лекарственная аллергия. J Allergy Clin Immunol. 2010 февраль; 125 (2 приложение 2): S126–37.
- Абрамс Э.М., Хан Д.А.Диагностика и лечение лекарственной аллергии. CMAJ. 2018 апр; 190 (17): E532–8.
- Абрамс Э.М., Аткинсон А.Р., Вонг Т., Бен-Шошан М. Важность устранения бета-лактамной аллергии у детей. J Pediatr. 2019 Янв; 204: 291–7.e1.
- Фернандес Т.Д., Майорга С., Ариза А., Корсо Ю.Л., Торрес М.Дж.Аллергические реакции на антибиотики у детей. Curr Opin Allergy Clin Immunol. 2014 август; 14 (4): 278–85.
- Романо А, Каубет Ж. Аллергия на антибиотики у детей и взрослых: от клинических симптомов до диагностики кожных проб. J Allergy Clin Immunol Pract. 2014, январь-февраль; 2 (1): 3–12.
- Совместная целевая группа по параметрам практики; Американская академия аллергии, астмы и иммунологии; Американский колледж аллергии, астмы и иммунологии; Объединенный совет аллергии, астмы и иммунологии. Лекарственная аллергия: обновленный параметр практики. Ann Allergy Asthma Immunol. 2010 Октябрь; 105 (4): 259–73.
- Павлос Р., Маллал С., Остров Д., Буус С., Метуши И., Петерс Б. и др. Т-клеточные реакции гиперчувствительности к лекарствам. Annu Rev Med. 2015; 66 (1): 439–54.
- Мэйси Э., Романо А., Хан Д.Практическое лечение гиперчувствительности к антибиотикам в 2017 году. J Allergy Clin Immunol Pract. 2017 Май — июн; 5 (3): 577–86.
- Саксон А., Билл Г. Н., Рор А. С., Адельман, округ Колумбия. Непосредственные реакции гиперчувствительности к бета-лактамным антибиотикам. Ann Intern Med. 1987 Авг; 107 (2): 204–15.
- Simons FE.Анафилаксия. J Allergy Clin Immunol. 2010 февраль; 125 (2 приложение 2): S161–81.
- Саймонс Ф. Е., Ардуссо Л. Р., Било М. Б., Димов В., Эбисава М., Эль-Гамаль Ю. М. и др .; Всемирная организация по аллергии. Обновление 2012: Рекомендации Всемирной организации по аллергии для оценки и лечения анафилаксии.Curr Opin Allergy Clin Immunol. 2012 август; 12 (4): 389–99.
- Шнайдер Б. Обращение к пациенту с лекарственной аллергией. Med Clin North Am. 2010 июл; 94 (4): 665–79, xv.
- Mirakian R, Leech SC, Krishna MT, Richter AG, Huber PA, Farooque S и др.; Комитет по стандартам лечения Британского общества аллергии и клинической иммунологии. Лечение аллергии на пенициллины и другие бета-лактамы. Clin Exp Allergy. 2015 фев; 45 (2): 300–27.
- Zhang T, Che D, Liu R, Han S, Wang N, Zhan Y и др. Типичные противомикробные препараты вызывают дегрануляцию тучных клеток и анафилактоидные реакции через MRGPRX2 и его мышиный гомолог MRGPRB2.Eur J Immunol. 2017, ноябрь; 47 (11): 1949–58.
- McNeil BD, Pundir P, Meeker S, Han L, Undem BJ, Kulka M и др. Идентификация рецептора, специфичного к тучным клеткам, критически важного для псевдоаллергических реакций на лекарства. Природа. 2015 Март; 519 (7542): 237–41.
- Hoetzenecker W, Nägeli M, Mehra ET, Jensen AN, Saulite I, Schmid-Grendelmeier P, et al.Нежелательные кожные высыпания, вызванные лекарствами: текущее понимание. Semin Immunopathol. 2016, январь; 38 (1): 75–86.
- Кормовой RS. Клиническая практика. Экзантематозные лекарственные высыпания. N Engl J Med. 2012 июнь; 366 (26): 2492–501.
- Пихлер WJ.Концепция p-i: фармакологическое взаимодействие лекарств с иммунными рецепторами. World Allergy Organ J. 2008 июн; 1 (6): 96–102.
- Kongpan T, Mahasirimongkol S, Konyoung P, Kanjanawart S, Chumworathayi P, Wichukchinda N, et al. Гены-кандидаты HLA для прогнозирования тяжелых кожных реакций, вызванных котримоксазолом.Pharmacogenet Genomics. 2015 августа; 25 (8): 402–11.
- Hautekeete ML, Horsmans Y, Van Waeyenberge C, Demanet C, Henrion J, Verbist L и др. HLA-ассоциация гепатита, вызванного амоксициллин-клавуланатом. Гастроэнтерология. 1999 ноя; 117 (5): 1181–6.
- Стивенс Р., Коутс Е., Стрит Дж., Кук Е., Дарк К.Комплексная оценка двух моноклональных антител HLA-B17 для скрининга HLA-B57 / B58 на основе проточной цитометрии до назначения абакавира. Int J Immunogenet. 2013 август; 40 (4): 311–5.
- Lucena MI, Molokhia M, Shen Y, Urban TJ, Aithal GP, Andrade RJ и др .; Испанский реестр DILI; ЕВДРАГЕН; ДИЛИН; ДИЛИГЕН; Международный SAEC.На предрасположенность к поражению печени, вызванному амоксициллин-клавуланатом, влияют множественные аллели HLA I и II классов. Гастроэнтерология. Июль 2011 г .; 141 (1): 338–47.
- Наранхо Калифорния, Бусто Ю., Селлерс Е.М., Сандор П., Руис И., Робертс Е.А. и др. Метод оценки вероятности побочных реакций на лекарства.Clin Pharmacol Ther. 1981, август; 30 (2): 239–45.
- Вайлс Д., Чиу А., Симпсон П., Ниммер М., Адамс Дж., Брюссо, округ Колумбия. Родители сообщили о симптомах аллергии на пенициллин в педиатрическом отделении неотложной помощи. Acad Pediatr. 2017 Апрель; 17 (3): 251–5.
- Имбальзано Э., Кашаро М., Квартуччо С., Минчиулло П.Л., Кашио А., Калапаи Дж. И др.Связь между крапивницей и вирусными инфекциями: систематический обзор. Allergy Asthma Proc. 2016, январь-февраль; 37 (1): 18–22.
- Матур А.Н., Матес Э.Ф. Имитаторы крапивницы у детей. Дерматол Тер (Heidelb). 2013 ноябрь-декабрь; 26 (6): 467–75.
- Чионг Ф.Дж., Лёвенталь М., Бойл М., Аттиа Дж.Реакция сывороточной болезни после вакцинации против гриппа. BMJ Case Rep. Декабрь 2015 г .; 2015 г .: bcr2015211917.
- Старнес Л., Патель Т., Скиннер РБ. Многоформная крапивница — описание случая. Pediatr Dermatol. 2011 июль-август; 28 (4): 436–8.
- Дибек Мисирлиоглу Э., Гувенир Х., Бахчечи С., Хактанир Абул М., Джан Д., Уста Гуч Б.Э. и др.Тяжелые кожные побочные реакции на лекарства у педиатрических пациентов: многоцентровое исследование. J Allergy Clin Immunol Pract. 2017 Май — июн; 5 (3): 757–63.
- Уайт К.Д., Эйб Р., Ардерн-Джонс М., Бичкофски Т., Бушар С., Карлтон Б. и др. SJS / TEN 2017: Создание междисциплинарных сетей для развития науки и перевода.J Allergy Clin Immunol Pract. 2018, январь — февраль; 6 (1): 38–69.
- Techasatian L, Panombualert S, Uppala R, Jetsrisuparb C. Лекарственный синдром Стивенса-Джонсона и токсический эпидермальный некролиз у детей: 20-летнее исследование в больнице третичного уровня. Мир J Pediatr. 2017 июн; 13 (3): 255–60.
- Бек А., Куирк К.П., Гамелли Р.Л., Мозье М.Дж. Детский токсический эпидермальный некролиз: использование SCORTEN и прогностических моделей для прогнозирования заболеваемости, когда недостаточно сосредоточиться на смертности. J Burn Care Res. 2015, январь-февраль; 36 (1): 167–77.
- Пикар Д., Джанела Б., Декамп В., Д’Инкан М., Курвиль П., Жако С. и др.Лекарственная реакция с эозинофилией и системными симптомами (DRESS): многоорганный противовирусный Т-клеточный ответ. Sci Transl Med. 2010 август; 2 (46): 46ra62.
- Мартинес-Кабриалес С.А., Родригес-Боланьос Ф., Shear NH. Лекарственная реакция с эозинофилией и системными симптомами (DReSS): как далеко мы зашли? Am J Clin Dermatol.2019 Апрель; 20 (2): 217–36.
- Чо Ю.Т., Чу С.Ю. Лечение тяжелых кожных побочных реакций. J Immunol Res. 2017; 2017: 1503709.
- Хотц С., Валери-Алланор Л., Хаддад С., Бувресс С., Ортонн Н., Дуонг Т.А. и др.Системное вовлечение острого генерализованного экзантематозного пустулеза: ретроспективное исследование с участием 58 пациентов. Br J Dermatol. 2013 декабрь; 169 (6): 1223–32.
- Kornmehl H, Gorouhi F, Konia T, Fung MA, Tartar DM. Обобщенная фиксированная лекарственная сыпь для пиперациллина / тазобактама и обзор литературы.Dermatol Online J. 2018 апр; 24 (4): 13030 / qt8cr714g5.
- Лабросс Р., Грэм Ф., Бегин П., Самаан К., Паради Л., Дес Рош А. и др. Педиатрический случай селективной фиксированной лекарственной сыпи амоксициллина. Pediatr Allergy Immunol. 2017 декабрь; 28 (8): 848–50.
- Ан Я, Демир В, Акдениз С.Фиксированная лекарственная сыпь, вероятно, вызванная азитромицином. Australas J Dermatol. 2017 ноя; 58 (4): e253–4.
- Can C, Akkelle E, Bay B, Arıcan O, Yalçın O, Yazicioglu M. Генерализованная фиксированная лекарственная сыпь у ребенка, вызванная триметопримом / сульфаметоксазолом. Pediatr Allergy Immunol. 2014 июн; 25 (4): 413–5.
- Дворжинский К., Ардерн-Джонс М., Нассер С.; Группа разработки рекомендаций; Национальный институт здравоохранения и передового опыта. Диагностика и лечение лекарственной аллергии у взрослых, детей и молодых людей: краткое изложение руководства NICE. BMJ. 2014 сентябрь; 349: g4852.
- Уитли Л. М., Плаут М., Шванингер Дж. М., Банерджи А., Кастельс М., Финкельман Ф. Д. и др.Отчет семинара Национального института аллергии и инфекционных заболеваний по лекарственной аллергии. J Allergy Clin Immunol. 2015 август; 136 (2): 262–71.e2.
- Co Minh HB, Bousquet PJ, Fontaine C, Kvedariene V, Demoly P. Системные реакции во время кожных проб с бета-лактамами: анализ факторов риска.J Allergy Clin Immunol. 2006 Февраль; 117 (2): 466–8.
- Pichichero ME, Pichichero DM. Диагностика аллергии на пенициллин, амоксициллин и цефалоспорин: надежность обследования оценивается с помощью кожных проб и перорального заражения. J Pediatr. 1998, январь; 132 (1): 137–43.
- Соленски Р., Джейкобс Дж., Лестер М., Либерман П., Маккафферти Ф., Нильссон Т. и др.Оценка аллергии на пенициллин: проспективная многоцентровая открытая оценка комплексного набора для кожных тестов на пенициллин. J Allergy Clin Immunol Pract. 2019 июль — август; 7 (6): 1876–85.e3.
- Мэйси Э., Нгор Э. В.. Безопасная диагностика клинически значимой аллергии на пенициллин с использованием только пенициллоил-полилизина, пенициллина и перорального амоксициллина.J Allergy Clin Immunol Pract. 2013 май-июнь; 1 (3): 258–63.
- Ibáñez MD, Rodríguez Del Río P, Lasa EM, Joral A, Ruiz-Hornillos J, Muñoz C и др .; Целевая группа по аллергии на пенициллин у детей (APENIN). Комитет детской аллергии, Испанское общество аллергии и клинической иммунологии (SEAIC).Проспективная оценка диагностических тестов детской аллергии на пенициллин: от истории болезни до контрольных тестов. Ann Allergy Asthma Immunol. 2018 август; 121 (2): 235–244.e3.
- Милл С., Примо М.Н., Медофф Е., Лейтеньи К., О’Киф А., Нетчипорук Е. и др. Оценка диагностических свойств градуированной оральной провокации для диагностики немедленных и немедленных реакций на амоксициллин у детей.JAMA Pediatr. 2016 июн; 170 (6): e160033.
- Ямматтео М., Альварес Аранго С., Ферастраоару Д., Акбар Н., Ли А.Ю., Коэн Х.В. и др. Безопасность и результаты перорального приема амоксициллина без предварительного кожного тестирования. J Allergy Clin Immunol Pract. 2019 Янв; 7 (1): 236–43.
- Бэнкс Т.А., Такер М., Мэйси Э.Оценка аллергии на пенициллин без кожных проб. Curr Allergy Asthma Rep.2019 Март; 19 (5): 27.
- Абрамс Э.М., Бен-Шошан М. Делегирование аллергии на пенициллин: требуется ли вообще кожная проба? J Allergy Clin Immunol Pract. 2019 Апрель; 7 (4): 1377.
- Бланка М., Романо А., Торрес М.Дж., Фернандес Дж., Майорга С., Родригес Дж. И др.Обновленная информация об оценке реакций гиперчувствительности на беталактамы. Аллергия. 2009 Февраль; 64 (2): 183–93.
- Мори Ф., Барни С., Пуччи Н., Росси Э., Аззари С., де Мартино М. и др. Чувствительность и специфичность кожных проб в диагностике аллергии на кларитромицин. Ann Allergy Asthma Immunol.2010 Май; 104 (5): 417–9.
- Cavkaytar O, Karaatmaca B, Yilmaz EA, Sekerel BE, Soyer O. Тестирование на гиперчувствительность к кларитромицину: диагностическая проблема в детстве. J Allergy Clin Immunol Pract. 2016 март-апрель; 4 (2): 330–2.e1.
- Торрес М.Дж., Адкинсон Н.Ф.-младший, Каубет Дж. К., Хан Д.А., Кидон М.И., Мендельсон Л. и др.; AAAAI / WAO 2018 Рабочая группа по тестированию аллергии на пенициллин и цефалоспорин. Споры в области лекарственной аллергии: тестирование гиперчувствительности к бета-лактамам. J Allergy Clin Immunol Pract. 2019 Янв; 7 (1): 40–5.
- Барни С., Мори Ф., Сарти Л., Пуччи Н., Росси Э.М., де Мартино М. и др.Полезность кожных проб у детей с историей немедленных реакций на амоксициллин. Clin Exp Allergy. 2015 Сен; 45 (9): 1472–4.
- Мори Ф., Чианферони А., Барни С., Пуччи Н., Росси М. Е., Новембре Е. Аллергия на амоксициллин у детей: пятидневный провокационный тест на лекарственные препараты при диагностике немедленных реакций.J Allergy Clin Immunol Pract. 2015 май-июнь; 3 (3): 375–80.e1.
- Сехон С, Недорость СТ. Патч-тестирование на побочные реакции на лекарства. Кутис. 2017 Янв; 99 (1): 49–54.
- Barbaud A, Collet E, Milpied B, Assier H, Staumont D, Avenel-Audran M и др.; Группа токсидермий Французского общества дерматологов. Многоцентровое исследование по определению ценности и безопасности пластырей для лечения трех основных классов тяжелых кожных побочных реакций на лекарства. Br J Dermatol. 2013 Март; 168 (3): 555–62.
- Торрес М.Дж., Романо А., Челик Дж., Демоли П., Хан Д.А., Мэйси Э. и др.Подход к диагностике реакций гиперчувствительности к лекарствам: сходства и различия между Европой и Северной Америкой. Clin Transl Allergy. 2017 Март; 7 (1): 7.
- Пинхо А., Коутиньо И., Гамейро А., Гувейя М., Гонсало М. Патч-тестирование — ценный инструмент для исследования не немедленных кожных побочных реакций на антибиотики.J Eur Acad Dermatol Venereol. 2017 Февраль; 31 (2): 280–7.
- Хаусманн О.В., Джентинетта Т., Бридтс СН, Эбо Д.Г. Тест активации базофилов при лекарственной аллергии немедленного типа. Immunol Allergy Clin North Am. 2009 август; 29 (3): 555–66.
- Абуаф Н., Ростан Х., Раджоэли Б., Гауар Х., Аутгарден Дж. Э., Лейнадье Ф. и др.Сравнение двух маркеров активации базофилов CD63 и CD203c в диагностике аллергии на амоксициллин. Clin Exp Allergy. 2008 июнь; 38 (6): 921–8.
- Пихлер В.Дж., Тилч Дж. Тест трансформации лимфоцитов в диагностике гиперчувствительности к лекарствам. Аллергия. 2004 август; 59 (8): 809–20.
- Мэйси Э., Контрерас Р. Побочные реакции, связанные с пероральным и парентеральным использованием цефалоспоринов: ретроспективный популяционный анализ. J Allergy Clin Immunol. 2015 Март; 135 (3): 745–52.e5.
- Ле Со Н., Робинсон Дж. Л.; Канадское педиатрическое общество, Комитет по инфекционным заболеваниям и иммунизации.Ведение острого среднего отита у детей от шести месяцев и старше. Педиатр детского здоровья. 2016, январь-февраль; 21 (1): 39–50.
- Кришна М.Т., Хьюссун А.П., Ли М., Рихтер А., Пиллэй Д.Г., Самбантан Д. и др. Повышение эффективности использования антибиотиков путем борьбы с «ложной» аллергией на пенициллин.Clin Exp Allergy. 2017 ноябрь; 47 (11): 1362–73.
- Abrams EM, Wakeman A, Gerstner TV, Warrington RJ, Singer AG. Распространенность бета-лактамной аллергии: обзор ретроспективной диаграммы оценки лекарственной аллергии в преимущественно педиатрической популяции. Allergy Asthma Clin Immunol. 2016 ноя; 12 (1): 59.
- Бланка М. Аллергические реакции на пенициллины. Меняющийся мир? Аллергия. 1995 Октябрь; 50 (10): 777–82.
- CDC: Назначение антибиотиков и их использование в кабинетах врача.
- Goossens H, Ferech M, Vander Stichele R, Elseviers M; Проектная группа ESAC. Амбулаторное использование антибиотиков в Европе и связь с устойчивостью: межнациональное исследование базы данных. Ланцет. 2005 февраль; 365 (9459): 579–87.
- Блюменталь К.Г., Лу Н, Чжан И, Ли И, Валенский Р.П., Чой Х.К.Риск метициллин-резистентного золотистого стафилококка и Clostridium difficile у пациентов с подтвержденной аллергией на пенициллин: согласованное когортное исследование на популяционной основе. BMJ. 2018 июн; 361: k2400.
- Центры по контролю и профилактике заболеваний.
- Мэйси Э., Контрерас Р.Использование медицинских услуг и распространенность серьезных инфекций, связанных с «аллергией» на пенициллин, у госпитализированных пациентов: когортное исследование. J Allergy Clin Immunol. 2014 Март; 133 (3): 790–6.
- Shaikh N, Dando EE, Dunleavy ML, Curran DL, Martin JM, Hoberman A, et al. Анализ экономической целесообразности 5 стратегий лечения острого среднего отита у детей.J Pediatr. 2017 октябрь; 189: 54–60.e3.
- Чен-младший, Тарвер С.А., Альварес К.С., Тран Т., Хан Д.А. Упреждающий подход к тестированию аллергии на пенициллин у госпитализированных пациентов. J Allergy Clin Immunol Pract. 2017 Май — июн; 5 (3): 686–93.
- Римави Р. Х., Кук П. П., Гуч М., Кабчи Б., Ашраф М. С., Римави Б. Х. и др.Влияние кожных проб на пенициллин на клиническую практику и применение антимикробных препаратов. J Hosp Med. 2013 июн; 8 (6): 341–5.
- King EA, Challa S, Curtin P, Bielory L. Кожные пробы на пенициллин у госпитализированных пациентов с аллергией на β-лактам: влияние на выбор антибиотика и стоимость.Ann Allergy Asthma Immunol. Июль 2016; 117 (1): 67–71.
- Блюменталь К.Г., Шеной Е.С., Вольфсон А.Р., Берковиц Д.Н., Карбалло В.А., Балекиан Д.С. и др. Устранение аллергии на бета-лактам в стационаре: реализация в нескольких больницах. J Allergy Clin Immunol Pract. 2017 Май — июн; 5 (3): 616–625.e7.
- Марвуд Дж., Агирребаррена Дж., Керр С., Уэлч С.А., Риммер Дж. Снятие маркировки самооценки аллергии на пенициллин в отделении неотложной помощи с помощью кожных тестов и пероральных тестов на провокацию лекарств. Emerg Med Australas. 2017 Октябрь; 29 (5): 509–15.
- Krey SC, Waise J, Skrupky LP.Противодействие проблеме бета-лактамной аллергии: квазиэкспериментальное исследование, оценивающее влияние вмешательств под руководством аптек. J Pharm Pract. 2019 Апрель; 32 (2): 139–46.
- Кларк К.Э., Брианд М.Э., Капур О., Пирастех А. Влияние стандартизированного опросника по аллергии на бета-лактамные продукты на использование азтреонама.J Pharm Pract. 2018 Янв; 8971758557.
- Бланка М., Торрес М.Дж., Гарсия Дж.Дж., Романо А., Майорга С., де Рамон Э. и др. Естественная эволюция чувствительности кожных проб у пациентов с аллергией на бета-лактамные антибиотики. J Allergy Clin Immunol. 1999 Май; 103 (5 Pt 1): 918–24.
Автор Контакты
Доктор.Моше Бен-Шошан
Отделение педиатрии, Отделение аллергии, клинической иммунологии и дерматологии
Детская больница Монреаля, Университет Макгилла, 1001 Декари
Монреаль, КК h5A 3J1 (Канада)
Эл. Почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 4 июня 2019 г.
Дата принятия: 17 июня 2019 г.
Опубликована онлайн: 8 августа 2019 г.
Дата выпуска: сентябрь 2019 г.
Количество страниц для печати: 10
Количество рисунков: 2
Количество столов: 1
ISSN: 1018-2438 (печатный)
eISSN: 1423-0097 (онлайн)
Для дополнительной информации: https: // www.karger.com/IAA
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако с учетом продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Почему мы любим амоксициллин — Партнеры по педиатрии и подросткам
Вы когда-нибудь задумывались, почему амоксициллин является антибиотиком первого ряда, который мы выбираем при инфекциях уха, носовых пазухах и стрептококковой инфекции горла? Иногда кажется, что амоксициллин получает плохую репутацию, потому что некоторые люди считают, что он «никогда не работает» на них, но на самом деле амоксициллин является отличным антибиотиком для большинства детей.Вот некоторые из причин, почему:
1. Амоксициллин относится к группе антибиотиков пенициллинового ряда. Он охватывает наиболее распространенные бактерии, вызывающие инфекции уха, носовые пазухи и ангины. Он также может быть эффективен при пневмонии.
2. Это довольно узкий спектр, что означает, что он не убивает так много других бактерий в организме. Это важно, потому что большинство бактерий в нашем организме помогает нам оставаться здоровыми. Убийство этих полезных бактерий вызывает у нас боли в животе, диарею и дрожжевые инфекции при приеме антибиотиков.Амоксициллин с меньшей вероятностью, чем большинство других антибиотиков, вызывает эти побочные эффекты.
3. Вкус хороший. Дети часто просят «лекарство из розовой жевательной резинки!» (Вы можете спросить, почему мы используем амоксициллин вместо старого пенициллина. Причина: жидкий пенициллин ужасен на вкус!)
4. Это недорого. 10-дневный курс амоксициллина можно приобрести за 4-8 долларов в Walmart и бесплатно в Meijer.
5. Его не нужно хранить в холодильнике (хотя он вкуснее, если бы был в холодильнике, поэтому по возможности рекомендуется хранить его в холодильнике).
Так почему же некоторые люди говорят, что «амоксициллин никогда не помогает»? У детей, которые принимали повторно антибиотики (или которые находятся в детском саду с другими детьми, которые получали повторные антибиотики), бактерии могут становиться все более устойчивыми. Это означает, что для уничтожения болезнетворных бактерий требуются более высокие дозы антибиотика или антибиотики широкого спектра («более сильные»). Для детей, которым требуется повторный курс антибиотиков в течение короткого периода времени, мы обычно пытаемся чередовать антибиотики, поскольку это, по-видимому, помогает снизить развитие резистентности (т.е. заставляет бактерии «гадать»). Мы следуем одному общему правилу: если ребенок принимал амоксициллин в течение предыдущих 6-8 недель, мы выберем что-нибудь более сильное для последующего курса антибиотиков. Однако, если с момента последнего курса антибиотиков прошло более 6-8 недель, то резистентность часто снижается, и мы постараемся вернуться к использованию амоксициллина.
Одним из источников путаницы для многих является использование амоксициллина при стрептококковой инфекции горла по сравнению с ушными инфекциями и инфекциями носовых пазух.Обычно резистентность к амоксициллину является проблемой только при инфекциях уха и носовых пазух. Бактерии, вызывающие стрептококк в горле (стрептококк группы А), почти всегда чувствительны к амоксициллину, поэтому даже дети, у которых нет хороших результатов при лечении амоксициллина при инфекциях уха и носовых пазух, должны иметь возможность принимать амоксициллин при ангины. Вы также можете заметить, что дозировка, которую мы используем для лечения ангины, ниже, чем дозировка, которую мы используем при инфекциях уха и носовых пазух. Это связано с тем, что бактерии стрептококка группы А легче поддаются лечению.
Одна из ситуаций, в которой вы можете увидеть, как мы используем антибиотики широкого спектра действия первой линии для лечения инфекций уха или носовых пазух, — это когда эти инфекции сопровождаются «розовым глазом». Наличие «розового глаза» часто указывает на то, что действуют более устойчивые бактерии, и амоксициллин может быть не лучшим антибиотиком (хотя иногда он все еще может работать).
Конечно, важно иметь в виду, что все антибиотики необходимо использовать разумно, чтобы они оставались эффективными. Я всегда удивляюсь тому, что так много людей хотят, чтобы их ребенок прописал антибиотики — это дороговизна, неудобства, побочные эффекты! Я в любой момент возьму вирус из-за бактериальной инфекции, требующей антибиотиков для моих собственных детей.Мне всегда интересно, что люди думают, что мы, педиатры, настолько удачливы, потому что можем прописать антибиотики нашим детям в любое время. Поверьте мне, наши дети получают гораздо меньше антибиотиков, чем средний ребенок, потому что мы не хотим, чтобы наши дети принимали их! А когда моему ребенку нужен антибиотик, я предпочитаю амоксициллин остальным.
Важные вещи, которые следует помнить, чтобы избежать ненужных антибиотиков для вашего ребенка:
1. Антибиотики не лечат вирусы.Вирусы на какое-то время делают нас несчастными, но в конце концов наш организм борется с ними без посторонней помощи. Они «идут своим чередом».
2. Простуда обычно длится 1,5–2 недели, а иногда и 3 недели. Если ваш ребенок не чувствует себя плохо или у него лихорадка с симптомами простуды в 2 недели, дайте ему еще неделю и посмотрите, не пройдет ли ситуация сама по себе. Если простуда длится более 3 недель, вашего ребенка следует осмотреть.
3. Желтая или зеленая слизь из носа не указывает на необходимость приема антибиотиков.Вирусы вызывают желто-зеленую слизь так же часто, как и бактерии.
4. Вирусы могут вызывать синусит (симптомы головной боли, лицевого давления и т. Д.).
5. Дети старшего возраста с ушными инфекциями выздоравливают самостоятельно в 80% случаев. Если вашему ребенку не менее 2 лет и у него только легкие симптомы ушной инфекции, вы можете попробовать подождать несколько дней дома, чтобы посмотреть, улучшится ли положение без лечения. Очевидно, что если у вашего ребенка сильная боль в ушах или жар, его следует осмотреть в офисе.
6. Бронхит обычно вирусный и не требует антибиотиков.
7. Пожалуйста, не заставляйте нас прописывать антибиотики! Мы действительно хотим, чтобы вы были довольны заботой, которую получает ваш ребенок, и если мы чувствуем, что вы не будете счастливы без антибиотика, мы окажемся в неприятном эмоциональном затруднении, если мы не будем думать, что антибиотик нужен. Кроме того, если вы надеетесь избежать приема антибиотиков, сообщите нам об этом словесно, так как это снимает часть нашего давления, которое мы испытываем, чтобы прописать что-то и попытаться сделать ребенка волшебным образом лучше!
Итак, подведем итог: Мы хотим по возможности избегать применения антибиотиков.Когда нам действительно нужны антибиотики, мы хотим использовать антибиотики самого узкого спектра действия, чтобы снизить риск побочных эффектов и резистентности.
